
- •ПРЕДИСЛОВИЕ
- •ГЛАВА 1. ВЫСОКОТЕМПЕРАТУРНАЯ ФИКСАЦИЯ АЗОТА
- •ХОЛОДИЛЬНЫЕ ЦИКЛЫ
- •Холодильный цикл среднего давления с расширением воздуха в детандере (цикл Клода)
- •ФИЗИКО-ХИМИЧЕСКИЕ ОСНОВЫ ПРОЦЕССОВ КОНВЕРСИИ ПРИРОДНОГО ГАЗА
- •РАВНОВЕСИЕ РЕАКЦИЙ КОНВЕРСИИ МЕТАНА ВОДЯНЫМ ПАРОМ
- •КАТАЛИЗАТОРЫ КОНВЕРСИИ МЕТАНА
- •Кинетика конверсии метана
- •КОНВЕРСИЯ ОКСИДА УГЛЕРОДА (II)
- •КАТАЛИЗАТОРЫ КОНВЕРСИИ ОКСИДА УГЛЕРОДА (II)
- •КИНЕТИКА КОНВЕРСИИ ОКСИДА УГЛЕРОДА (II)
- •ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ КОНВЕРСИИ ПРИРОДНОГО ГАЗА
- •ОСНОВНОЕ ТЕХНОЛОГИЧЕСКОЕ ОБОРУДОВАНИЕ ПРОЦЕССОВ КОНВЕРСИИ ПРИРОДНОГО ГАЗА
- •Очистка газов от диоксида углерода водными растворами аминоспиртов
- •Очистка газов от диоксида углерода водными растворами карбонатов щелочных металлов
- •ОЧИСТКА КОНВЕРТИРОВАННОГО ГАЗА ОТ ОКСИДА УГЛЕРОДА (II)
- •РАВНОВЕСИЕ РЕАКЦИИ СИНТЕЗА АММИАКА
- •КАТАЛИЗАТОРЫ СИНТЕЗА АММИАКА
- •КИНЕТИКА СИНТЕЗА АММИАКА
- •ВЫДЕЛЕНИЕ АММИАКА ИЗ ПРОРЕАГИРОВАВШЕЙ АЗОТОВОДОРОДНОЙ СМЕСИ
- •ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ СИНТЕЗА АММИАКА
- •ТЕХНОЛОГИЧЕСКОЕ ОБОРУДОВАНИЕ БЛОКА СИНТЕЗА АММИАКА
- •Теплообменная аппаратура
- •Аппаратура для выделения жидкого аммиака
- •Пути совершенствования схем синтеза аммиака
- •ГЛАВА 6. ПРОИЗВОДСТВО АЗОТНОЙ КИСЛОТЫ
- •ОКИСЛЕНИЕ АММИАКА
- •ОКИСЛЕНИЕ ОКСИДА АЗОТА (II)
- •ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ ПОЛУЧЕНИЯ АЗОТНОЙ КИСЛОТЫ
- •ПРОИЗВОДСТВО КОНЦЕНТРИРОВАННОЙ АЗОТНОЙ КИСЛОТЫ
- •Прямой синтез концентрированной азотной кислоты
- •ГЛАВА 7. ПРОИЗВОДСТВО АЗОТНЫХ УДОБРЕНИЙ
- •ПРОИЗВОДСТВО СУЛЬФАТА АММОНИЯ
- •ПРОИЗВОДСТВО НИТРАТА АММОНИЯ
- •ПРОИЗВОДСТВО КАРБАМИДА
- •ТЕХНОЛОГИЧЕСКИЕ СХЕМЫ СИНТЕЗА КАРБАМИДА
- •ЖИДКИЕ АЗОТНЫЕ УДОБРЕНИЯ
- •ЛИТЕРАТУРА
- •ОГЛАВЛЕНИЕ
ГЛАВА 7. ПРОИЗВОДСТВО АЗОТНЫХ УДОБРЕНИЙ
Соединения азота играют огромную роль в минеральном питании растений. Азот входит в состав белков, являющихся основой растительной ткани, а также в состав хлорофилла, с помощью которого растения ассимилируют углерод из находящегося в атмосфере диоксида углерода. Содержание азота в зерне составляет 1,8–2,1%, в соломе – 0,5%, в клубнях картофеля – 0,2–0,3%, в листьях и ботве – 0,4–0,5%.
Ежегодный вынос азота из почвы с урожаем сельскохозяйственных культур в зависимости от вида культуры и величины урожая колеблется от 50–300 кг/га. В связи с этим для поддержания и повышения урожайности сельскохозяйственных культур необходимо ежегодно вносить в почву вещества, содержащие в своем составе азот, в форме, доступной для усвоения растений. Эти вещества называются азотными удобрениями. Азотные удобрения подразделяются на аммиачные, в которых азот содержится в виде свободного аммиака или аммиакатов; аммонийные – азот содер-
жится в виде катиона NH 4 ; нитратные – азот содержится в виде аниона NO3 , и амидные, в них азот содержится в виде амино-
группы NH2 .
К числу азотных удобрений относится жидкий и водный аммиак, сульфат, нитрат и фосфаты аммония, нитраты натрия и кальция, карбамид и их смеси. Все азотные удобрения хорошо растворимы в воде, поэтому азот из них легко усваивается растениями. Сырьем для получения аммиачных, аммонийных и амидных удобрений является аммиак, для нитратных удобрений – азотная кислота. Эти вещества получают из элементарного азота, запасы которого в атмосфере практически неограничены. Качество азотных удобрений оценивается по содержанию азота, величине растворимости в воде, по физиологическому действию на почвенные растворы, по гранулометрическому составу, гигроскопичности, слеживаемости, а также по термической устойчивости. Наибольшее применение в качестве азотных удобрений получили сульфат, нитрат аммония, карбамид и их смеси, поэтому в настоящем пособии ограничимся рассмотрением только этих соединений.

Производство азотных удобрений |
169 |
ПРОИЗВОДСТВО СУЛЬФАТА АММОНИЯ
Свойства сульфата аммония. Сульфат аммония (NH4)2SO4 –
бесцветное кристаллическое вещество плотностью 1769 кг/м3, содержит 21,21% азота. При нагревании выше 200°С разлагается с выделением аммиака и образованием кислых сульфатов аммония. Полная диссоциация сульфата аммония на аммиак и серную кислоту происходит при 513°С. Растворимость в воде мало зависит от температуры и характеризуется данными, представленными в табл. 22.
Таблица 22
Зависимость растворимости сульфата аммония в воде от температуры
Температура, °С |
0 |
20 |
40 |
60 |
80 |
100 |
Растворимость, % мас. |
41,4 |
43,0 |
44,8 |
46,8 |
48,8 |
50,8 |
Сульфат аммония – малогигроскопичное вещество, практически не слеживается, поэтому внесение его в почву не вызывает затруднений. Недостатком сульфата аммония как удобрения является большая физиологическая кислотность, так как при внесении в почву ион аммония усваивается растениями, а ион
SO24 превращается в серную кислоту и подкисляет почвенные
растворы. В связи с этим при систематическом применении сульфата аммония необходимо осуществлять периодическое известкование почвы.
Способы получения сульфата аммония. Основным способом получения сульфата аммония является нейтрализация серной кислоты аммиаком по реакции
2NH3 + H2SO4 = (NH4)2SO4 + 274 кДж.
Эта реакция относится к числу реакций нейтрализации. Она практически необратима и сопровождается выделением большого количества тепла. Величина теплового эффекта реакции зависит от концентрации серной кислоты. При использовании 100%-ной серной кислоты и чистого газообразного аммиака тепловой эффект составляет 274 кДж/моль (NH4)2SO4. При использовании водных растворов серной кислоты величина теплового эффекта уменьшается на теплоту разбавления серной кислоты и теплоту

170 |
Глава 7 |
растворения сульфата аммония. Образуются водные растворы сульфата аммония, которые должны подвергаться выпарке, поэтому для уменьшения энергетических затрат теплота нейтрализации используется для испарения воды. При высоких концентрациях серной кислоты количества выделяющегося тепла вполне достаточно для полного испарения воды, поэтому сульфат аммония может быть получен «сухим» безупарочным методом. Однако этот метод не нашел промышленного применения из-за низкого содержания азота в сульфате аммония и большого расхода серной кислоты, которая входит в состав удобрения в виде балласта и не усваивается растениями, а подкисляет почву. Поэтому синтетический аммиак перерабатывают в более концентрированные удобрения – нитрат, фосфаты аммония и карбамид. Для производства сульфата аммония используют аммиаксодержащие газы, являющиеся побочными продуктами других производств, в частности коксовый газ, который содержит от 6– 14 г/м3 NH3. Выделение аммиака из коксового газа осуществляется путем абсорбции разбавленными растворами серной кислоты в барботажных или распыливающих аппаратах с получением растворов сульфата аммония и последующей выпаркой и кристаллизацией продукта.
При нейтрализации серной кислоты аммиаком наряду со средней солью (NH4)2SO4 могут образоваться кислые сульфаты аммо-
ния 4(NH4)2SO4 · H2SO4, 3(NH4)2SO4 · H2SO4, (NH4)2SO4 · H2SO4 и
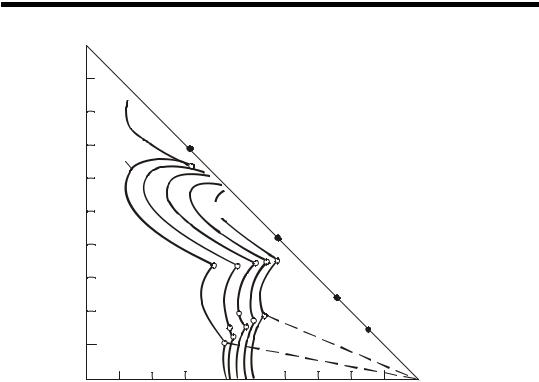
(NH4)2SO4 · 3H2SO4. Диаграмма растворимости в системе (NH4)2SO4 – H2SO4 – Н2О представлена на рис. 36.
Поле кристаллизации средней соли (NH4)2SO4 лежит в области a1E1c при 10°С и a2E2c при 90°С. Поэтому во избежание образования кислых солей содержание H2SO4 в жидкой фазе должно быть меньше, чем в точках Е, т. е. меньше 11,08% при 10°С и 19,77% при 90°С.
Следовательно, процесс нейтрализации необходимо проводить полностью. Однако техническая серная кислота содержит в своем составе примеси, в частности сульфаты железа и алюминия. При полной нейтрализации серной кислоты будут происходить следующие реакции:
Fe2(SO4)3 + 6NH3 + 6H2O = 2Fe(OH)3 + 3(NH4)2SO4; Al2(SO4)3 + 6NH3 + 6H2O = 2Al(OH)3 + 3(NH4)2SO4.
H SO , % 2 4
Производство азотных удобрений |
171 |
H2SO4
80 |
5 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(NH ) SO 3H |
|
SO |
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
2 |
|
|
|
|
|
|
|
|
|
|
||||||||
|
10 С |
4 |
2 |
|
4 |
|
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
60 |
30 50 |
70 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
90 С |
|
|
|
(NH ) SO H SO |
|
|
|
|
|
|
||||||||
|
4 |
|
|
|
|
|
4 |
|
|
|
|
|
||||||||
40 |
|
|
|
|
|
|
|
4 |
2 |
4 |
2 |
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3(NH ) SO H SO |
4 |
|
|||||||
|
|
3 |
|
|
|
|
|
|
|
|
|
4 |
2 |
|
4 |
|
2 |
|
|
|
20 |
|
|
|
E2 |
|
|
|
|
4(NH ) SO |
H SO |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
4 |
||||||||
|
|
E1 |
|
|
|
|
|
|
|
|
|
|
|
|
4 |
2 |
4 |
|
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C11 |
|
|
C2 |
|
|
|
|
|
|
|
|
|
|
С |
|
|
|
|
|
20 |
40 |
|
|
|
60 |
|
|
|
80 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
|
(NH ) SO |
|
|
|||||||||
|
|
(NH ) SO |
|
, % |
|
|
|
|
|
|
4 |
2 |
4 |
|
|
|||||
|
|
4 |
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
4 |
2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 36. Изотермы растворимости в системе
(NH4)2SO4 – H2SO4 – Н2О при 10, 30, 50, 70 и 90°С
В результате этих реакций образуются коллоидные гидроксиды железа и алюминия, которые осаждаются на поверхности кристаллов сульфата аммония и тормозят их рост. Эти факты необходимо учитывать при выборе условий нейтрализации. В практических условиях концентрацию серной кислоты в конечных растворах поддерживают на уровне от 4 до 10% мас. Поглощение аммиака из коксового газа можно осуществлять в сатураторах барботажного типа или в скрубберах распыливающего типа. Технологическая схема получения сульфата аммония бессатураторным методом представлена на рис. 37.
По этой схеме аммиак из коксового газа улавливается в полом скруббере 2, снабженном брызгалами 3. Скруббер разделен на две секции. Нижняя секция орошается раствором, содержащим 3–4% H2SO4, а верхняя – раствором, содержащим 10–12% H2SO4. Серная кислота и вода поступают в сборник 4, откуда циркуляционным насосом 5 подаются на орошение верхней части скруббера.

172 |
Глава 7 |
Коксовый газ на переработку
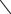 1
1
Коксовыйгаз |
11 |
12 |
К вакуумэжектору
2
3 Серная |
|
|
6 |
7 |
Вода |
|
|
||
|
Пар |
|
||
кислота |
|
|
|
|
|
|
Конденсат |
|
Готовый |
|
4 |
|
продукт |
|
|
|
|
на сушку |
|
|
5 |
|
8 |
и в склад |
10
 9
9
Рис. 37. Схема производства сульфата аммония из аммиака коксового газа бессатураторным методом:
1 – ловушка; 2 – скруббер; 3 – брызгалы; 4, 10, 11 – сборники; 5, 8, 9, 12 – насосы; 6 – выпарной аппарат; 7 – центрифуга
Часть этого раствора передается в сборник 11 и циркулирует в нижней части скруббера с помощью насоса 12. Сюда же поступает маточный раствор с центрифуги 7. Из нижней части скруббера отбирается раствор, содержащий 40% (NH4)2SO4, и поступает в сборник 10, откуда насосом 9 подается в вакуум-выпарной аппарат 6, где происходит кристаллизация сульфата аммония. Образовавшаяся суспензия из выпарного аппарата подается на фильтрацию в центрифугу 7. Продукт, имеющий влажность 2–3%, подвергают сушке в аппаратах с кипящим слоем, а маточный раствор возвращают в цикл.
Такие установки функционируют на коксохимических заводах. В Республике Беларусь коксохимические заводы отсутствуют, поэтому сульфат аммония производят на ОАО «Гродно Азот» в качестве побочного продукта при производстве капролактама. Завершающими стадиями этого производства являются оксимирование циклогексанона путем его обработки водным раствором гидроксиламинсульфата с последующей изомеризацией циклогексаноксима в капролактам по схеме

Производство азотных удобрений |
173 |
CH2 |
–CH2 |
|
2NH2OH H2SO4 |
|
|
Олеум |
||
–C=O CH2 –CH2 –C=N–OH |
||||||||
|
|
|
|
|
|
|
|
|
CH2 |
–CH2 |
–CH2 |
CH2 –CH2 –CH2 |
|||||
циклогексанон |
циклогексаноксим |
|||||||
|
|
|
|
Олеум |
|
|
|
|
|
|
|
|
CH2 –CH2 –C=O |
||||
|
|
|
|
|
|
|
NH |
|
|
|
|
|
|
|
–CH2 –CH2 |
||
|
|
|
|
CH2 |
||||
|
|
|
|
|
капролактам |
|||
На стадии оксимирования гидроксиламинсульфат нейтрализуют аммиаком по реакции
2NH2OH · H2SO4 + 2NH3 = 2NH2OH + (NH4)2SO4.
Образовавшийся гидроксиламин вступает во взаимодействие
сциклогексаноном с образованием циклогексаноксима, который отделяют от водного раствора сульфата аммония и обрабатывают олеумом для изомеризации в капролактам. После завершения изомеризации серную кислоту нейтрализуют аммиаком с образованием лактамного масла и раствора сульфата аммония, которые расслаиваются на водную и органическую фазы. Таким образом, на стадиях оксимирования и нейтрализации олеума получают водный раствор сульфата аммония с концентрацией 34–43%. Этот раствор подвергают выпарке в выпарных аппаратах с кристаллорастителями, что обеспечивает получение крупнокристаллического сульфата аммония с размером кристаллов 0,5–1,5 мм. Образовавшиеся кристаллы отделяют на центрифугах и подвергают сушке в аппаратах с кипящим слоем.
Вописанных процессах первой стадией является нейтрализация серной кислоты аммиаком с получением водных растворов сульфата аммония, которые подвергаются выпарке и кристаллизации. Наряду
сэтими способами сульфат аммония может быть получен без затрат серной кислоты конверсионным методом с использованием в качестве исходного сырья природного гипса или фосфогипса, являющегося отходом производства экстракционной фосфорной кислоты. Конверсию гипса в сульфат аммония осуществляют водным раствором карбоната аммония при 50–55°С по реакции
CaSO4 + (NH4)2CO3 = CaCO3 + (NH4)2SO4.
Эта реакция смещена вправо, поскольку растворимость карбоната кальция меньше, чем сульфата кальция. После отделения
