
- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
2. Приготовление растворов заданной концентрации разбавлением
Пример. Приготовить 20 мл раствора с содержанием 0,1 моль/лNaОН из раствора с содержанием 0,5 моль/л NaОН.
Решение. Находим массу NaОН, которая должна содержаться в 20 мл раствора с концентрацией 0,1 моль NaОН.
В 1000 мл р-ра (0,1 моль/л NaОН) содержится 4 г NaОН,
В 20 мл р-ра (0,1 моль/л NaОН) содержится х г NaОН,
тогда х =
![]() = 0,08 г
= 0,08 г
Далее находим объем (мл) раствора с концентрацией 0,5 моль/л, в котором содержится 0,08 г NaОН.
20 г NaОН содержится в 1000 мл р-ра (0,5 моль/л NaОН)
0,08 г NaОН содержится в y мл р-ра (0,5 моль/л NaОН)
тогда у =
![]() = 4 мл
= 4 мл
Следовательно, чтобы приготовить 20 мл раствора с содержанием 0,1 моль/л NaОН надо взять 4 мл раствора с содержанием 0,5 моль/л NaОН и прилить 16 мл воды (20мл – 4 мл).
3. Приготовление раствора промежуточной концентрации из
двух растворов большей и меньшей концентрации
Пример. В каких массовых отношениях надо смешать 20%-ный раствор и 5%-ный раствор NaОН, чтобы получить 10%-ный раствор?
Решение. Допустим, надо взять Х массовых частей 20%-ного раствора и у массовых частей 5%-ного раствора. Количество массовых частей растворенного вещества в 20%-ном растворе:
![]() = 0,2х.
= 0,2х.
Количество
массовых частей растворенного вещества
в 5%-ном растворе равно:
![]() =
0,05у
=
0,05у
Количество массовых частей растворенного вещества в 10%-ном растворе равно: 0,1 (х+у).
Масса растворенного вещества до сливания равна массе растворенного вещества после сливания.
Составляем и решаем уравнение: 0,2х + 0,05у = 0,1 (х+у)
0,2х + 0,05у = 0,1 (х+у)
0,2х – 0,1х = 0,1у – 0,05у
0,1х = 0,05у
![]() =
=![]()
![]() =
=![]()
Следовательно, 20%-ного раствора надо взять 1 массовую часть, а 5%-ного раствора - 2 массовых части.
Когда не требуется особенной точности для разбавления растворов или смешивания их для получения растворов другой концентрации, можно воспользоваться следующим простым и быстрым способом, используя диагональную схему (правило креста).
«Правило креста»
В центре схемы пишут искомую концентрацию. Пишем вначале так:
 20
20
 10%, где 20 и
5 – процентные концентрации исходных
10%, где 20 и
5 – процентные концентрации исходных
5 растворов.

 Теперь из 20
вычитаем 10, и полученное значение пишем
в правом нижнем углу, вычитая 5 из 10,
пишем полученную цифру в правом верхнем
углу. Схема примет вид: 20
5, т.е. нужно взять 5 мас-
Теперь из 20
вычитаем 10, и полученное значение пишем
в правом нижнем углу, вычитая 5 из 10,
пишем полученную цифру в правом верхнем
углу. Схема примет вид: 20
5, т.е. нужно взять 5 мас-
10

5 10
совых частей 20%-ного раствора и 10 массовых частей 5%-ного раствора или 1 массовую часть 20%-ного раствора и 2 массовых части 5%-ного раствора.
Экспериментальная часть
Измерительными приборами, применяемыми в объемном анализе, служат мерная колба, пипетка и бюретка.
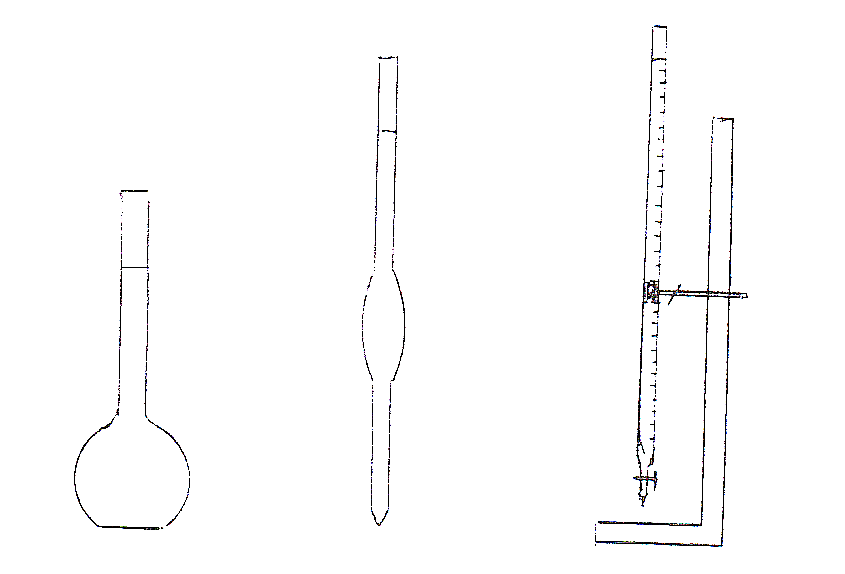
Рис. 1 а) б) в)
Мерная колба – круглая плоскодонная колба с узким горлом, плотно закрывающимся пробкой (рис. 1а). На горле имеется метка, а на самой колбе указан ее рабочий объем и температура, при которой производилась градуировка.
Для приготовления растворов данной концентрации определенный объем жидкости при помощи пипетки переносят в мерную колбу, доливают водой до метки и перемешивают. Отсчет уровня жидкости в мерной колбе производится по нижнему мениску. Уровень жидкости прозрачных растворов устанавливают по нижнему краю мениска, а непрозрачных – по верхнему краю мениска.
Для перемешивания раствора в колбе ее плотно закрывают пробкой, переворачивают вверх дном и, держа одной рукой за круглую часть, другой – за пробку, несколько раз сильно встряхивают.
Пипетка – стеклянная трубка с расширением в средней части и меткой в верхней части (рис.1б). Нижняя часть пипетки заканчивается оттянутым кончиком. На расширенной или верхней частях указывают ее рабочий объем и температуру калибровки (рис. 1б). Чтобы наполнить пипетку, надо втянуть в нее резиновой грушей жидкость выше метки и быстро закрыть указательным пальцем правой руки ее верхнее отверстие.
Вынув пипетку из жидкости и держа ее над ним вертикально, установить глаз на вертикальном уровне с меткой пипетки. Осторожным движением указательного пальца дать вытекать жидкости из пипетки до тех пор, пока нижний край мениска не опустится до метки; в этот момент следует плотно закрыть пальцем отверстие пипетки и перелить в сосуд. После вытекания раствора из пипетки остающуюся каплю жидкости в ее кончике удаляют, коснувшись кончиком пипетки стенки того сосуда, в который выливается жидкость.
Бюретка – узкая трубка с делениями, отмеривающая объем вытекающей жидкости (рис.1в). Емкость бюреток различна – от 5 до 100 мл. Бюретки заполняются жидкостью через воронку с коротким концом, таким, чтобы он не доходил до нулевого деления бюретки. Затем открывают кран или зажим и заполняют раствором часть бюретки, расположенную ниже крана. Это нужно проделывать тщательно, чтобы в отводной части бюретки не оставалось пузырьков воздуха. Бюретки следует заполнять, чтобы вначале уровень жидкости был несколько выше нулевого деления шкалы, затем, осторожно приоткрывая кран, устанавливают уровень жидкости на нулевой отметке.
Опыт 1. Определение массовой доли соли в растворе по его относительной плотности, измеренной ареометром (рис.2).
Ознакомьтесь с устройством ареометра. Ареометры калибруются при 200С, поэтому, если температура испытуемого раствора отличается от 200С, следует нагреванием или охлаждением довести ее до 200С. Налейте в цилиндр около 250 мл испытуемого раствора соли при 200С и осторожно опустите в него ареометр. Отмерьте по шкале ареометра его показание. Ареометр не должен касаться стенок цилиндра. Приподняв ареометр на 1-2 см, вновь его опустите в раствор, еще раз определите показание. (Повторите это три раза). Раствор вылейте в склянку, вымойте ареометр.
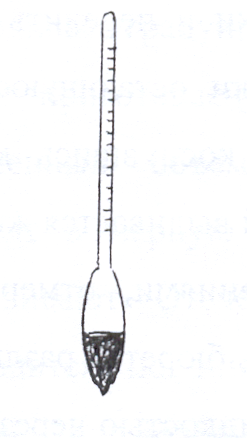
Рис.2.
Таблица 1
