
- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
Методы определения концентрации растворов
Концентрацию растворов можно определять различными методами:
1) По плотности раствора, когда не требуется большой точности;
2) Титрованием, если значение концентрации необходимо определить с точностью до 0,01%.
Плотность раствора определяется по формуле:
![]() ,
,
где m – масса раствора, г;
V – объем раствора, мл.
Определение плотности проще всего производить при помощи ареометра. Не существует универсального ареометра. Каждый ареометр предназначен для жидкостей, значения плотностей которых лежат в определенных пределах. Поэтому при выборе ареометра необходимо, чтобы ориентировочное значение плотности данного раствора попадало в интервал шкалы данного ареометра.
Так как плотность раствора обусловлена его концентрацией, то измерив ареометром плотность, можно по таблицам найти массовую долю растворённого вещества в растворе (таб.1).
Титрование – определение неизвестной концентрации одного раствора по известной концентрации другого путем измерения объемов реагирующих растворов.
Согласно закону эквивалентов вещества вступают и образуются в результате реакции в эквивалентных количествах. Следовательно, в процессе титрования νэ(1)=νэ(2). Выразим количества эквивалентов реагирующих веществ через объемы (V) растворов и молярные концентрации их эквивалентов Сэ, тогда
V(1)
∙ Сэ(1)
= V(2)
∙ Сэ(2),
или
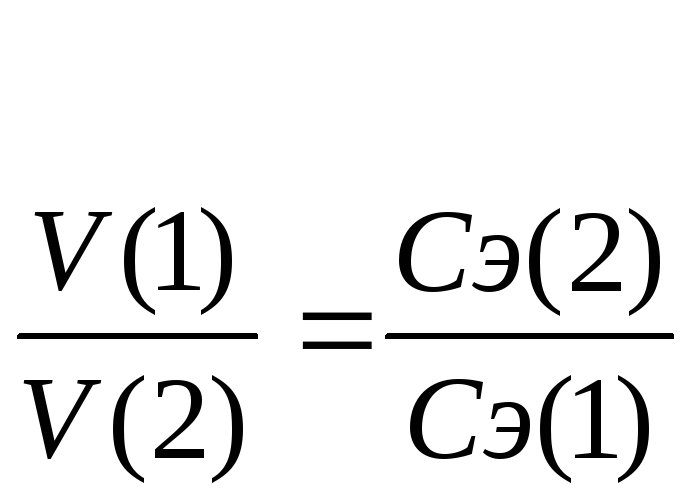 (11)
(11)
Эти два соотношения называются формулами титрования.
Способы приготовления растворов заданной концентрации
Растворы заданной концентрации можно приготовить различными способами:
1. Растворением вещества в растворителе
Пример 1. Приготовить 50 г 5% раствора хлорида натрия NaCl.
Решение. Для этого необходимо рассчитать, какую массу (г) хлорида натрия и массу воды (г) нужно взять для приготовления 50 г 5% раствора.
По определению
массовой доли в 100 г 5% раствора содержатся
5 г хлорида натрия, а в 50 г 5% раствора
будет содержаться Х г хлорида натрия.
Отсюда: Х =
![]() = 2,5гNaCl,
тогда легко вычислить массу воды:
= 2,5гNaCl,
тогда легко вычислить массу воды:
50г – 2,5г = 47,5г.
Если
воспользоваться формулой (2), то решение
будет следующим: ω
=
![]() ∙ 100% →
∙ 100% →
→ m( р.в. )= ω ∙ m (р-ра) /100% = 5% ∙ 50 г / 100% = 2,5 г
m (H2O) = m (р-ра) – m (р.в.) = 50 г – 2,5 г = 47,5 г
Таким образом, для приготовления раствора данной концентрации, необходимо на весах взвесить 2,5г NaCl и растворить его в 47,5 мл воды (учитывая, что плотность воды равна 1 г/мл, объем воды будет равен ее массе).
Пример 2. Приготовить 100 мл раствора сульфата меди с молярной концентрацией 0,1 моль/л сульфата меди.
Решение. По определению молярной концентрации в 1000 мл раствора содержится 0,1 моль CuSO4, а в 100 мл раствора будет содержаться х моль CuSO4.
х =
![]() = 0,01 моль
= 0,01 моль
Из соотношения (4) следует m= ν∙М, т.к. М (CuSO4) = 160 г/моль, то m = 0,01 моль ∙160 г/моль = 1,6 г
Если воспользоваться формулой (5), то решение будет следующим:
С
=![]() → m
= С ∙ М ∙ V
= 0,01моль/л ∙ 160 г/моль ∙ 0,1 л = 1,6 г
→ m
= С ∙ М ∙ V
= 0,01моль/л ∙ 160 г/моль ∙ 0,1 л = 1,6 г
Таким образом, для того, чтобы приготовить 100 мл раствора с концентрацией 0,1 моль/л CuSO4, необходимо на весах взвесить 1,6 г CuSO4, перенести в мерную колбу на 100 мл и довести объем раствора в колбе до метки.
Пример 3. Приготовить 200 мл раствора NaОН с 0,5 молярной концентрацией эквивалента NaОН.
Решение.
Из уравнения (7) находим массу NaОН
Сэ
=
![]() →m=
Сэ
∙ Vэ
∙ Мэ
зная, что Мэ
(NaОН)
=
→m=
Сэ
∙ Vэ
∙ Мэ
зная, что Мэ
(NaОН)
=
![]() = 40г /моль, тогда m =0,5 моль/л
∙ 0,2 л ∙ 40 г/моль = 4 г
= 40г /моль, тогда m =0,5 моль/л
∙ 0,2 л ∙ 40 г/моль = 4 г
Итак, для приготовления 200 мл раствора с 0,5 молярной концентрацией эквивалента NaОН необходимо взвесить 4 г NaОН, перенести в мерную колбу на 200 мл и довести объем раствора в колбе до метки.
