
- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
Вопросы для самоконтроля.
Как формулируется закон Авогадро?
Сформулировать следствия, вытекающие из закона Авогадро?
Что называется «молярным объемом газообразного вещества»?
Какие условия называются «нормальными»?
Сформулируйте закон объемных отношений. Укажите, какова его роль в развитии атомно-молекуляных представлений.
Чему равно число Авогадро, что оно определяет?
Как называется отношение масс равных объемов двух газов. Как обозначается эта величина? Что означают записи
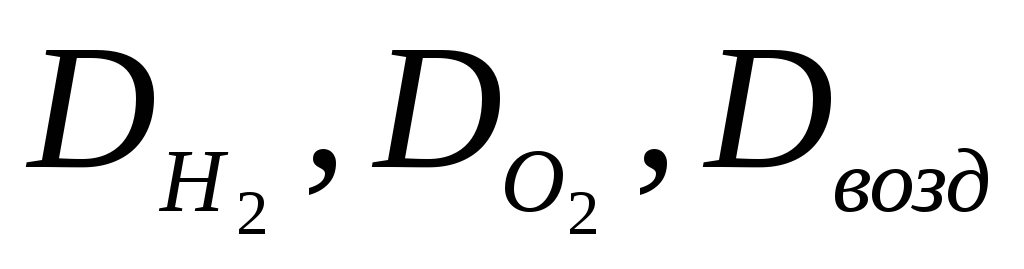
Какие существуют методы определения молярных масс газообразных веществ?
Каковы единицы измерения массы объема, давления и температуры?
Сформулируйте законы Гей-Люссака, Бойля – Марриота.
Объединенный газовый закон.
Напишите уравнение Менделеева – Клапейрона.
Что называется универсальной газовой постоянной? Каков ее физический смысл? Каковы единицы измерения (R).
Задачи.
Какой объем занимает аммиак массой m=51г при н.у.? (Ответ: 67,2 л)
Плотность газа по водороду равна 14. Определите плотность этого газа по воздуху. (Ответ: 0,966)
Какую массу имеют 3,01 ∙1023молекул хлороводорода и какой объем они займут при температуре 270С и давлении 0,3 атм.? (Ответm= 18,25 г ,V= 41 л)
Определите объем, занимаемый 5,25 г азота при температуре 260С и давлении 98,9 кПа (742 мм рт.ст.). (Ответ: 4,71 л)
Сколько моль кислорода находится в 1 л (н.у) воздуха, если объемное содержание его составляет 21% ? (Ответ 0,0094 моль)
Определите молярную массу газа, если при н.у. 0,824 г его занимают объем 0,260 л? (Ответ: 71 г/моль)
Определите объем 1 кг воздуха при температуре 170С и давлении 1 атм. (Ответ: 820 л).
Раздел 5
РАСТВОРЫ.
СПОСОБЫ ВЫРАЖЕНИЯ И МЕТОДЫ ОПРЕДЕЛЕНИЯ
КОНЦЕНТРАЦИИ РАСТВОРОВ.
Цель работы:
Усвоить понятия растворов, растворимости и способы выражения концентрации растворов; приобрести навыки приготовления растворов и определения их концентрации.
Теоретическая часть
Раствором называется устойчивая однородная система, состоящая из двух и более компонентов, относительные количества которых могут меняться в определенных пределах без нарушения однородности системы; в простейшем случае раствор состоит из растворителя и растворенного вещества.
Растворителем принято считать тот компонент, который при данных условиях в чистом виде находится в том же агрегатном состоянии, что и раствор. Если же оба компонента в чистом виде находятся в одинаковом агрегатном состоянии, то растворителем называют вещество, присутствующее в большем количестве. Растворение представляет собой сложный физико-химический процесс, связанный: а) с разрушением исходной структуры растворяемого вещества; б) с распределением его частиц по всему объему системы и образованием частиц взаимодействия растворенного вещества с молекулами растворителя.
Так, например, раствор хлорида натрия состоит из растворителя (воды), растворенного вещества (соли) и продуктов их взаимодействия – гидратированных ионов Na+ , CI-.
Продукты взаимодействия растворителя с растворенным веществом называют сольватами, а процесс их образования – сольватацией. Если растворитель – вода, сольваты называют гидратами, а процесс – гидратацией.
Таким образом, растворимостью называется способность вещества взаимодействовать с растворителем с образованием продуктов взаимодействия (сольватов).
Важнейшей количественной характеристикой раствора является его концентрация.
Под концентрацией понимают массу или количество растворенного вещества, содержащегося в определенной массе или объеме раствора или растворителя.
