
- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
Закон Авогадро (1811 г.)
В равных объемах различных газов при одинаковых условиях (температуре и давлении) содержится одинаковое число молекул (атомов).
Следствия из закона Авогадро.
1. При одинаковых условиях 1 моль любого газа занимает одинаковый объем.
При н.у. один моль любого газа занимает объем, равный 22,4 литра. Этот объем называется молярным объемомгаза (Vm = 22,4 л/моль)
Молярный объем можно вычислить, если известна масса 1 л газа. При н.у., т.е. Т0=273 К и давлении Р0=101325 Па, 1 л водорода имеет массу 0,09 г, молярная масса его равна 1,008∙2=2,016 г/моль.
Тогда объем, занимаемый 1 моль водорода равен:
![]()
Молярный объем (Vm) – это отношение объема газообразного вещества к количеству этого вещества:
![]()
V– объем вещества , л
ν – количество газообразного вещества, моль.
Vm= 22,4 л/моль
2. Отношение масс равных объемов различных газов при одинаковых условиях равно отношению их молярных масс.
![]()
где m1,m2– массы первого и второго газов,
М1, М2– молярные массы первого и второго газов.
Отношение m1/m2– называетсяотносительной плотностьюи обозначается D.
Тогда:
![]() ,
а М1 = DМ2
,
а М1 = DМ2
относительную плотность газа обычно вычисляют по отношению к водороду или воздуху.
![]() ,
М1=2D
,
М1=2D
![]() ,
М1=29D
,
М1=29D
Задача. Какой объем займет при нормальных условиях оксид углерода (IV) массой 22 г?
Дано: m(CO2) =22г.
Найти: V(СО2).
Решение: 1.Определяем количество вещества оксида углерода (IV):
![]() ,
,
![]()
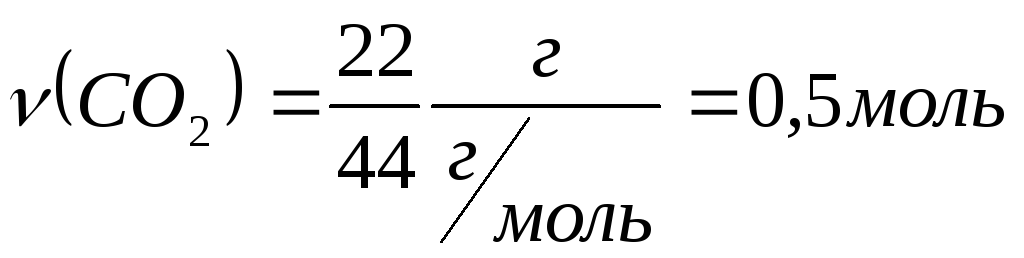
2. Находим объем СО2:
V=νVm, V( CO2)=0,5 моль∙22,4 л/моль =11,2 л
Ответ: V(CO2) = 11,2 л.
Задача. Определите плотности иодоводорода по водороду и по воздуху.
Дано: М(НI)=127,9 г/моль
М(Н2)=2 г/моль
М(возд)=29 г/моль
Найти:
![]()
Решение: определяем относительную плотность (HI) иодоводорода по водороду:
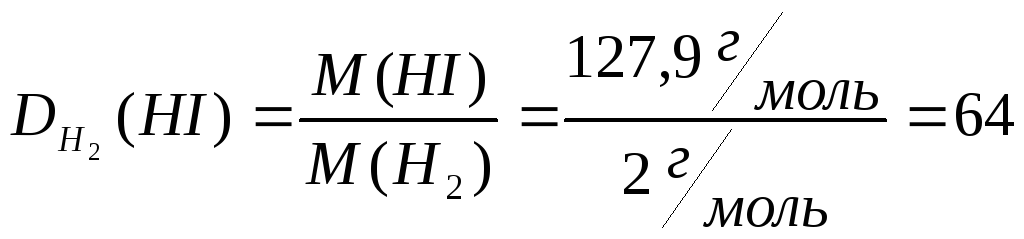
Находим относительную плотность иодоводорода по воздуху:
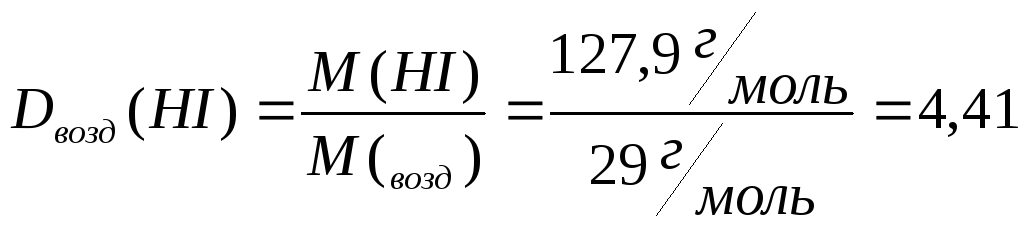
Ответ:
![]()
![]()
Уравнение Менделеева – Клапейрона широко используется для определения молярной массы не только газов, но и всех веществ, переходящих при нагревании (без разложения) в газообразное состояние.
Молярные массы, определенные этими способами не вполне точны, потому что рассмотренные газовые законы и уравнение Менделеева – Клапейрона строго справедливы лишь при очень малых давлениях и высоких температурах.
Определение молярной массы газа.
Для определения относительной молекулярной массы газообразного вещества М(r)(безразмерная величина) находят численно равную ей молярную массу М (выражается в СИ в кг/моль или г/моль). Экспериментальное определение молярной массы газообразного или парообразного вещества основано на применении закона Авогадро и следствий из него.
1. Определение молярной массы газа по относительной плотности к другому газу.
![]()
где D– относительная плотность;
М1, М2– молярные массы газов.
Тогда
М1 = DМ2
Если второй газ водород, М(Н2) = 2 г/моль, то формула для расчета молярных масс принимает вид (М(н2)=2,0158 г/моль):
М = 2D(н2)
Если второй газ воздух (М(возд)=29 г/моль), то уравнение для расчета молярных масс:
М = 29Dвозд
2. Определение молярной массы газа по молярному объёму газа.
![]() или
или
![]()
P0,V0,T0– давление, объём и температура
газа при н. у.
P,V,T- давление, объём и температура газа при заданных условиях.
Зная массу (m) газа и его объём (V0) рассчитывают массу 22,4 л, газа равную молярной массе.
m–V0
![]()
M– 22,4
