
- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
Экспериментальная часть.
В настоящей работе определение молекулярной массы газа заключается :
а) в получении некоторого объема газа, при разложении взятого для опыта вещества путем нагревания;
б) в определении массы и объема полученного газа;
в) в измерении температуры опыта по термометру и атмосферного давления по барометру.
г) в вычислении молярной массы газа с использованием этих данных по уравнению Менделеева – Клапейрона.
Схема установки для проведения опыта представлена на рис.1
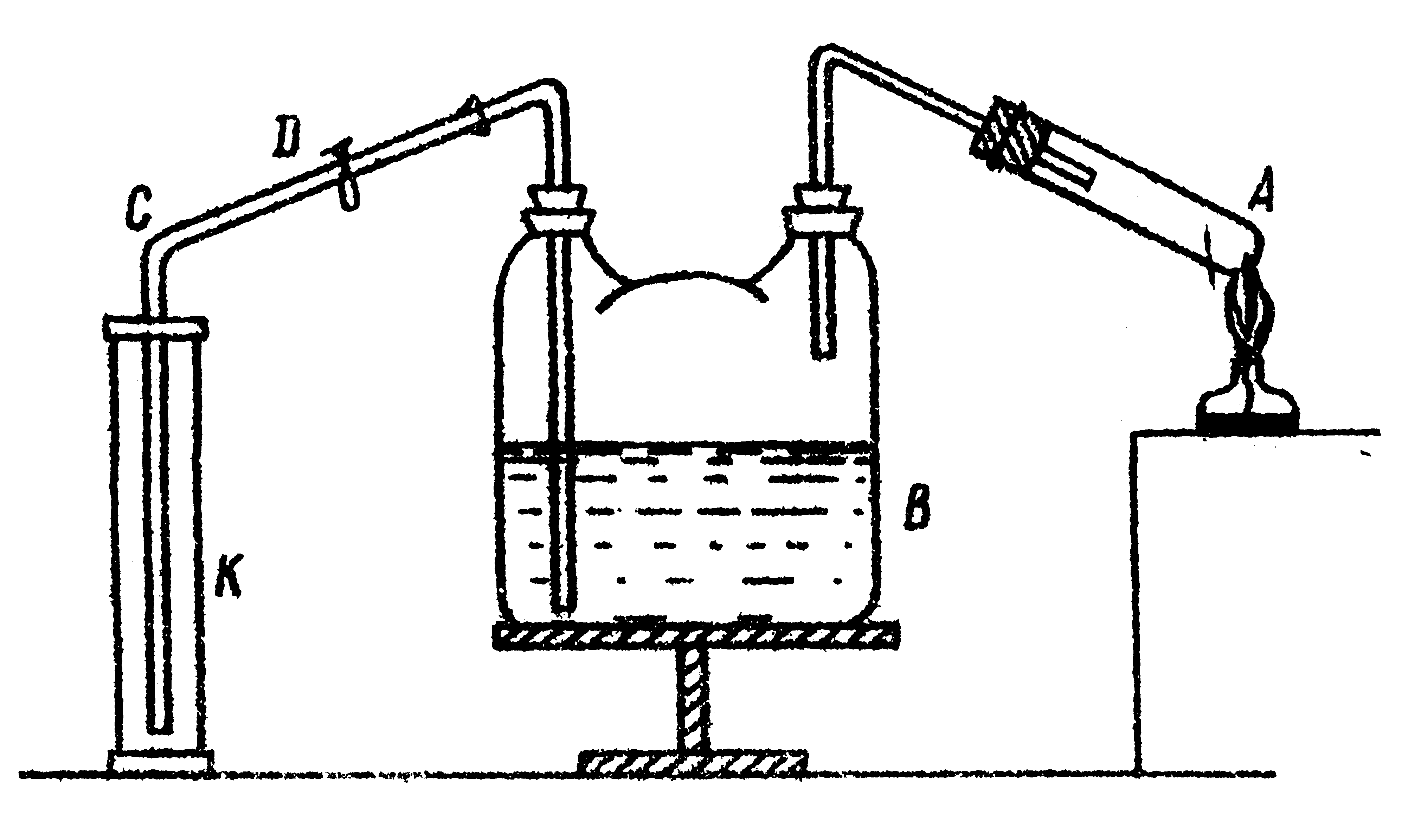
В – двугорлая склянка;
С – газоотводная трубка;
К – стеклянный цилиндр; Д – зажим;
А – пробирка стеклянная.
1. В чистую сухую пробирку поместить взятое у преподавателя вещество, взвесить пробирку с веществом на технических весах с точностью до 0,01 г. Записать полученную массу m1в табл.2.
2. Проверить прибор на герметичность. Для этого наполнить склянку В дистиллированной водой доверху, открыть зажим Д на трубке С и подставить под конец трубки С цилиндр К, вдунуть в склянку В воздух через открытый конец газоотводной трубки, идущей от пробирки А. Присоединить пробирку А со взвешенным веществом к склянке В.Если при открытии зажима Д вода не вытекает из трубки в цилиндр К, это значит, что прибор герметичен.
3. Убедившись таким образом в герметичности прибора, вылить воду из цилиндра К и подставить под трубку С пустой цилиндр К.
4. Приступить к разложению вещества в пробирке А. Осторожно нагреть пробирку так, чтобы вещество из пробирки не перебрасывалось в склянку В. Когда цилиндр наполнится водой до объёма 500 – 600 см3, прекратить нагревание и оставить прибор охлаждаться до комнатной температуры.
5. Замерить точный объем вытесненной в цилиндр воды. Этот объем будет равен объему полученного газа. Записать объем полученного газа (V, см3) в табл. 2.
6. Отсоединить пробирку А от прибора и снова взвесить на тех же весах. Записать массу пробирки после опыта ( m2) в табл.2.
7. По разности массы пробирки до и после опыта вычислить массу газа (m), образовавшегося в результате разложения вещества. Записать результат в табл.2.
8. Записать показания термометра (t0С), барометра (мм рт.ст.) и давления водяных паров для соответствующей температуры из таблицы 1 в таблицу 2. Перевести температуру в шкалу Кельвина (Т=Т0 +t0, Т0=273К); данные записать в табл.2.
Для точных расчетов пользуются формулой:
![]()
где m– масса вещества (г);
R– газовая постоянная (62360 мм рт.ст.∙ мл/моль∙К);
V– объём вещества (мл);
T– температура (К).
![]() –атмосферное
давление во время опыта (мм рт.ст.)
–атмосферное
давление во время опыта (мм рт.ст.)
![]() - давление водяного
пара при температуре опыта (мм рт. ст.)
- давление водяного
пара при температуре опыта (мм рт. ст.)
Таблица 1.
Зависимость давления водяного пара от температуры
|
t, 0 С |
17 |
18 |
19 |
20 |
21 |
22 |
23 |
24 |
|
мм рт.ст |
14,5 |
15,5 |
16,5 |
17,5 |
18,7 |
19,8 |
21 |
22,3 |
Порядок оформления результатов опыта.
1. Результаты опыта представьте в виде таблицы:
Таблица 2
|
Параметры |
Обозначения |
Числовые значения |
|
масса пробирки с веществом до опыта, г |
m1 |
|
|
масса пробирки после разложения вещества, г |
m2 |
|
|
масса полученного газа, г |
m |
|
|
условия опыта |
|
|
|
давление по барометру, мм рт.ст. |
|
|
|
давление водяных паров, мм рт.ст. (см. таблицу 1) |
|
|
|
температура опыта, 0С |
t0С |
|
|
абсолютная температура (К), Т = 273 + t0С, Т0= 273К |
Т (К) |
|
|
объем полученного газа, мл (см3) |
V |
|
2. Провести расчет молярной массы полученного газа по уравнению:
![]()
R= 62360 мл ∙мм рт.ст./К∙моль
Так как молярная масса численно равна относительной молекулярной массе Мr, то полученная молярная масса М (г/моль) будет соответствовать Мr.
3.Вычислить величину абсолютной ошибки опыта.
ΔХабс = Мтеор - Мпракт
4. Вычислить относительную ошибку опыта.
![]()
