
- •Раздел 4
- •Определение молекулярной массы газа.
- •Теоретическая часть.
- •Газовые законы.
- •Закон объемных отношений (Гей-Люссака, 1808 г.)
- •Закон Бойля – Мариотта (1660 – 1667 г.Г.)
- •Закон Гей-Люссака (1802 г.)
- •Закон Шарля (1787)
- •Закон Авогадро (1811 г.)
- •Определение молярной массы газа.
- •1. Определение молярной массы газа по относительной плотности к другому газу.
- •Экспериментальная часть.
- •Порядок оформления результатов опыта.
- •Вопросы для самоконтроля.
- •Задачи.
- •Раздел 5
- •Способы выражения концентрации растворов
- •Размерность молярной концентрации эквивалента [моль/л]
- •Методы определения концентрации растворов
- •Способы приготовления растворов заданной концентрации
- •1. Растворением вещества в растворителе
- •2. Приготовление растворов заданной концентрации разбавлением
- •3. Приготовление раствора промежуточной концентрации из
- •Экспериментальная часть
- •Относительные плотности растворов и массовая доля растворённого вещества
- •Пример записи результатов измерения
- •1. Находят разность величин относительных плотностей растворов и массовых долей, выраженных в процентах, по табличным данным:
- •Вопросы для самопроверки
- •Задачи и упражнения
- •Раздел 6 Жесткость воды. Методы определения и устранения жесткости
- •Общие сведения
- •Методы устранения жесткости
- •Практическая часть
- •Раздел 7 окислительно-восстановительные реакции
- •Теоретическая часть Степень окисления
- •Окислительно-восстановительные реакции
- •Типы окислительно-восстановительных реакций
- •Алгоритм расстановки коэффициентов в уравнениях овр
- •Важнейшие окислители и восстановители
- •Практическое применение окислительно-восстановительных реакций
- •Экспериментальная часть
- •Вопросы для самоконтроля
- •Задачи и упражнения
Практическая часть
Опыт № 1. Определение временной жесткости.
Временную (карбонатную) жесткость определяют титрованием определенного объема воды раствором соляной кислоты в присутствии индикатора – метилоранжа. Химизм процесса можно выразить уравнениями в молекулярной и в ионной формах:
Ca(HСО3)2 + 2HC1 = СаCl2 + 2H2O + 2CO2↑
HCO3- + H+ = H2O + CO2↑
Отмерьте в три конические колбы по 100 мл анализируемой воды и добавьте в каждую несколько капель метилоранжа до желтого окрашивания. Одну из колб оставьте контрольной, а остальные оттитруйте 0,1Н раствором соляной кислоты до перехода желтой окраски в розово-оранжевую. Для расчетов используйте формулу:
![]() (7),
(7),
где Жк – временная жесткость воды, ммоль/л;
Сэ(HCl) – молярная концентрация эквивалента раствора соляной кислоты, моль/л;
V(HCl)– объем кислоты, пошедший на титрование, мл;
V(H2O)- объем воды, взятый для анализа, мл
Опыт № 2. Определение общей жесткости.
К исследуемой воде добавляют в избытке щелочную смесь (NaOН + Na2CO3) и кипятят несколько минут.
Са(НСО3)2 +2NаОH = СаСО3↓ + Na2СО3 + 2H2О
MgSO4 + Na2CO3 = MgCO3↓ + Na2SO4
t0C
Ca(HCO3)2 = CaCO3↓ + H2O + CO2
После выпадения солей в осадок, раствор, содержащий не прореагировавший остаток щелочной смеси отфильтровывают, а затем титруют раствором соляной кислоты.
Для проведения опыта отмерьте с помощью мерного цилиндра в колбу 100 мл воды, добавьте к ней 20 мл щелочной смеси (щс) (10 мл 0,1Н раствора NaOH и 10 мл 0,1Н раствора Nа2СО3). Доведите до кипения и кипятите 3 минуты. После охлаждения отфильтруйте, добавьте метилоранж к фильтрату и титруйте 0,1Н раствором соляной кислоты до розово - оранжевой окраски. Для расчета общей жесткости воды используйте формулу:
![]() , (8)
, (8)
где СЭ(щс) – молярная концентрация эквивалента щелочной смеси, моль/л;
СЭ(HCl) – молярная концентрация эквивалента соляной кислоты, моль/л;
V(HCl) – объем кислоты, пошедшей на титрование, мл;
V(H2O)- объем воды, мл;
V(щс) – объем щелочной смеси, мл.
Опыт № 3. Комплексонометрическое определение общей жесткости.
В практике технического и агрохимического анализа для определения общей жесткости природных вод используют комплексонометрическое титрование.
Комплексоны – это сложные органические соединения, содержащие в своих молекулах атомы Н, S, реже Р, способные образовывать координационные связи с ионами металлов: Са2+, Mg2+, Fe3+ и т.д. Наиболее широко в аналитической практике используется комплексон III (трилон Б) – динатриевая соль этилендиаминтетрауксусной кислоты:
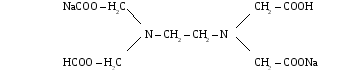
Трилон Б
Анализируемую воду подщелачивают аммонийной буферной смесью до рН ~ 10 и добавляют индикатор – эриохром черный Т, который образует с ионами Са2+ и Mg2+ растворимые комплексы винно-красного цвета.
Далее воду титруют раствором трилона Б. При титровании в точке эквивалентности индикатор изменяет окраску красную на синюю.
Для определения общей жесткости к 100 мл исследуемой воды добавьте 5 мл буферной щелочной смеси (NH4Cl + NH4OH) и 3-4 капли индикатора – эриохрома черного Т до появления хорошо заметной, но не очень темной винно-красной окраски (вместо этого можно внести на конце шпателя 20–30 мг сухой смеси индикатора с хлоридом натрия). Титруйте воду 0,05Н раствором трилона Б до синей окраски. Повторите титрование 3 раза и возьмите среднее значение. Вычисления производите по формуле:
![]() ,
(9)
,
(9)
где Жо – общая жесткость, ммоль/л;
СЭ(ТБ) – молярная концентрация эквивалента трилона Б, моль/л;
V(H2O)- объем воды, взятой для определения, мл;
V(ТБ) – объем трилона Б, пошедшего на титрование, мл;
Вопросы для самоконтроля
Что понимают под термином «жесткость воды»?
Какие химические соединения обусловливают временную, постоянную жесткость?
Причины возникновения жесткости.
Каковы требования к жесткости воды различного назначения: хозяйственно-питьевого, технического?
Назвать основные методы устранения жесткости.
Какую жесткость можно устранить с помощью следующих реагентов: Ca(OH)2, Na2СО3, Na3PO4. Составьте уравнения реакций.
Какие процессы будут происходить в воде, содержащей Са(НСО3)2 при:
а) ее кипячении;
б) при добавлении к ней Na2CO3;
в) при добавлении к ней NaOH.
Составьте соответствующие уравнения реакций.
Задачи
Путем анализа было установлено, что в 2 л исследуемой воды содержится 48 мг ионов Mg2+ и 180 мг ионов Ca2+. Вычислите общую жесткость воды.
Ответ: 6,5 ммоль/л
Какой объем 0,1Н раствора соляной кислоты потребуется для титрования 75 см3 воды жесткостью 4 ммоль/л?
Ответ: 3 мл
На титрование речной воды жесткостью 8 ммоль /л потребовалось 8 мл 0,2Н раствора кислоты. Какой объем воды был взят для анализа?
Ответ: 200 мл
Найти жесткость воды, если в 500 л ее содержится 101,25 г гидрокарбоната кальция Са(НСО3)2.
Ответ: 2,5 ммоль/л
К 100 л жесткой воды для ее умягчения добавили 12,95 г гидроксида кальция Са(ОН)2. На сколько единиц при этом понизилась жесткость воды?
Ответ: 3,5 единицы
В 100 л воды содержится 14,6 г гидрокарбоната магния Mg(HCO3)2. Какова ее жесткость?
Ответ: 2,5 ммоль/л
К 1 м3 водопроводной воды прибавили 53 г карбоната натрия Na2СО3. На сколько единиц понизилась жесткость воды?
Ответ: 1 единица
Вода, содержащая только сульфат магния MgSO4, имеет жесткость 7 ммоль/л. Какая масса MgSO4 содержится в 100 л этой воды?
Ответ: 42 г
После кипячения 500 мл исследуемой воды, содержащей только гидрокарбонат кальция, выпало в осадок 5 мг СаСО3. Какова жесткость исследуемой воды?
Ответ: 0,2 ммоль/л
Какую массу гашеной извести Ca(OH)2 необходимо добавить к 5 л воды, чтобы устранить жесткость, равную 2 ммоль/л?
Ответ: 0,37 г
В 220 л воды обнаружено 6,6 г сульфата магния MgSO4 и 7,48 г сульфата кальция CaSO4. Рассчитать жесткость этой воды.
Ответ: 1 ммоль/л
