
- •12. Імунодефіцити
- •12.1. Первинні імунодефіцити
- •12.1.1. Дефіцит гуморального імунітету (в-системи)
- •12.1.2. Дефіцит клітинного імунітету (т-системи)
- •12.1.3. Комбіновані імунодефіцити
- •12.1.4. Вродженні дефекти фагоцитарної системи
- •12.1.5. Вродженні дефекти системи комплементу
- •12.1.6. Лікування первинних імунодефіцитів
- •12.2. Вторинні імунодефіцити
- •12.2.1. Класифікація вторинних імунодефіцитів та їх етіологія
- •12.2.2. Імунодефіцити, викликані інфекційними агентами
- •12.2.3. Імунодефіцити, викликані лікарськими препаратами
- •12.2.4. Вторинні імунодефіцити, викликані недоліками у харчуванні
- •12.2.5. Снід – синдром набутого імунодефіциту
- •Питання для засвоєння матеріала
- •Відповіді на тести
12.2.5. Снід – синдром набутого імунодефіциту
СНІД – синдром набутого дефіциту отримав свою назву через те, що у хворих було виявлено різке зменшення кількості лімфоцитів і особливо Т-хелперів. Хоча СНІД викликається вірусом, як і багато інших вторинних імунодефіцитів, це захворювання посідає особливе місце серед імунодефіцитів насамперед тому, що мішенню вірусу стають клітини імунної системи і хвороба має фатальний характер (100% летальність). Здорового вірусоносійства за останні 20 років не спостерігалося.
Відкриття ВІЛ і епідеміологічний стан хвороби. Вперше захворювання на СНІД було зафіксовано у червні 1981 р. в Атланті (США), а вже у серпні до перших 5 хворих додалося ще 111. Першими захворілими були молоді чоловіки-гомосексуалісти, які вмерли від рідкісної пневмоцистної пневмоніїї, викликаної грибком Pneumocystis carinii. З досить високою частотою у хворих на СНІД виявлялася саркома Капоші, досить рідке захворювання, яке виникає звичайно у людей похилого віку. Стало зрозуміло, що мова йде про епідемію принципово нової хвороби, яка зараз вже переросла у пандемію.
Кількість інфікованих людей у 2000 р. вже сягнула 30 млн, кожний рік гине понад 2 млн людей. Більшість (80%) інфікованих і хворих живе у краінах з низьким рівнем економічного розвитку. Серед країн Європи Україна займає перше місце з поширення ВІЛ (вірусу імунодефіциту людини). Кількість зареєстрованих в Україні ВІЛ-інфікованих на 2004-2005 рр. вже склала понад 100000. Хвороба має вибуховий характер маніфестації у нових регіонах, тому що ВІЛ внаслідок тривалого інкубаційного періоду накопичується в популяції 10-15 років без помітних клінічних ознак.
Вірус-збудник вперше був виділений у 1983 році паралельно двома вченими – американцем Робертом Галло та французом Люком Монтаньє. Р. Галло назвав його HTLV-III (Human T-lymphotropic Virus III), тому що раніше ним було виділено HTLV-I і HTLV-II. Л. Монтаньє дав вірусу іншу назву – LAV (Lymphoadenopathy Associated Virus), тому що виділив його від хворого з лімфоаденопатією. Пізніше було встановлено, що саме вірус є провідним фактором захворювання на СНІД, тому за пропозицією Всесвітньої організації охорони здоров’я (ВООЗ) назву СНІД було замінено на ВІЛ-інфекцію (ВІЛ – вірус імунодефіциту людини). А СНІД розглядається як клінічний прояв термінальної фази ВІЛ-інфекції. В англомовній літературі ВІЛ позначають як HIV (від англ. Human Immunodeficiency Virus), а СНІД як AIDS (від англ. Acquired Immune Deficiency Syndrom).
Шляхи зараження. ВІЛ-інфекція передається статевим шляхом (80% заражених), при потраплянні у кров (ін’єкції, переливання крові, введення препаратів з крові тощо), при слизових контактах, трансплацентарно – від хворої матері до плоду, при грудному вигодовуванні. На відміну від інших пандемій, при розповсюдженнї ВІЛ не спостерігається спонтанного призупинення інфекції. Це пояснюється впливом багатьох антропогенних факторів на поширення хвороби, до яких належать такі, як полігамні статеві відносини, наркоманія, світовий туризм, високе скупчення населення у великих містах, широке поширення косметичних маніпуляцій (манікюр, педикюр, різноманітні ін’єкції “молодості” та ін.), поширення у медичній практиці деяких методів з великим ступенем ризику щодо зараження ВІЛ (ендоскопія, введення вакцин, препаратів з людської крові тощо) .
Резистентність вірусу в умовах зовнішнього середовища низька. Але незвачаючи на те, що зовнішня мембрана вірусу легко пошкоджується під дією екстремальних факторів (сонячне та УФ-опромінення, термоінактивація при 80°С протягом 30 хв, обробка дезинфекторами 20-30 хв), його РНК є дуже стійкою, а саме вона визначає інфекційний потенціал цього збудника.
Будова вірусу. ВІЛ належить до ретровірусів. Це РНК-вмісний вірус сферичної форми з діаметром 100-120 нм і наявнісю суперкапсиду – так званої “мембрани”. Суперкапсид має форму багатогранника, який формується з 12 п’ятикутників і 20 шестикутників. Над поверхнею суперкапсиду піднімаються молекули глікопротеїну gp120, які переважно розташовані у центрі та кутах шестикутників. Молекула кожного gp120 пов’язана з внутрішньомембранним глікопротеїном gp41. Таким чином, поверхня віріону вкрита своєрідними шипами, кожен з яких утворюється трьома спареними білками gp120 + gp41. Ці білки, разом з подвійним ліпідним шаром, саме і утворюють суперкапсид віріону. Під суперкапсидом вірусу прихований нуклеокапсид, який має форму зрізаного циліндра (дельта-ікосаедра) і утворений білками р17, р24, р7 і р9. Білки р17 формують шар, що лежить безпосередньо під мембраною. У серцевині нуклеокапсиду розташований геном вірусу, що складається з двох ідентичних молекул РНК (кожна вміщує 9213 нуклеотидів). Ще усередині нуклеокапсиду є затравочна РНК, одна молекула протеази, так званий pol-комплекс (полімеразний), що містить зворотну транскриптазу, РНК-азу Н і ДНК-залежну ДНК-полімеразу, а також молекулу інтегрази. Затравочна РНК, pol-комплекс і, зокрема, зворотна транскриптаза забезпечують процес синтезу ДНК копії на вірусній РНК, як на матриці. А інтеграза сприяє ковалентній інтеграції ДНК-ової копії у декілька різних місць в геномі людини.

gp120 Оболонковий ліпід
ВІЛ-1
РНК
gp41
Зворотна
транскриптазаза Ядерні
протеїни




























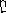



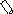













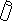


























Рис. 12.2. Будова віруса імунодефіциту людини
Геном ВІЛ має екзон-інтронну будову і складається з 9 генів, нуклеотидні послідовності яких частково перекриваються. Це є основою для альтернативного сплайсингу і залежно від дії білків-регуляторів, забезпечує можливість синтезувати ти чи інші білки залежно від стадії розвитку і потреби вірусу. Завдяки такому влаштуванню генома 9 генів вірусу кодують синтез 15 білків, 9 із яких є структурними, а 6 – регуляторними. По краях молекули вірусних РНК оточені довгими кінцевими повторами з 638 нуклеотидів кожний. Це LTR-послідовності (від англ. Long Terminal Repeat), які містять регуляторні елементи для контролю за роботою вірусного генома.
Антигенні властивості ВІЛ. Існує два основних варіанта вірусу – ВІЛ-1 і ВІЛ-2, які імунологічно відрізняються один від одного, тому що гомологія їх геномів складає тільки 42%. ВІЛ-2 є ендемічним для Західної Африки, хоча зустрічається і в інших регіонах. Його РНК містить 9671 нуклеотид, а LTR-послідовності – 854 нуклеотиди. Є підстави вважати його менш патогенним, ніж ВІЛ-1. Перехресного імунітету при інфікуванні ВІЛ-1 і ВІЛ-2 не виникає. Але існування двох основних серологічних варіантів ВІЛ не вичерпує антигенної різноманітності вірусу. Він дуже мінливий і кожний акт реплікації вірусного генома супроводжується, щонайменше однією точковою мутацією. Завдяки цьому в організмі інфікованого водночас може перебувати 1 млн генетичних варіантів вірусу, а в організмі хворого (з вираженими ознаками хвороби) – до 100 млн. Тому реагування імунної системи постійно спізнюється, не встигає за дуже швидкими змінами вірусних антигенів. Є припущення, що ВІЛ-2 виник в результаті мутації вірусу імунодефіциту мавп – ВІМ, а можливо, ВІЛ-1, ВІЛ-2 і ВІМ виникли шляхом генетичних змін від единого предка.
Мішені дії ВІЛ. У зв’язку з існуванням великої кількості квазивидів ВІЛ (різних генетичних варіантів) змінилося уявлення про клітини-мішені, що уражуються вірусом. Ще недавна вважали, що в основному ВІЛ розмножується в Т-хелперах. Тепер же стало зрозуміло, що це генералізована інфекція всього організму і що різні квазивиди здатні опановувати ті чи інші “території” (тканини, органи, клітини) в організмі. Так, у кожного хворого переважає ураження вірусом тієї чи іншої тканини. Для проникнення вірусу у клітину хазяїна йому потрібна “посадочна площадка”. У ролі такої можуть виступати деякі мембранні рецептори клітин: CD4, рецептори для хемокінів, в тому числі CC-CKR5, можливо, і деякі інші рецептори. Зараз вже встановлено, що ВІЛ здатний інфікувати не тільки Т-хелпери (CD4+ Т-лімфоцити), але й CD8+ Т-лімфоцити, моноцити, макрофаги, дендритні клітини, В-лімфоцити, клітини ендотелію, нейрони, фібробласти, хондроцити, стовбурові кровотворні клітини, промієлоцити, мегакаріоцити. В інфікованої людини вірус присутній у всіх тканинах, а також в їх секретах та продуктах виділення (у слизу, слині, поті, сечі, фекаліях, спермі, ушній сірці тощо). Складається враження, що еволюція вірусу йде шляхом адаптації до все більш широкого кола хазяїв і клітин-мішеней.
Механізми і причини імунодепресії при ВІЛ-інфекції дуже різноманітні, але на першому місці за значенням – виснаження і дисфункція Т-хелперів, або їх загибель в результаті прямої дії вірусу. Досі неясно, яким чином ВІЛ вбиває клітини-мішені. Як можливі причини розглядаються такі:
пошкодження клітинної мембрани і лізис інфікованих клітин при відбруньковуванні вірусних часток з поверхні клітини;
накопичення РНК і неінтегрованої ДНК у цитоплазмі клітин, що викликає серйозні порушення в їх функціонуванні;
внутрішньоклітинне зв’язування ще невиведених на поверхню CD4 з gp120 вірусу, що порушує диференціацію Т-лімфоцитів і взагалі робить неможливим імунне розпізнавання;
цитопатична дія вірусу, яка виражається в утворенні синцитіїв – гігантських багатоядерних клітин за рахунок зливання інфікованих і здорових клітин (в основі цього – взаємодія gp120, експресованих на поверхні інфікованих клітин, і CD4 здорових клітин);
знищення Т-хелперів й інших клітин-мішеней (після зв’язування їх CD4 з gp120) цитотоксичними Т-лімфоцитами;
антитілозалежна цитотоксичність К-клітин (АЗКЦТ) у відношенні уражених вірусом Т-лімфоцитів CD4+;
індукція апоптозу у клітинах-мішенях.
Окрім безпосередньої дії на клітини-мішені, ВІЛ суттєво впливає на функціонування і взаємодію клітин імунної системи. Порушення імунних функцій виражається у виснаженні субпопуляції Т-лімфоцитів CD4+, пригніченні їх реакції на антигени, мітогени та інші стимули. Значно змінюється Т-лімфоцитарний індекс. Якщо у здорових людей співвідношення Т-хелпери/Т-супресори =або 2, то у хворих на СНІД воно 0,5. Знижається також продукція інтерлейкінів (IL-4, IL-5, IL-6) і особливо IL-2, в результаті чого втрачається здатність Т-кілерів до ВІЛ-специфічної імунної відповіді, хоча кількість активованих і ареактивних Т-лімфоцитів CD8+ може зростати. Деякі цитокіни здатні додатково стимулювати реплікацію вірусу. Так, найсильнішим стимулятором ВІЛ є TNF-. Білки ВІЛ діють як суперантигени і здатні неспецифічно зв’язуватися з різними імуноцитами і антитілами, що може призводити до неспецифічної поліклональної активації В-лімфоцитів з наступним знищенням активованих клонів. Спостерігається також пригнічення функцій ЦТЛ, NK-клітин і макрофагів (з “погіршенням” бактерицидних механізмів).
Починаючи репродукцію у клітинах-мішенях, вірус розвиває справжню експансію проти імунної системи і організму взагалі. Середній час напівжиття вірусу в інфікованих клітин становить менш 2 діб. Щоденно з уражених клітин вивільняється 10(9)– 10(10) вірусних часток, які інфікують наступні клітини.
Клінічна картина ВІЛ-інфекції характеризується різноманітними проявами залежно від стадії хвороби. Згідно з класифікацією відомого російського вченого В. І. Покровського виділяють 3 основні клінічні стадії, які відрізняються різним рівнем ураження імунної системи і більш-менш характерною симптоматикою. Міжнародна класифікація включає 4 стадії, які розглядаються далі.
І стадія ВІЛ (інкубаційна) – це період від моменту інфікування до перших клінічних проявів. Він триває протягом 2 - 3 тижнів, а іноді 1-2 місяців і більше (за деякими даними 3-5 років). В інфікованих спостерігається тимчасове зменшення кількості Т-хелперів (але не нижче 500 на 1 мкл крові) і збільшення Т-супресорів, ВІЛ виявляється у плазмі крові. У перші 2-6 тижнів після інфікування у крові можна визначити антитіла до серцевинних та оболонкових білків вірусу.
Найбільш раннім проявом гострої ВІЛ-інфекції є грипоподібний синдром (у 70% хворих), який супроводжується лихоманкою, болями у м’язах, суглобах, лімфоаденопатією, втратою апетиту, фарингітом, кашлем. Характерні також ураження шкіри у вигляді еритематозного або розеолоподібного висипу, кропивниці, алопеції (облисіння), утворення шкіряно-слизових виразок. З боку травної системи відмічаються нудота, блювота, діарея, кандидоз ротової порожнини стравоходу. Серед уражень нервової системи найбільш характерні: головний біль, симптоми менінгоенцефаліту, периферійна нейропатія, неврити, радикуліт, стани афекту тощо. Грипоподібний синдром спонтанно зникає і хвороба переходить у тривалий бессимптомний період (ІІ стадія), який може продовжуватися 10-15, а іноді й більше років.
ІІ стадія ВІЛ – стадія первинних проявів (кількість Т-лімфоцитів СD4 поступово зменшується до 200-500 на 1 мкл крові, а кількість супресорів може збільшуватися). Ця стадія може мати 3 основні фази: А – гостра фаза з лихоманкою (1-2 тижні – 1 місяць); Б – бессимптомна фаза (1-3 місяці – 1,5-2 роки); В – персистуюча генералізована аденопатія (6 місяців – 5 років).
Клінічні прояви гострої фази часто мають неспецифічний характер і супроводжуються вираженою інтоксикацією, слабкістю, лихоманкою, болями у м’язах і суглобах, катаральними явищами у верхніх дихальних шляхах, головним болем, зсувами у свідомості і навіть порушенням памיяті. У бессимптомній фазі хронічна інфекція не супроводжується клінічними проявами, однак у 33% хворих збільшені лімфатичні вузли. При симптоматичній формі хвороби продовжується зниження кількості Т-хелперів (до 200 на 1мкл), і на тлі поступового розвитку імунодепресії виникають дегенеративні, аутоімунні та деякі хронічні інфекційні захворювання: дерматомікоз, себорейний дерматит, демієлінізуючі нейропатії, парези, паралічі, синдром Сьогрена, гастроентерити, оральна лейкоплакія та ін.. Лімфоаденопатія може приймати генералізований персистуючий характер.
ІІІ стадія ВІЛ (кількість Т-лімфоцитів СD4 – менше 200 на 1 мкл крові, співвідношення Т-хелпери : Т-супресори О,5). На цій стадії хвороби відзначаються як неспецифічні, так і специфічні симптоми. Серед неспецифічних симптомів найбільш характерні: лихоманка, нічна пітливість, діарея, втрата ваги (до 10% маси тіла), слизово-шкіряний кандидоз, оперізуючий лишай, герпетичні ураження (вірус простого герпесу), різні шкірні інфекції. Ці розлади є передвісниками власне СНІДу, який супроводжується формуванням імунодепресивного стану і внаслідок цього розвитком важких опортуністичних інфекцій і пухлин.
Серед новоутворень найбільш характерні при СНІД саркома Капоші і різноманітні лімфоми (Беркіта, імунобластна, первинна лімфома головного мозку, В-лімфоми кишечника, кісткового мозку). Саркома Капоші дозволяє за однією цією ознакою ставити діагноз СНІД, тому що у даному випадку вона розвивається не як локальна пухлина, а багатоосередкова. Розповсюджуючись ця ендотеліальна пухлина уражує шкіру, слизові оболонки, кишечник, легені та інші внутрішні органи. Зі саркомою Капоші часто буває асоційований вірус герпесу 8-го типу (HHV8).
До опортуністичних інфекцій, які розвиваються на тлі важкої імунодепресії, перш за все слід віднести пневмоцистну пневмонію, яка викликається грибом Pneumocystis carinii і теж є дуже характерною для хворих на СНІД. Ураження дихальних шляхів можуть викликати й інші гриби (аспергіл, мукор), найпростіші (Histoplasma capsulatum), мікобактерії туберкульозу. У хворих з діареєю виявляються ентеробактеріїї (Salmonella, Campylobacter) та патогенні найпростіші (криптоспорідії та мікроспорідії). Токсоплазмоз (протозойна інфекція) може спричинити утворення кіст у головному мозку та викликати неврологічні розлади. Гриб Cryptococcus neoformans викликає менінгіт, цитомегаловірус – ретиніт з втратою зору, запалення головного та спинного мозку, вірус поліоми – швидко прогресуючу лейкоенцефалопатію з летальним кінцем.
У значної частини хворих на ІІІ стадії захворювання розвиваються різні неврологічні розлади: зниження розумових здібностей, вміння концентрувати увагу, погіршення пам’яті, порушення координації руху, зміна поведінки, апатія і навіть деменція (слабкість розуму).
IV стадія ВІЛ – термінальна, або стадія розгорнутого СНІДу. Для ціє стадії характерні дуже низькі показники рівня СD4-клітин (нижче 200 на 1 мкл) і інтенсивний розвиток великої кількості опортуністичних хвороб. Захворювання, як правило, закінчується летально.
Діагностика, лікування і профілактика ВІЛ-інфекції проводиться за урахуванням, по-перше, вірусної природи збудника, по-друге, того факту, що відбувається ураження імунної системи. Діагностика ВІЛ-інфекції проводиться на основі наявності відповідної клінічної картини, зменшення індексу співвідношення Т-хелперів/Т-супресорів (до 0,025 – 0,1) і виявленні у крові хворого антитіл до ВІЛ.
Лікування ВІЛ-інфекції і СНІД проводиться за декількома стратегіями:
антивірусна терапія;
лікування опортуністичних інфекцій;
підтримуюча терапія;
імунотерапія і імунопрофілактика.
Антивірусна терапія при ВІЛ-інфекції є дуже проблематичною у зв’язку з дуже високою мінливістю вірусу і його здатністю інтегруватися у хромосоми хазяїна. Щорічно у світі розробляється декілька вакцин і тисячі препаратів, з яких до клінічних випробувань доходять лише одиниці. Це перш за все пов’язано з високою токсичністю ліків для організму в цілому. Монотерапія азидотимідином (AZT, ретровір, зидовудин) – першим нуклеозидним препаратом, застосованим проти ВІЛ, і досі використовується. Азидотимідин є аналогом нуклеотиду тимідину, включається до складу дочірнього ланцюга при синтезі ДНК-провірусу і блокує її подальший синтез. Використання AZT на ранніх стадіях захворювання дає слабкий тимчасовий ефект і не збільшує тривалості життя хворих, на пізніх стадіях монотерапія азидотимідином знижує смертність у найближчі строки після початку лікування і затримує прогресування хвороби.
На сьогодні, крім азидотимідину, використовується багато інших антиретровірусних нуклеозидних препаратів (діданозин, ламівудин, ставудин, зальцтабін). Але монотерапія з використанням AZT (або інших нуклеозидних препаратів) ефективна не період не більше 6-18 місяців у зв’язку з швидким виробленням резистентності у ВІЛ-1 і ВІЛ-2.
В останні роки використовується комплексна терапія ВІЛ-інфекції. Так, комбінація двох препаратів інгібіторів зворотної транскриптази знижує смертність від ВІЛ на 40% (порівняно з монотерапією) протягом 1-3 років. Якщо стан внутрішніх органів хворого (особливо нирок і печінки) дозволяє, то використовується комплексна високоактивна антиретровірусна терапія – HAART (highly active antiretroviral therapy). До неї входять препарати двох типів:1 інгібітор протеази вірусу (рітонавір, індінавіт або саквухавіт) і декілька (2 і більше) інгібіторів зворотної транскриптази ненуклеозидної природи. Мета використання HAART – зниження кількості вірусних часток, їх продуктів і, зокрема, РНК і ДНК у крові шляхом пригнічення реплікації вірусу і його інтеграції у хромосому. Стратегія використання HAART побудована на чергуванні комбінацій антиретровірусних препаратів з метою забезпечення їх синергічної дії та запобігання вироблення вірусом резистентності.
Комбінація трьох типів препаратів – інгібітора протеази та двох інгібіторів зворотної транскриптази (нуклеозидної і ненуклеозидної природи) дає ще кращий противірусний ефект, тому що супроводжується короткочасним збільшенням рівня Т-хелперів, що значно покращує клінічний перебіг хвороби. Є надія також, що під впливом нуклеозидних препаратів черга мутацій у вірусному геномі може привести до втрати вірусом вірулентності. Комплексна терапія ВІЛ-інфекції має дуже суттєві обмеження у зв’язку з високою вартістю препаратів. Лікування одного хворого протягом року може коштувати декілька десятків тисяч доларів.
Щодо строків початку лікування, то є різні рекомендації. HAART рекомендують розпочинати якомога раніше від моменту виявлення ВІЛ. Однак більшість лікарів вважають, що лікування треба починати тоді, коли при повторному визначенні рівень Т-хелперів буде зниженим до 200-400 клітин/мкл.
Існує ще одна стратегія в лікуванні ВІЛ-інфекції – блокування його адсорбції на клітинах хазяїна. Американською біотехнологічною компанією Дженентек за допомогою методів генної інженерії ще у 80-х роках минулого століття був створений білковий препарат CD4 – синтетична копія CD4-рецепторів Т-хелперів і деяких інших клітин, що відповідають за проникнення вірусу всередину клітини. Цей препарат, подібно до хімічної гумки, абсорбує вірус ще до того, як він проникне у клітини імунної системи. У 1988 р. цей препарат пройшов клінічні випробування у трьох медичних центрах США, але повідомлень про його ефективність у науковій літературі практично не зустрічається, можливо тому, що оптимальний час його використання дуже обмежений – це перші дні після зараження і моменти загострення хвороби, коли відбувається репродукція вірусу.
Лікування опортуністичних інфекцій при наявності вираженого СНІД проводиться симптоматично за допомогою антибактеріальних, антигрибкових, антипротозойних препаратів. Підтримуюча терапія може включати вітамінні, препарати, що покращуть обмін речовин взагалі і роботу окремих систем організму, нейтралізують і виводять з організму токсичні продукти.
Підтримуюча терапія може включати вітаміни, препарати, що покращуть обмін речовин взагалі і роботу окремих систем організму, нейтралізують і виводять з організму токсичні продукти тощо.
Імунотерапія і імунопрофілактика може проводитися з використанням імуномодулюючих засобів, а також вакцин. У клініках перевірялася можливість використання препаратів тимуса для покращення стану клітинного імунітету. Було встановлено, що у хворих з вираженим СНІД тимопентин (синтетичний аналог тимопоетину – гормону тимуса) і альфа-тимозин не давали позитивної динаміки, але їх застосування у продромальному періоді хвороби призводило до відновлення імунологічних параметрів, що корелювало з клінічним покращенням стану. Малоефективними виявилися препарати - і -інтерферонів, проте лікування рекомбінантним -інтерфероном у частини хворих СНІД із саркомою Капоші призводило до редукції пухлин. Більш багатообіцяючим є використання інтерлейкіну-2 (IL-2), який індукує проліферацію і диференциацію Т-клітин, особливо з ефекторними цитотоксичними функціями. Імунотерапія шляхом пересадки кісткового мозку у деяких випадках приводить до часткового відновлення імунних показників, але не забезпечує вираженого клінічного ефекта.
За останні двадцять років було створено декілька десятків вакцин проти ВІЛ, однак їх ефективність не перевищує 50%, що обумовлено великою мінливістю вірусу. Так, вірусні частки, що виділяються від різних хворих можуть відрізнятися на 30% і більше, навіть якщо первинне джерело зараження було загальним. Тому інактивовані чи вбиті вакцини є малоефективними. При створенні нових рекомбінантних вакцин використовують найбільш консервативні структури вірусу, які найменш підлеглі мутегенезу, отримують “коктейль” поверхневих антигенів, здійснюють монтаж “потрібних генів, розробляють ад’юванти для збільшення імуногенності вакцинного матеріалу. Вже створено генноінженерну вакцину на основі ослабленого віруса віспи, який несе гени ВІЛ, відповідальні за синтез найважливіших антигенів.
До вакцин ставляться такі вимоги: вони повинні бути безпечними, стимулювати синтез віруснейтралізуючих антитіл і утворення цитотоксичних лімфоцитів. Можливо, ВІЛ-вакцини можна буде застосовувати не тільки для профілактики цього захворювання, але й на перших стадіях захворювання у зв’язку з тривалим інкубаційним періодом хвороби.
Ураховуючи дуже швидке зростання ВІЛ-пандемії і неможливість повного виліковування хвороби, на перший план виходить профілактика, тобто пропаганда здорового способу життя і контроль за поширенням інфекції.
