
- •Содержание
- •Глава 1.Распространение воды на планете земля……………5
- •Глава 2.Строение состав воды………………………………………...6
- •Глава 3.Физические свойства воды……………………………….14
- •Глава 4.Определение временной или карбонатной жесткости воды…………………………………………………………....22
- •Глава 5.Химические свойства воды………………………………28
- •Глава 6.Загрязнение вод в тульской области………………….31
- •Введение
- •Глава 1. Распространение воды на планете земля
- •Глава 2.Строение и состав воды
- •2.1 Изотопный состав воды
- •2.2 Строение молекулы воды
- •2.3 Диаграмма состояния воды
- •Глава 3.Физические свойства воды
- •3.1 Определение физических показателей воды. Определение количества грубодисперсных примесей
- •3.1.1. Теоретическая часть
- •3.2. Определение содержания грубодисперсных примесей воды
- •3.2.1 Практическая часть
- •3.3 Определение запаха воды
- •3.4 Определение прозрачности воды
- •3.5 Определение цветности воды
- •3.6 Определение плотности жидкостей
- •3.6.1 Теоретическая часть
- •3.7 Определение плотности жидкости при помощи пикнометра
- •3.7.1 Практическая часть
- •3.8 Определение кислотности воды
- •3.8.1 Теоретическая часть
- •3.8.2 Практическая часть
- •Глава 4. Определение временной или карбонатной жесткости воды
- •4.1 Понятие и методы устранения жесткости воды
- •4.2 Проведение анализа
- •4.3 Определение сульфатов в воде
- •4.3.1 Теоретическая часть
- •4.3.2 Практическая часть
- •Глава 5. Химические свойства воды
- •Глава 6. Загрязнение вод в тульской области
- •Заключение
- •Литература
4.3 Определение сульфатов в воде
4.3.1 Теоретическая часть
Сульфаты
встречаются во всех природных водах,
чаще всего в виде кальциевых, магниевых
и натриевых солей (CaS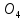 ,
MgS
,
MgS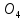 ,
N
,
N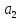 S
S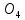 ).
Содержание сульфатов в природных водах
колеблется в широких пределах от единиц
до десятков тысяч мг/л.
).
Содержание сульфатов в природных водах
колеблется в широких пределах от единиц
до десятков тысяч мг/л.
Существует несколько методов определения сульфатов в воде: весовой, комплексонометрический (трилонометрический), колориметрический.
Комплексонометрический
метод дает наиболее надежные результаты.
Сущность этого метода состоит в том, в
исследуемую воду вводят ионы
 (раствор
BaC
(раствор
BaC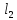 ),
которые связывают ионы S
),
которые связывают ионы S -
в трудно растворимые соединения,
выпадающие в осадок:
-
в трудно растворимые соединения,
выпадающие в осадок:
 +
+ =BaS
=BaS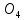 ↓
↓
Количество
сульфат-ионов оценивают по разности
расхода трилона Б на взаимодействие с
ионами
 до
осаждения ионовS
до
осаждения ионовS -
и после их осаждения.
-
и после их осаждения.
4.3.2 Практическая часть
В
коническую колбу на 250 мл внести 25 мл
исследуемой воды. Добавить 2 капли
индикатора метилового красного и
подкислить среду децинормальным
раствором соляной кислоты. Затем
полученный раствор кипятить в течении
3-5 минут для удаления углекислоты. К
кипящему раствору прибавить 1 мл раствора
хлористого бария, содержащего ионы
магния (10 г. BaC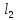 ∙2
∙2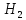 O
и 4г MgC
O
и 4г MgC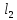 ∙6
∙6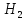 O
в 1 л) и снова прокипятить в течении 10-15
секунд. Через 10-15 минут нейтрализовать
децинормальным раствором едкого натра,
прибавляя его по каплям до перехода
красной окраски в желтую. Затем ввести
2,5 мл аммиачного буферного раствора,
несколько крупинок индикатора эриохрома
черного Т и титровать 0,1 н раствором
трилона Б (V3). В отдельной пробе определить
объем раствора трилона Б (V1), необходимый
для титрования 1 мл раствора хлористого
бария, содержащего ионы
O
в 1 л) и снова прокипятить в течении 10-15
секунд. Через 10-15 минут нейтрализовать
децинормальным раствором едкого натра,
прибавляя его по каплям до перехода
красной окраски в желтую. Затем ввести
2,5 мл аммиачного буферного раствора,
несколько крупинок индикатора эриохрома
черного Т и титровать 0,1 н раствором
трилона Б (V3). В отдельной пробе определить
объем раствора трилона Б (V1), необходимый
для титрования 1 мл раствора хлористого
бария, содержащего ионы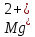 В
другой отдельной колбе определить объем
раствора трилона Б (V2), необходимый для
титрования ионов С
В
другой отдельной колбе определить объем
раствора трилона Б (V2), необходимый для
титрования ионов С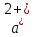 и M
и M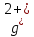 .
.
Расчет проводим по формуле:
X
=![]() мг/л,
мг/л,
Где
 - объем исследуемой воды (25 мл)
- объем исследуемой воды (25 мл)
N - нормальностьтрилона Б
Э - миллиграмм-эквивалент иона SO42 - (48)
 =
2,3 мл
=
2,3 мл
 =
0,5 мл
=
0,5 мл
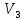 =
1,1 мл
=
1,1 мл
Результат: X = 326,4 мг/л.
Глава 5. Химические свойства воды
В![]() ода
– весьма активное в химическом отношении
вещество.
ода
– весьма активное в химическом отношении
вещество.
1) Вода реагирует со многими металлами с выделением водорода:
2Na + 2H2O = H2 + 2NaOH (бурно)
2K + 2H2O = H2 + 2KOH (бурно)
3Fe + 4H2O = 4H2 + Fe3O4 (только при нагревании)
Не все, а только достаточно активные металлы могут участвовать в окислительно-восстановительных реакциях этого типа. Наиболее легко реагируют щелочные и щелочноземельные металлы I и II групп.
Из неметаллов с водой реагируют, например, углерод и его водородное соединение (метан). Эти вещества гораздо менее активны, чем металлы, но все же способны реагировать с водой при высокой температуре:
C + H2O = H2 + CO (при сильном нагревании)
CH4 + 2H2O = 4H2 + CO2 (при сильном нагревании)
2) Вода разлагается на водород и кислород при действии электрического тока. Это также окислительно-восстановительная реакция, где вода является одновременно и окислителем, и восстановителем:
![]()
3) Вода реагирует со многими оксидами неметаллов. В отличие от предыдущих, эти реакции не окислительно-восстановительные, а реакции соединения:
|
SO2 |
+ |
H2O |
= |
H2SO3 |
|
|
|
|
|
сернистая кислота |
|
SO3 |
+ |
H2O |
= |
H2SO4 |
|
|
|
|
|
серная кислота |
|
CO2 |
+ |
H2O |
= |
H2CO3 |
|
|
|
|
|
угольная кислота |
4) Некоторые оксиды металлов также могут вступать в реакции соединения с водой. Примеры таких реакций мы уже встречали:
|
CaO |
+ |
H2O |
= |
Ca(OH)2 |
|
|
|
|
|
гидроксид кальция (гашеная известь) |
Не все оксиды металлов способны реагировать с водой. Часть из них практически не растворима в воде и поэтому с водой не реагирует. Мы уже встречались с такими оксидами. Это ZnO, TiO2, Cr2O3, из которых приготовляют, например, стойкие к воде краски. Оксиды железа также не растворимы в воде и не реагируют с ней.
5) Вода образует многочисленные соединения, в которых ее молекула полностью сохраняется. Это так называемые гидраты. Если гидрат кристаллический, то он называется кристаллогидратом. Например:
|
CuSO4 |
+ |
5 H2O |
= |
CuSO4.5H2O |
|
вещество белого цвета (безводный сульфат меди) |
|
|
|
кристаллогидрат (медный купорос), синие кристаллы |
Приведем другие примеры образования гидратов:
H2SO4 + H2O = H2SO4.H2O (гидрат серной кислоты)
NaOH + H2O = NaOH.H2O (гидрат едкого натра)
Соединения, связывающие воду в гидраты и кристаллогидраты, используют в качестве осушителей. С их помощью, например, удаляют водяные пары из влажного атмосферного воздуха.
6) Особая реакция воды – синтез растениями крахмала (C6H10O5)n и других подобных соединений (углеводов), происходящая с выделением кислорода:
6n CO2 + 5n H2O = (C6H10O5)n + 6n O2 (при действии света)
