
- •Содержание
- •Глава 1.Распространение воды на планете земля……………5
- •Глава 2.Строение состав воды………………………………………...6
- •Глава 3.Физические свойства воды……………………………….14
- •Глава 4.Определение временной или карбонатной жесткости воды…………………………………………………………....22
- •Глава 5.Химические свойства воды………………………………28
- •Глава 6.Загрязнение вод в тульской области………………….31
- •Введение
- •Глава 1. Распространение воды на планете земля
- •Глава 2.Строение и состав воды
- •2.1 Изотопный состав воды
- •2.2 Строение молекулы воды
- •2.3 Диаграмма состояния воды
- •Глава 3.Физические свойства воды
- •3.1 Определение физических показателей воды. Определение количества грубодисперсных примесей
- •3.1.1. Теоретическая часть
- •3.2. Определение содержания грубодисперсных примесей воды
- •3.2.1 Практическая часть
- •3.3 Определение запаха воды
- •3.4 Определение прозрачности воды
- •3.5 Определение цветности воды
- •3.6 Определение плотности жидкостей
- •3.6.1 Теоретическая часть
- •3.7 Определение плотности жидкости при помощи пикнометра
- •3.7.1 Практическая часть
- •3.8 Определение кислотности воды
- •3.8.1 Теоретическая часть
- •3.8.2 Практическая часть
- •Глава 4. Определение временной или карбонатной жесткости воды
- •4.1 Понятие и методы устранения жесткости воды
- •4.2 Проведение анализа
- •4.3 Определение сульфатов в воде
- •4.3.1 Теоретическая часть
- •4.3.2 Практическая часть
- •Глава 5. Химические свойства воды
- •Глава 6. Загрязнение вод в тульской области
- •Заключение
- •Литература
3.7 Определение плотности жидкости при помощи пикнометра
3.7.1 Практическая часть
Чистый
сухой пикнометр взвесить на аналитических
весах с точностью до 0,0002 г. Затем заполнить
его дистиллированной водой немного
выше метки, закрыть пробкой и поместить
в термостат. После 20-минутной выдержки
в термостате при температуре (20±0,1 С
уровень воды в пикнометре быстро довести
до метки, отбирая излишек воды пипеткой,
капилляром или свернутой полоской
чистой неволокнистой фильтровальной
бумаги. Пикнометр снова закрыть пробкой,
термостатировать еще 10 мин, проверить
соответствие уровня жидкости метке,
протереть снаружи досуха чистой мягкой
тканью или фильтровальной бумагой и
снова взвесить. После этого пикнометр
освободить от воды, споласнуть
последовательно спиртом и эфиром,
удалить остатки эфира продуванием
воздуха, заполнить пикнометр испытуемой
жидкостью и провести те же операции,
что и с дистиллированной водой.
С
уровень воды в пикнометре быстро довести
до метки, отбирая излишек воды пипеткой,
капилляром или свернутой полоской
чистой неволокнистой фильтровальной
бумаги. Пикнометр снова закрыть пробкой,
термостатировать еще 10 мин, проверить
соответствие уровня жидкости метке,
протереть снаружи досуха чистой мягкой
тканью или фильтровальной бумагой и
снова взвесить. После этого пикнометр
освободить от воды, споласнуть
последовательно спиртом и эфиром,
удалить остатки эфира продуванием
воздуха, заполнить пикнометр испытуемой
жидкостью и провести те же операции,
что и с дистиллированной водой.
3.8 Определение кислотности воды
3.8.1 Теоретическая часть
Кислотностью воды называется содержание в воде веществ, вступающих в реакцию с сильными щелочами (едким натром, едким кали). Объем 0,1 н. раствора щелочи, израсходованный на титрование таких веществ, соответствует общей кислотности воды.
В природных водах кислотность в большинстве случаев зависит только от содержания свободной растворенной углекислоты.
Часть кислотности, обусловленная присутствием гуминовых и других слабых органических кислот, растворенных в воде, называется естественной кислотностью воды; рН такой воды обычно не бывает ниже 4,5. Промышленные сточные воды могут содержать сильные кислоты или соли сильных кислот и слабых оснований (чаще всего железа и алюминия), подвергающиеся гидролизу в результате чего кислотность увеличивается.рН воды обычно в этих случаях снижается значительно ниже 4,5.
Та часть общей кислотности, при которой снижается рН воды до 4,5 и ниже, называется свободной кислотностью воды.
Кислотность воды определяют титрованием раствором сильного основания. Количество 0,1 н. раствора сильного основания, при израсходовании которого рН раствора достигает значения 4,5, соответствует свободной кислотности, а при израсходовании которого рН раствора достигает значения 8,3 - соответствует общей кислотности. Если рН исследуемой воды больше 8,3, то ее кислотность равна нулю.
3.8.2 Практическая часть
Предварительно определяют свободную кислоту, измеряя рН. Если предварительное определение показало наличие свободной кислоты, то проводят количественное определение свободной и общей кислотности.
Глава 4. Определение временной или карбонатной жесткости воды
4.1 Понятие и методы устранения жесткости воды
Жесткость
подразделяют на постоянную и временную,
она же карбонатная, она же устранимая
жесткость связана с присутствием в воде
наряду с
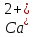 и
и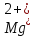 гидрокарбонатных или бикарбонатных
анионов (HCO3). Временную жесткость можно
устранить кипячением - отсюда и ее
название. При кипячении воды гидрокарбонатные
анионы вступают в реакцию с этими
катионами и образуют с ними очень мало
растворимые карбонатные соли, которые
выпадают в осадок.
гидрокарбонатных или бикарбонатных
анионов (HCO3). Временную жесткость можно
устранить кипячением - отсюда и ее
название. При кипячении воды гидрокарбонатные
анионы вступают в реакцию с этими
катионами и образуют с ними очень мало
растворимые карбонатные соли, которые
выпадают в осадок.
 +
2HC
+
2HC = CaC
= CaC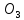 ↓+
↓+ O
+ C
O
+ C ↑
(1)
↑
(1)
Метод
определения карбонатной жесткости
путем титрования пробы воды соляной
кислотой измеряют вовсе не жесткость
так таковую, то есть не концентрацию
 и
и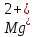 , а щелочность - концентрацию в растворе
гидрокарбонатных ионов.
, а щелочность - концентрацию в растворе
гидрокарбонатных ионов.
Если строго следовать определению карбонатной жесткости, то ее корректное измерение должно быть основано на кипячении заданного объема воды с последующим взвешиванием образовавшегося осадка (накипи), но на практике это трудно выполнимо. Поэтому поступают иначе.
Определение карбонатной жесткости воды приводится путем ее титрования соляной кислоты. Титрование - добавление в исследуемую пробу раствора реагента, концентрация которого заранее известна. По расходу этого реагента - он взаимодействует с тем веществом, содержание которого хотят определить, рассчитывают концентрацию определяемого вещества. Для аквариумных нужд удобно пользоваться 0,05 M раствором соляной кислоты. А также необходим индикатор метиловый оранжевый, который нужен для того, чтобы установить момент окончания титрования.
