
- •Лекция 1 Тема: основные химические понятия и законы. Цель: Ознакомить студентов с оснровными законами и понятиями, лежащими в основе химии.
- •Химия как наука и ее задачи.
- •Важнейшие законы, лежащие в основе химии.
- •Основные понятия химии
- •Закон Авогадро.
- •Уравнение состояния газа. Уравнение Менделеева-Клапейрона.
- •Лекция 2
- •2.Образование атомной кристаллической решетки
- •Лекция 3. Тема: Классификация неорганических соединений. Цель: Ознакомить студентов с разнообразием, строением и свойствами неорганических соединений
- •Кислота основание основание кислота
- •Лекция 4
- •Лекция 5
- •Лекция 6
- •2.Энергия активации. Энтропия активации
- •3.Факторы, влияющие на скорость гомо- и гетерогенных химических реакций. Катализ.
- •Лекция 7
- •2.Изменение энтропии в химическом процессе. Энергия Гиббса
- •Лекция 8
- •2. Коллигативные свойства растворов
- •3.Сильные и слабые электролиты
- •4. Растворы электролитов
- •5. Процесс диссоциации
- •6. Константа диссоциации. Смещение ионного равновесия
- •7. Особенности воды как электролита. Ионное произведение воды . РН раствора. Буферные растворы
- •8. Гидролиз солей. Расчёт концентрации ионов водорода в растворах
- •Лекция 9
- •2.Окислители и восстановители
- •1)Окислители
- •2)Восстановители
- •3)Окислительно-восстановительная двойственность
- •3.Составление уравнений окислительно-восстановительных реакций
- •1.Метод электронного баланса.
- •2.Метод полуреакций, или ионно-электронный метод.
- •Электрохимические процессы
- •2.Направление протекания овр
- •3.Электролиз
- •4.Законы электролиза
- •5.Применение электролиза
- •Лекция 10
- •2.Атомно-молекулярное учение. Основные химические понятия и определения
- •3.Строение атома
- •4. Квантовые числа. Правила заполнения электронных орбиталей
- •Периодический закон и периодическая система элементов д. И. Менделеева.
- •2.Свойства атомов
- •Лекция 11
- •2.Типы химической связи
- •3.Гибридизация атомных орбиталей
- •4.Метод валентных связей
- •Лекция 12
- •Комплексные соединения, их строение и номенклатура. Химическая связь в комплексных соединениях.
- •Устойчивость комплексных ионов. Константа нестойкости. Комплексные химические соединения.
- •Лекция 13
- •2. Водород
- •3. Вода
- •4. Пероксид водорода
- •5. Элементы viiа группы
- •6. Элементы viа группы
- •Общая характеристика элементов vа, ivа групп
- •1. Элементы vа группы.
- •2.Элементы ivа группы.
- •Характеристика металлов
- •1. Строение металлов.
- •2. Физические свойства металлов.
- •3. Химические свойства металлов.
- •Уменьшение химической активности нейтральных атомов
- •Уменьшение способности ионов к присоединению электронов
- •Характеристика элементов второй группы периодической системы
- •Стеарат натрия стеарат кальция
- •Сода осаждает кальций и магний тоже в виде карбонатов:
- •Характеристика элементов третей группы периодической системы
4. Пероксид водорода
Бинарное соединение. Молекула Н2О2 неплоская, имеет строение
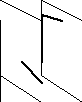
с σ-связью О – О на ребре и связями Н – О на плоскостях двугранного угла. Степень окисления кислорода равна -1, валентность равна 2. Группа – О – О – называется пероксигруппой (пероксидный мостик). Молекула полярна.
Бесцветная жидкость, вязкая (это обусловлено развитой системой водородных связей), тяжелее воды, чувствительна к свету и примесям (стабилизатор Н3РО4). Разлагается со взрывом при слабом нагревании, на катализаторе – при комнатной температуре. Неограниченно смешивается с водой. Разбавленными щелочами нейтрализуется не полностью. Сильный окислитель, слабый восстановитель.
Пероксид водорода применяется как отбеливатель текстиля, бумаги, кож, жиров и минеральных масел, окислитель ракетного топлива, реагент в органическом синтезе, при осветлении картин старых мастеров (потемневший красочный слой из-за перехода белил – гидроксикарбонатов свинца – в черный PbS осветляют переводом в белый PbSО4). В промышленности обычно используют взрывобезопасный 30%-ный раствор (пергидроль), в медицине – 3%-ный раствор.
Уравнения важнейших реакций:
2H2O2 = 2H2O + O2 (выше 150°С или на кат. MnO2)
H2O2(разб.) + NaOH(разб.) = NaHO2 + H2O
H2O2(конц.) + 2NaOH(т) = Na2O2↓+ 2H2O (0°С)
H2O2(3%) + 2H+ + 2I- = I2↓ + 2H2O
5H2O2 (30%) + I2(т) = 2HIO3 + 4H2O
H2O2 (10%) + SO32- = SO42- + H2O
4H2O2(30%) + PbS(черн.) = 4H2O + PbSО4 (бел.)↓
H2O2 + OH- + [Sn(OH)3]- = [Sn(OH)6]2-
3H2O2 + 2[Cr(OH)6]3- = 2СrO42- + 8H2O + 2OH-
H2O2(конц.) +Ag2O = 2Ag↓ + O2↑ + H2O
2H2O2(клнц.) + Ca(ClO)2 = CaCl2 + 2H2O +2O2↑
5H2O2 + 6H2SО4 + 2КMnO4 = 2MnSО4+ 5O2↑+ 8H2O + К2SО4
Получение: в лаборатории вначале синтезируют пероксид бария:
2BaO + O2(изб.) = 2BaO2 (до 500°С)
а затем его обрабатывают серной кислотой на холоду:
BaO2 + H2SO4 = BaSO4↓ + H2O2
В промышленности (старый метод) – электролиз водного раствора серной кислоты или сульфата аммония в специальных условиях; при этом кислота или соль не расходуются, а протекает электролиз воды с образованием на аноде пероксид водорода:
2 H2O → H2 + H2O2
Современный промышленный способ – окисление 2-этилантрагидрохинона кислородом воздуха на холоду:
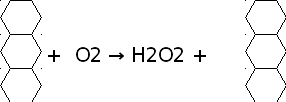
2-этилантрагидрохинон 2-этилантрахинон
Еще один промышленный способ – каталитическое окисление изопропилового спирта, ценным побочным продуктом реакции является ацетон:
(СН3)2СН(ОН) + О2 → СН3СОСН3 + Н2О2
5. Элементы viiа группы
Элементы VIIА группы носят групповое название галогены. Общая электронная формула валентного уровня атомов галогенов – ns2np5. Электроотрицательность элементов уменьшается от фтора к астату.
Все галогены в свободном виде построены из двухатомных молекул и являются типичными неметаллическими простыми веществами. Из них фтор и хлор – газы, бом – жидкость, йод – твердое вещество.
Окислительная способность простых веществ уменьшается от фтора к йоду, фтор – самый сильный окислитель. Изменение окислительных свойств галогенов проявляется в реакциях:
Cl2 + 2KBr = Br2↑ + 2KCl (кипячение)
I2 + 2KBrО3 = Br2 + 2KClO3
где галоген с меньшим порядковым номером всегда вытесняет галоген с большим порядковым номером из бескислородных солей последнего. Для кислородсодержащих солей наблюдается обратное.
Фтор – от греч. фторос (разрушающий); по разъедающему действию фтора на стекло. Лат. Fluorum (F) – от флуор (текучесть); по использованию в металлургии минерала флюорит в качестве плавня (флюса), понижающего температуру плавки.
Открыт К.-В. Шееле в 1771 г. При обработке минерала флуорит СаF2 серной кислотой (СаF2 + H2SО4 = СаSО4 ↓+ 2НF) он выделил НF в виде водного раствора (плавиковая кислота). В свободном виде фтор получили ввиду его агрессивности лишь сто лет спустя (А.Муассан, 1886). Наличие фтора в зубной эмали установлено в конце 18в. Промышленная химия фтора (особенно его органических соединений и полимеров) получила развитие только во 2-й половине 20в.
1.Нахождение в природе.
Содержание фтора в земной коре составляет 0,065%. В свободном состоянии не встречается. Важнейшими минералами, содержащими фтор, являются флуорит СаF2 (плавиковый шпат) и фторапатит 3Са3(РО4)2*СаF2.
2. Получение.
Фтор получают электролизом расплава КF*НF (при 250°С) или КF*2НF (при 100°С). Процесс проводят в медных или стальных электролизерах, катоды – медные или стальные, аноды – угольные.
Аппараты и коммуникации для работы со фтором обычно изготавливают из меди или никеля. Никель является наиболее стойким по отношению к фтору металлом.
3.Физические свойства.
Фтор – светло-желтый газ с резким, очень неприятным запахом, т.пл. - 219°С, т.кип. - 188°С. Фтор и его соединения сильно ядовиты (исключение СF4 , SF6).
4. Химические свойства.
В соединениях степень окисления фтора равна -1, т.е. все соединения фтора являются фторидами.
Являясь сильнейшим окислителем, фтор энергично реагирует со всеми простыми веществами за исключением кислорода, гелия, неона и аргона. Криптон взаимодействует со фтором при электрическом заряде. Ксенон горит в атмосфере фтора ярким пламенем, при этом образуется XeF4 и другие фториды ксенона. В атмосфере фтора горят даже такие негорючие в обычном понимании вещества, как асбест и вода. В соединениях с фтором элементы часто проявляют высшие степени окисления.
Исключительная химическая активность фтора обусловлена, с одной стороны, большой прочностью образуемых ими связей, так, энергия связи Е и(Н-F) = 566, Е (Si-F) = 582 кДж/моль, с другой стороны, низкой энергией связи в молекуле фтора Е (F-F) = 151 кДж/моль. Большая энергия связей фтора с элементами является следствием значительной электроотрицательности фтора и малого размера его атома. Низкое значение энергии связи в молекуле фтора, по-видимому, объясняется сильным отталкиванием электронных пар, находящихся на π-орбиталях, обусловленных малой длиной связи F-F. Благодаря малой энергии связи молекулы фтора легко диссоциируют на атомы.
Реакции с фтором водородсодержащих веществ (H2O, H2, NH3, B2H6, SiH4, AlH3 и др.) сопровождаются образованием НF:
2 NH3 + 3F2 = 6HF + N2
реакция протекает в газовой фазе при высокой температуре.
С водой фтор взаимодействует очень энергично:
2Н2О + 2F2 = 4HF + О2
Кроме кислорода образуются также озон и ОF2.
Фторид кислорода можно получить и по реакции:
2F2 + 2КОН(разб.) = 2КF + ОF2 + Н2О
Фтороводород растворяя в воде образует плавиковую кислоту. Важная особенность этой кислоты – способность к взаимодействию с оксидом кремния (IV):
SiO2 + 4HF = SiF4 + 2Н2О
Поэтому она разъедает стекло, и ее хранят в сосудах из парафина, каучука, полиэтилена или свинца.
5.Применение.
Фтор используют для фторирования органических соединений, синтеза различных хладоагентов (фреонов), получения фторопластов, в частности тефлона, образующегося при полимеризации тетрафторэтилена. Это хороший материал при лабораторных исследованиях, для изготовления аппаратуры в производстве особо чистых веществ. В технике используют фторосодержащие смазки.
Плавиковая кислота используется для удаления песка с металлического литья и для травления стекла, для разложения силикатов в химическом анализе.
Фтор и его соединения являются окислителями ракетных топлив.
Различные фторсодержащие соединения применяются для борьбы с вредителями сельского хозяйства.
ВF3 (активная кислота Льюиса) применяется как катализатор во многих органических синтезах.
Хлор, бром, йод, астат.
Хлор – от греч. клорос (желто-зеленый цвет увядающей листвы); по окраске газообразного хлора. Лат.Chlorum.
Открыт К.-В. Шееле (Швеция)в 1774 г. при обработке пиролюзита MnO2 соляной кислотой он выделил газ (MnO2 + 4НCl = MnCl2 + 2H2O + Cl2).
Бром – от греч. бромос (зловонный); по запаху жидкого брома. Лат. Bromum (Br).
Открыт А.-Ж. Баларом в 1826г. (Франция). Он действовал хлором на рассол морских соляных промыслов, содержащий бромиды. Важнейшим источником брома служат природные воды нефтяных и газовых скважин, морей и некоторых минеральных источников, а также рассолы калийного производства.
Йод – от греч. иодес (фиолетовый0; по цвету парообразного йода. Лат. Iodum.
Открыт Б. Куртуа в 1811г. (Франция). При кипячении серной кислоты с рассолом золы морских водорослей он наблюдал выделение фиолетового пара, при охлаждении превращающегося в темные кристаллы с ярким блеском:
2NaI + 2H2SO4 = I2 + SO2 + 2H2O + Na2SO4
Важнейшим природным источником йода служат буровые воды нефтяных и газовых скважин.
1.Нахождение в природе.
В природе в свободном виде хлор встречается только в вулканических газах. Широко распространены его соединения: хлорид натрия, хлорид калия, хлорид магния, сильвинит, состоящий из NaCl и KCl, карналлит состава KCl*MgCl2*6H2O, каинит состава MgSO4*KCl*3H2O и др. В природе 12-ый по химической распространенности элемент (5-й среди неметаллов).Третий по содержанию элемент в природных водах (после О и Н), особенно много хлора в морской воде (до 2% по массе). Жизненно важный элемент для всех организмов. У животных и человека хлорид-ионы Cl- участвуют в выработке желудочного сока, регулируют водный обмен.
Содержание в земной коре хлора – 0,017%, брома – 0,00016%, йода – 0,00004%, астата – ничтожно мало. Хотя содержание галогенов в природе небольшое, их не причисляют к редким элементам, так как основная масса этих элементов сконцентрирована в воде морей и океанов. Йод концентрируется в некоторых водорослях, в частности в ламинарии, из золы которых получают I2. Промышленным источником йода и брома служат воды ряда соленых озер и нефтяных скважин.
Йод также необходим для жизнедеятельности человека.
2. Получение.
В промышленности хлор получают электролизом водного раствора хлорида натрия.
2NaCl(расплав) → 2Na + Cl2
2NaCl + 2H2O → H2↑ + Cl2↑ + 2NaOH
В лаборатории хлор берут из баллонов, доставляемых с производства. Небольшие количества хлора удобно получать, действуя концентрированной соляной кислотой на MnO2 (при нагревании) или KMnO4:
4HCl + MnO2 → Cl2↑ + MnCl2 + 2H2O
2KMnO4 + 16HCl → 5Cl2 + 2MnCl2 + 2KCl + 8H2O
Особо чистый хлор получают нагреванием хлорида золота:
2AuCl3 → 2Au + 3Cl2
Бром получают из природной воды. После выделения из нее 75% хлорида натрия ее обрабатывают хлором, в результате выделяется бром; последний выдувают потоком воздуха и поглощают железными стружками или другими веществами.
Йод получают из содержащегося в природной воде иодида натрия действием окислителей (обычно хлора). Выделившийся йод извлекают из раствора адсорбцией на активном угле, с помощью ионитов или экстракцией.
3.Физические свойства.
Хлор – зеленовато-желтый газ с резким запахом, т.пл. - 101°С, т.кип. - 34°С. Ядовит. Жидкий хлор имеет желтую окраску.
Бром – красно-бурая жидкость, т.пл.-71°С, т. кип. 59°С. Пары брома имеют красную окраску.
Йод – черные, металлически блестящие кристаллы; т.пл. 114°С, т.кип. 183°С. Йод легко возгоняется, пар йода окрашен в фиолетовый цвет. Вдыхание паров йода и особенно брома разрушающе действует на дыхательные пути и поэтому опасно.
4. Химические свойства.
Для хлора характерны следующие степени окисления: -1(хлориды); +1(гипохлорит натрия NaClO, белильная известь CaOCl2); +3; +5 (хлорат калияKClO3); +7 (хлорная кислота HClO4 и перхлораты KClO4, NH4ClO4).
Бром проявляет характерные степени окисления -1(бромоводород и бромиды);+3; +5 (бромат калия KBrO3 ); +7.
Для йода характерны степени окисления -1 (иодоводород и иодиды); +1;+3;+5(иодат калия KIO3, иодноватый ангидрид I2O5);+7(иодная кислота H5IO6, метапериодаты натрия и калия NaIO4, KIO4).
Хлор легко взаимодействует со многими веществами. Из простых веществ он не ваимодействует только с углеродом, азотом, кислородом и благородными газами.
Галогены хорошо растворимы в органических растворителях.
Прочность связи в молекулах галогенов уменьшается при переходе от хлора к йоду (но возрастает при переходе от фтора к хлору).
Для галогенов характерны окислительно-восстановительные реакции.
Водород в хлоре сгорает:
Cl2 + H2 ↔ 2HCl
Хорошо растворим в воде, подвергается в ней дисмутации на 50% и полностью – в щелочном растворе:
Cl2 + H2O ↔ HClO + HCl
Cl2 + 2NaOH = NaClO + NaCl + H2O
3Cl2 + 6NaOH = NaClO3 + 5NaCl + 3H2O
Раствор хлора в воде называют хлорной водой, на свету кислота HClO разлагается на HCl и атомарный кислород, поэтому «хлорную воду» надо хранить в темной склянке. Хлор очень сильный окислитель по отношению к металлам и неметаллам:
Cl2 + Na = 2NaCl
3Cl2 + 2Fe → 2FeCl3 200°C
Cl2 + Se = SeCl4
5Cl2+ 2P = 2PCl5 90°C
Реакции с соединениями других галогенов:
Cl2 + 2KI = 2KСl + I2↓
3Cl2 + 3H2O + KI = 6HCl + KIO3 80°C
Качественная реакция – взаимодействие недостатка хлора с иодидом калия и обнаружение иода по синему окрашиванию после добавления раствора крахмала.
Йод в небольшой степени проявляет свойства, характерные для металлов. Например, в среде безводного этилового спирта может быть разлагающийся ниже 0°С нитрат йода I(NO3)3:
I2 + AgNO3 = AgI + INO3
3INO3 = I2 + I(NO3)3
Последний элемент подгруппы – астат – в природе не встречается. Его изотопы получают с помощью различных ядерных превращений, в частности, бомбардировкой Bi α-частицами в циклотроне:
20983Bi + 42He → 21185At + 210n
При плавлении облученного висмута астат улетучивается и может быть собран в охлаждаемом приемнике. Астат имеет период полураспада 8,3 ч, другие его изотопы распадаются еще быстрее.
5.Применение.
Хлор в больших количествах используется для производства растворителей, мономеров и полимеров (ПВХ), ядохимикатов, промежуточных продуктов.
Гипохлориты применяют для отделки тканей и бумажной массы, а также для дезинфекции.
Перхлораты применяют в качестве окислителей во взрывчатых смесях и ракетном топливе.
Галогениды алюминия служат катализаторами в органическом синтезе.
Бромид серебра используется для фотографии.
