
- •Лекция 1 Тема: основные химические понятия и законы. Цель: Ознакомить студентов с оснровными законами и понятиями, лежащими в основе химии.
- •Химия как наука и ее задачи.
- •Важнейшие законы, лежащие в основе химии.
- •Основные понятия химии
- •Закон Авогадро.
- •Уравнение состояния газа. Уравнение Менделеева-Клапейрона.
- •Лекция 2
- •2.Образование атомной кристаллической решетки
- •Лекция 3. Тема: Классификация неорганических соединений. Цель: Ознакомить студентов с разнообразием, строением и свойствами неорганических соединений
- •Кислота основание основание кислота
- •Лекция 4
- •Лекция 5
- •Лекция 6
- •2.Энергия активации. Энтропия активации
- •3.Факторы, влияющие на скорость гомо- и гетерогенных химических реакций. Катализ.
- •Лекция 7
- •2.Изменение энтропии в химическом процессе. Энергия Гиббса
- •Лекция 8
- •2. Коллигативные свойства растворов
- •3.Сильные и слабые электролиты
- •4. Растворы электролитов
- •5. Процесс диссоциации
- •6. Константа диссоциации. Смещение ионного равновесия
- •7. Особенности воды как электролита. Ионное произведение воды . РН раствора. Буферные растворы
- •8. Гидролиз солей. Расчёт концентрации ионов водорода в растворах
- •Лекция 9
- •2.Окислители и восстановители
- •1)Окислители
- •2)Восстановители
- •3)Окислительно-восстановительная двойственность
- •3.Составление уравнений окислительно-восстановительных реакций
- •1.Метод электронного баланса.
- •2.Метод полуреакций, или ионно-электронный метод.
- •Электрохимические процессы
- •2.Направление протекания овр
- •3.Электролиз
- •4.Законы электролиза
- •5.Применение электролиза
- •Лекция 10
- •2.Атомно-молекулярное учение. Основные химические понятия и определения
- •3.Строение атома
- •4. Квантовые числа. Правила заполнения электронных орбиталей
- •Периодический закон и периодическая система элементов д. И. Менделеева.
- •2.Свойства атомов
- •Лекция 11
- •2.Типы химической связи
- •3.Гибридизация атомных орбиталей
- •4.Метод валентных связей
- •Лекция 12
- •Комплексные соединения, их строение и номенклатура. Химическая связь в комплексных соединениях.
- •Устойчивость комплексных ионов. Константа нестойкости. Комплексные химические соединения.
- •Лекция 13
- •2. Водород
- •3. Вода
- •4. Пероксид водорода
- •5. Элементы viiа группы
- •6. Элементы viа группы
- •Общая характеристика элементов vа, ivа групп
- •1. Элементы vа группы.
- •2.Элементы ivа группы.
- •Характеристика металлов
- •1. Строение металлов.
- •2. Физические свойства металлов.
- •3. Химические свойства металлов.
- •Уменьшение химической активности нейтральных атомов
- •Уменьшение способности ионов к присоединению электронов
- •Характеристика элементов второй группы периодической системы
- •Стеарат натрия стеарат кальция
- •Сода осаждает кальций и магний тоже в виде карбонатов:
- •Характеристика элементов третей группы периодической системы
3.Гибридизация атомных орбиталей
При образовании химической связи (ковалентной) чаще всего участвуют орбитали, принадлежащие различным подуровням одного и того же атома. Электронные облака различаются как по форме, так и по энергии. При образовании же связи из разных по форме и энергии орбиталей образование одинаковых по форме и энергии электронных облаков. Происходит это вследствие перераспределения электронной плотности – гибридизация. (В процессе гибридизации образуется столько же гибридных облаков, сколько было негибридных облаков). Процесс гибридизации способствует выигрышу энергии для всей молекулы. Это связано с тем, что у гибридных орбиталей. Электронная плотность в сильной степени смещена к взаимодействующему атому, потенциал энергии в системе повышается, и орбитали дают более прочные и выгодные связи.
Если связь образуется при перекрывании орбиталей по линии, соединяющей ядра атомов, она называется -связью. Если p-орбитали взаимодействующих атомов ориентированы перпендикулярно оси связи, их перекрывание даёт -связь.
Примеры:
BeCl2 sp – гибридизация: s(шар)+p(правильная восьмерка) – образуют 2 sp – облака (по форме – неправильная восьмерка). Валентный угол =1800, форма молекулы – плоскостная линейная. Две sp–орбитали могут образовывать две -связи (BeCl2, ZnCl2). Ещё две -связи могут образовываться, если на двух p-орбиталях, не участвующих в гибридизации, находятся электроны. Пример – молекула ацетилена, C2H 2. Молекулы, в которых осуществляется sp–гибридизация, имеют линейную геометрию.
ВН3 sp2 – гибридизация: s(шар)+2p(правильная восьмерка) – образуют 3 sp2 – облака (по форме – неправильная восьмерка). Валентный угол =1200, форма молекулы – плоского треугольника. Три sp2–орбитали могут образовывать три -связи (BН3, AlCl 3). Ещё одна связь (-связь) может образовываться, если на p-орбитали, не участвующей в гибридизации, находится электрон. Пример - молекула этилена C2H 4. Молекулы, в которых осуществляется sp2–гибридизация, имеют плоскую геометрию.
СН4 sp3 – гибридизация: s(шар)+3p(правильная восьмерка) – образуют 4 sp3 – облака (по форме – неправильная восьмерка). Валентный угол =109028’ , форма молекулы – тетраэдрическая.
В молекуле метана на каждой из sp3–орбиталей атома углерода находится по одному электрону. Перекрывание с s-орбиталями атомов водорода, на каждой из которых имеется по одному электрону, приводит к образованию четырёх ковалентных -связей.
Форма молекулы воды – угловая, так как хоть и sp3 гибридизация, но имеютсяся 2 несвязывающие орбитали (у атома кислорода заполнение оболочек: 2 s2p4, валентный угол – 1050.
У аммиака – форма молекулы – пирамидальная, валентный угол – 1070, sp3 – гибридизация, но имеется одна несвязывающая орбиталь у атома азота (т.е орбиталь с неподеленной парой электронов).
4.Метод валентных связей
Метод валентных связей:
1.Связь образуется электронами с антипараллельными спинами.
2.Хим. связь всегда направлена в сторону максимального перекрывания электронных плотностей.
МВС (локализованных электронных пар) исходит из положения, что каждая пара атомов в молекуле удерживается вместе при помощи 1 или нескольких общих электронных пар. Т.е. в представлении МВС хим. связь локализована между двумя атомами, т.е. она двуцентровая и двухэлектронная.
Сила взаимодействия между электроном и ядром атома Н2 составляет 1030 эр/с. Встает вопрос, почему электрон не падает на ядро и атомная система стабильная. Объяснением служит 2 тезиса:
1) атом Н2
вращается по электронной обитали с
определенной скоростью, усиливает
эффекты отталкивания от ядра и этим
можно объяснить устойчивость системы.
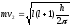 Однако
в стационарном состоянии скорость
движения электрона=0.
Однако
в стационарном состоянии скорость
движения электрона=0.
2)электрон падает на ядро и благодаря волновым свойствам удерживает систему в устойчивом состоянии. Однако этот процесс возможен в нейтронах звезд
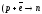
Единственным тезисом, который может объяснить причину устойчивости атома водорода является следующий: электрон стремится как можно занять больший объем. ΨH=ΨE
Сокращенное уравнение Шредингера для атома Н2 .Для рациональных способов решения уравнение Шредингера. От декартовых координат перешли к полярным координат r,Ө,μ разделили переменные величины и уравнение будет представлено в виде произведения 3х отдельных функций, каждая зависит от одного аргумента.
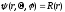 -
рациональная волновая функция зависит
от безразмерных величин n,e.
-
рациональная волновая функция зависит
от безразмерных величин n,e.
Ө(ө) Φ(φ) – сферические волновые функции зависят L, me,0.
Ур-е Шредингера в полярных координатах для атома Н2 решается в том случае, если безразмерная величина n принимает значение 1.2.3… ~, l, 0,1.2 до n-1 me +l, 0-l. Безразмерные величины были названы квантовыми числами.
Литература:
Ахметов, Н.С. Общая и неорганическая химия / Н.С.Ахметов. – 3-е изд. – М.: Высшая школа, 2000. – 743с.
Т.Браун. Химия – в центре наук / Браун.Т, Лемей Г.Ю. – М.: Мир, 1983. – тт. 1–2.
Карапетьянц М.Х. Общая и неорганическая химия / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 2002.
Коровин Н.В. Общая химия / Н.В.Коровин. – М.: Высшая школа, 2006. – 557 с.
Кузьменко Н.Е. Краткий курс химии / Н.Е. Кузьменко, В.В Еремин, В.А. Попков. – М.: Высшая школа , 2002. – 415 с.
Зайцев, О.С. Общая химия. Строение веществ и химические реакции / О.С.Зайцев. – М.: Химия, 1990.
Карапетьянц, М.Х. Строение вещества / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 1981.
