
- •Лекция 1 Тема: основные химические понятия и законы. Цель: Ознакомить студентов с оснровными законами и понятиями, лежащими в основе химии.
- •Химия как наука и ее задачи.
- •Важнейшие законы, лежащие в основе химии.
- •Основные понятия химии
- •Закон Авогадро.
- •Уравнение состояния газа. Уравнение Менделеева-Клапейрона.
- •Лекция 2
- •2.Образование атомной кристаллической решетки
- •Лекция 3. Тема: Классификация неорганических соединений. Цель: Ознакомить студентов с разнообразием, строением и свойствами неорганических соединений
- •Кислота основание основание кислота
- •Лекция 4
- •Лекция 5
- •Лекция 6
- •2.Энергия активации. Энтропия активации
- •3.Факторы, влияющие на скорость гомо- и гетерогенных химических реакций. Катализ.
- •Лекция 7
- •2.Изменение энтропии в химическом процессе. Энергия Гиббса
- •Лекция 8
- •2. Коллигативные свойства растворов
- •3.Сильные и слабые электролиты
- •4. Растворы электролитов
- •5. Процесс диссоциации
- •6. Константа диссоциации. Смещение ионного равновесия
- •7. Особенности воды как электролита. Ионное произведение воды . РН раствора. Буферные растворы
- •8. Гидролиз солей. Расчёт концентрации ионов водорода в растворах
- •Лекция 9
- •2.Окислители и восстановители
- •1)Окислители
- •2)Восстановители
- •3)Окислительно-восстановительная двойственность
- •3.Составление уравнений окислительно-восстановительных реакций
- •1.Метод электронного баланса.
- •2.Метод полуреакций, или ионно-электронный метод.
- •Электрохимические процессы
- •2.Направление протекания овр
- •3.Электролиз
- •4.Законы электролиза
- •5.Применение электролиза
- •Лекция 10
- •2.Атомно-молекулярное учение. Основные химические понятия и определения
- •3.Строение атома
- •4. Квантовые числа. Правила заполнения электронных орбиталей
- •Периодический закон и периодическая система элементов д. И. Менделеева.
- •2.Свойства атомов
- •Лекция 11
- •2.Типы химической связи
- •3.Гибридизация атомных орбиталей
- •4.Метод валентных связей
- •Лекция 12
- •Комплексные соединения, их строение и номенклатура. Химическая связь в комплексных соединениях.
- •Устойчивость комплексных ионов. Константа нестойкости. Комплексные химические соединения.
- •Лекция 13
- •2. Водород
- •3. Вода
- •4. Пероксид водорода
- •5. Элементы viiа группы
- •6. Элементы viа группы
- •Общая характеристика элементов vа, ivа групп
- •1. Элементы vа группы.
- •2.Элементы ivа группы.
- •Характеристика металлов
- •1. Строение металлов.
- •2. Физические свойства металлов.
- •3. Химические свойства металлов.
- •Уменьшение химической активности нейтральных атомов
- •Уменьшение способности ионов к присоединению электронов
- •Характеристика элементов второй группы периодической системы
- •Стеарат натрия стеарат кальция
- •Сода осаждает кальций и магний тоже в виде карбонатов:
- •Характеристика элементов третей группы периодической системы
2.Свойства атомов
1.Энэргия ионизации (I, э )
2.Энэргия сродства к ē (Е, эВ)
3.Электролтрицательность (Э.О, эВ)
4.Атомный радиус
Энергия ионизации [ I,эВ]- это энергия необходимая для отрыва1ē от атома(если атом многоэлектронен, то для него будет несколько энергий ионизаций.[ I ]атомов вычислены и сведены в табл. (табулированы)
Na 1s²2s²2p63s¹+ I→ ē+Na(1s²2s²2p6)
[ I ]изменяется по периодам и группам Наименьшей [I]обладают s¹s² элементы (Me). По группе сверху вниз[I] уменьшается. По периоду слева направо наблюдается тенденция к увеличению величины[I]. Наибольшим значением [I]обладают инертные газы.
Сродство к ē [Е,эВ ]– энергия ,которая выделяется при присоединении ē к нейтральному атому.
9F 1s² 2s² 2p5+ē→E+F¯(1s²2s²2p6).[Е] изменяется по периодам и группам. Наибольшим [Е]обладает F ,галогены,N,O2. .По группе сверху вниз наблюдается уменьшение[Е]; по периоду слева направо[Е] величина возрастает(табулирована).
Электроотрицательность
[Э.О,
эВ],величина,
характеризующая способность атома
концентрировать электронную плотность
.Качественно Э.О.можно оценить как
полусумму
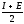 Существует шкала Э.О. Последнее время
общепринята шкала Э. О. по Полингу в
которой Э. О.
Li
принята за1. Из шкалы Полинга следует,
что наиболее электроотрицательный
F,галогены
,N,S,O2
. Э.О.<1 обладают щелочнее Ме.
Существует шкала Э.О. Последнее время
общепринята шкала Э. О. по Полингу в
которой Э. О.
Li
принята за1. Из шкалы Полинга следует,
что наиболее электроотрицательный
F,галогены
,N,S,O2
. Э.О.<1 обладают щелочнее Ме.
Атомный радиус (табл. А°, нм.) различают орбитальный и эффективный.
Орбитальный - экспериментально измеренный рентгеноструктурным анализом φ² в данной точке атомного пространства и имеет максимальное значение.
Эффективный – радиусы проявляемые в действии а) ковалентные б) кристаллические в) ионные. По своей величине они различны. Особенно различие увеличивается у d и f эл-ов .Величина атомного радиуса периодически изменяется по группам и периоду. В периодах по мере увеличения заряда ядра наблюдается общая тенденция уменьшения атомных и ионных радиусов. Наибольшее уменьшение атомных радиусов наблюдается у элементов малых периодов.
В больших периодах происходит постепенное (плавное) уменьшение радиусов и уменьшение носит не монотонный (скачкообразный) характер. Это объясняется d и f сжатием по периоду. Причины - d и f сжатия – эффект проникновения электронов к ядру, и эффект экранирования ядра электронами.
В периодической системе наблюдается закономерное изменение характеристик атома (энергии ионизации, сродства к электрону, электроотритцательности и атомных радиусов). Свойства атомов элементов позволяют судить о поведении атомов при образовании химической связи. Электроотрицательность служит для вычисления электронной плотности в молекуле.
Литература:
Ахметов, Н.С. Общая и неорганическая химия / Н.С.Ахметов. – 3-е изд. – М.: Высшая школа, 2000. – 743с.
Т.Браун. Химия – в центре наук / Браун.Т, Лемей Г.Ю. – М.: Мир, 1983. – тт. 1–2.
Карапетьянц М.Х. Общая и неорганическая химия / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 2002.
Коровин Н.В. Общая химия / Н.В.Коровин. – М.: Высшая школа, 2006. – 557 с.
Кузьменко Н.Е. Краткий курс химии / Н.Е. Кузьменко, В.В Еремин, В.А. Попков. – М.: Высшая школа , 2002. – 415 с.
Зайцев, О.С. Общая химия. Строение веществ и химические реакции / О.С.Зайцев. – М.: Химия, 1990.
Карапетьянц, М.Х. Строение вещества / М.Х. Карапетьянц, С.И.Дракин. – М.: Высшая школа, 1981.
