
- •Лекция 1 Тема: основные химические понятия и законы. Цель: Ознакомить студентов с оснровными законами и понятиями, лежащими в основе химии.
- •Химия как наука и ее задачи.
- •Важнейшие законы, лежащие в основе химии.
- •Основные понятия химии
- •Закон Авогадро.
- •Уравнение состояния газа. Уравнение Менделеева-Клапейрона.
- •Лекция 2
- •2.Образование атомной кристаллической решетки
- •Лекция 3. Тема: Классификация неорганических соединений. Цель: Ознакомить студентов с разнообразием, строением и свойствами неорганических соединений
- •Кислота основание основание кислота
- •Лекция 4
- •Лекция 5
- •Лекция 6
- •2.Энергия активации. Энтропия активации
- •3.Факторы, влияющие на скорость гомо- и гетерогенных химических реакций. Катализ.
- •Лекция 7
- •2.Изменение энтропии в химическом процессе. Энергия Гиббса
- •Лекция 8
- •2. Коллигативные свойства растворов
- •3.Сильные и слабые электролиты
- •4. Растворы электролитов
- •5. Процесс диссоциации
- •6. Константа диссоциации. Смещение ионного равновесия
- •7. Особенности воды как электролита. Ионное произведение воды . РН раствора. Буферные растворы
- •8. Гидролиз солей. Расчёт концентрации ионов водорода в растворах
- •Лекция 9
- •2.Окислители и восстановители
- •1)Окислители
- •2)Восстановители
- •3)Окислительно-восстановительная двойственность
- •3.Составление уравнений окислительно-восстановительных реакций
- •1.Метод электронного баланса.
- •2.Метод полуреакций, или ионно-электронный метод.
- •Электрохимические процессы
- •2.Направление протекания овр
- •3.Электролиз
- •4.Законы электролиза
- •5.Применение электролиза
- •Лекция 10
- •2.Атомно-молекулярное учение. Основные химические понятия и определения
- •3.Строение атома
- •4. Квантовые числа. Правила заполнения электронных орбиталей
- •Периодический закон и периодическая система элементов д. И. Менделеева.
- •2.Свойства атомов
- •Лекция 11
- •2.Типы химической связи
- •3.Гибридизация атомных орбиталей
- •4.Метод валентных связей
- •Лекция 12
- •Комплексные соединения, их строение и номенклатура. Химическая связь в комплексных соединениях.
- •Устойчивость комплексных ионов. Константа нестойкости. Комплексные химические соединения.
- •Лекция 13
- •2. Водород
- •3. Вода
- •4. Пероксид водорода
- •5. Элементы viiа группы
- •6. Элементы viа группы
- •Общая характеристика элементов vа, ivа групп
- •1. Элементы vа группы.
- •2.Элементы ivа группы.
- •Характеристика металлов
- •1. Строение металлов.
- •2. Физические свойства металлов.
- •3. Химические свойства металлов.
- •Уменьшение химической активности нейтральных атомов
- •Уменьшение способности ионов к присоединению электронов
- •Характеристика элементов второй группы периодической системы
- •Стеарат натрия стеарат кальция
- •Сода осаждает кальций и магний тоже в виде карбонатов:
- •Характеристика элементов третей группы периодической системы
Периодический закон и периодическая система элементов д. И. Менделеева.
СВОЙСТВА АТОМОВ
1.Периодический закон и периодическая система Д. И.Менделеева.
2.Свойства атомов.
1. Периодический закон и периодическая система элементов
Д. И. Менделеева
1) Закон Менделеева. Закон Мозли.
2)Периодичность свойств элементов в периодической системе. Вторичная периодичность и диагональное сходство.
3)Строение периодической системы элементов Д.И.Менделеева
1) В
своей классической формуле закон был
эмпирическим и это признавал сам
Менделеев, т.к. закон не опирался на
математический аппарат ,не вскрывал
причину периодичности свойств элементов,
некоторые атомы элементов не соответствовали
атомной массе размещенной в таблице .В
1914 г. Исследуя спектр рентгеновских
излучений Мозгли установил, что все
последующие элементы за атомом Н2
по своему
спектру напоминают спектр атома Н2,
только спектральные линии удаляются в
более коротковолновую область. Мозли
выводит √
из частоты
характеристического спектра атома
элемента пропорционального порядковому
номеру Эл-та
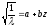 .
.
Работы Чадвига и Резерфорда подтвердили правильность закона Мозли. Действительно свойства элементов и их соединений измеряются по мере возрастания заряда ядер атомов. Периодический закон Менделеева нашел новую формулировку: свойства простых тем, а так же свойства их соединений находятся в периодической зависимости от порядкового номера атомов. Но закон оставался эмпирический. Закономерности изучения электронного строения атома позволили приобрести закону математический аппарат. При сопоставлении элементов и правил электронного строения атомов в периодической системе обнаружены следующие закономерности:
1) Номер периода соответствует n (главному квантовому числу)
2) На внешнем энергетическом уровне суммарное количество ē равно 8 (s² p6 )
3) На предвнешнем энергетическом уровне общее количество ē равно 18 (s²pd¹º)
4) Максимальное число ē определяется формулой 2n²
5) Свойства атомов элементов зависит от периодического изменения электронной структуры атомов.
2) Если рассматривать электронные структуры атомов в группах ,то наблюдается явление которое называется электронная аналогия элементов. Различают полные и неполные электронные аналогии. Например: 5гр N 1s²2s²2p³ максимальная валентность 3, т.к. у N отсутствует d подуровень.P 1s²2s²2p63s²3p³максимальная валентность 5, т.к. в возбужденном состоянии электрон с 3s nодуровня. переходят на свободную орбиталь 3d nодуровня. Хотя ē конфигурация внешних наружных уровней N и P одинакова. Эти элементы неполными ē аналогами.
P и As (мышьяк) -полное ē аналоги, т.к. у них есть свободный d nодуровень. P иV-неполные ē аналоги, т.к. в переходе участвуют электроны разных n/уровней. По мере заполнения электронами у d и f элементов в атомной системе резко проявляются эффекты проникновения электронов в ядро, по этому для d и f элементов присуща вторичная или внутренняя периодичность. При этом отмечено, что атомный радиус элементов изменяется незначительно.
Например :у лантанидов, начиная от Эл-та и кончая атомные радиусы изменяются примерно на 0,3 нм, количество ē возрастает значительно, поэтому от церия до тербия 4f подуровень заполняется наполовину (max f 7),а затем до гафния происходит спаривание ē до f14-происходит так называемое «лантоидное сжатие» ,которое оказывает большое влияние на свойства последующих элементов.
Исключением из правила Клечковского являются лантан и актиний. У этих элементов вместо 4f и 5f заполняется подуровень 5d и 6d .Это связано с особенностями распределения электронной плотности на 4 и 5 уровнях.
3) Первый период состоит из 2-х элементов: водорода и гелия. У водорода ē находится на первом энергетическом уровне, электронная формула - 1 s1, s - электронные облака имеют форму шара. В соответствие с принципом Паули на 1 орбитали может находится 2 ē, следовательно, у гелия 1 s2.
2 и 3 периоды содержат по 8 элементов. У элементов 2 периода заполняется 2-ой слой (n=2), сначала 2 s орбиталь, а затем последовательно 3 2p- орбитали.
У неона Ne – 8 внешних ē образуют высокосеммитричную структуру из 4-х устойчивых двухэлектронных облаков. У атомов Na, P и Ar заполняются соответственно 3s1, 3p3 и 3 p6 подуровни. 3d – орбитали остаются свободными.
Элементы у которых последним заполняется s- подуровень – s-элементы, а те, у которых последний p- подуровень – p-элементы.
4 и 5 периоды содержат по 18 элементов. В 4 периоде начинают заполнятся 4- s- орбиталь при свободной 3d – орбитали, так как это более выгодно энергетически. Далее начиная со скандия (Sc) начинают заполняться 3d орбитали (более энергетически выгодно)- так называемые d – элементы, а после них - заполняется 4- p подуровень. Аналогично и в 5 – ом периоде.
6 период содержит 32 элемента и 7 – незаконченный (25-27 элементов).
В 6 периоде начинает заполнятся после 6s – подуровня 4f- подуровень - лантаниды (церий – лютеций (Ce-Lu)). – f элементы. Потом заполняется 5d - подуровень, так как это более энергетически выгодно. В 7 периоде – после 7s заполняется 5f – подуровень – Актиниды (Th-Lr).
По мере роста заряда ядра происходит закономерная периодическая повторность сходных электронных структур, а следовательно и повторяемость свойств элементов.
