
- •Лекция 1 Тема: основные химические понятия и законы. Цель: Ознакомить студентов с оснровными законами и понятиями, лежащими в основе химии.
- •Химия как наука и ее задачи.
- •Важнейшие законы, лежащие в основе химии.
- •Основные понятия химии
- •Закон Авогадро.
- •Уравнение состояния газа. Уравнение Менделеева-Клапейрона.
- •Лекция 2
- •2.Образование атомной кристаллической решетки
- •Лекция 3. Тема: Классификация неорганических соединений. Цель: Ознакомить студентов с разнообразием, строением и свойствами неорганических соединений
- •Кислота основание основание кислота
- •Лекция 4
- •Лекция 5
- •Лекция 6
- •2.Энергия активации. Энтропия активации
- •3.Факторы, влияющие на скорость гомо- и гетерогенных химических реакций. Катализ.
- •Лекция 7
- •2.Изменение энтропии в химическом процессе. Энергия Гиббса
- •Лекция 8
- •2. Коллигативные свойства растворов
- •3.Сильные и слабые электролиты
- •4. Растворы электролитов
- •5. Процесс диссоциации
- •6. Константа диссоциации. Смещение ионного равновесия
- •7. Особенности воды как электролита. Ионное произведение воды . РН раствора. Буферные растворы
- •8. Гидролиз солей. Расчёт концентрации ионов водорода в растворах
- •Лекция 9
- •2.Окислители и восстановители
- •1)Окислители
- •2)Восстановители
- •3)Окислительно-восстановительная двойственность
- •3.Составление уравнений окислительно-восстановительных реакций
- •1.Метод электронного баланса.
- •2.Метод полуреакций, или ионно-электронный метод.
- •Электрохимические процессы
- •2.Направление протекания овр
- •3.Электролиз
- •4.Законы электролиза
- •5.Применение электролиза
- •Лекция 10
- •2.Атомно-молекулярное учение. Основные химические понятия и определения
- •3.Строение атома
- •4. Квантовые числа. Правила заполнения электронных орбиталей
- •Периодический закон и периодическая система элементов д. И. Менделеева.
- •2.Свойства атомов
- •Лекция 11
- •2.Типы химической связи
- •3.Гибридизация атомных орбиталей
- •4.Метод валентных связей
- •Лекция 12
- •Комплексные соединения, их строение и номенклатура. Химическая связь в комплексных соединениях.
- •Устойчивость комплексных ионов. Константа нестойкости. Комплексные химические соединения.
- •Лекция 13
- •2. Водород
- •3. Вода
- •4. Пероксид водорода
- •5. Элементы viiа группы
- •6. Элементы viа группы
- •Общая характеристика элементов vа, ivа групп
- •1. Элементы vа группы.
- •2.Элементы ivа группы.
- •Характеристика металлов
- •1. Строение металлов.
- •2. Физические свойства металлов.
- •3. Химические свойства металлов.
- •Уменьшение химической активности нейтральных атомов
- •Уменьшение способности ионов к присоединению электронов
- •Характеристика элементов второй группы периодической системы
- •Стеарат натрия стеарат кальция
- •Сода осаждает кальций и магний тоже в виде карбонатов:
- •Характеристика элементов третей группы периодической системы
3.Сильные и слабые электролиты
Отдельные электролиты при одинаковой нормальности растворов диссоциируют на ионы различно. Особенно это заметно у кислот. Это различие обусловлено характером валентной связи между атомами, образующими их молекулы. Чем более полярна связь между водородом и остальной частью молекулы (для кислот), тем легче отщепляется водород, тем сильнее диссоциирует кислота.
Электролиты, хорошо диссоциирующие на ионы – сильные, плохо – слабые.
Растворы сильных электролитов сохраняют высокую электропроводность даже при очень больших концентрациях. Для слабых электролитов – наоборот. К сильным электролитам относят кислоты: соляную, азотную, серную и некоторые другие; щелочи (кроме NH4OH) и почти все соли.
Многоосновные кислоты и основания диссоциируют ступенчато:
H2SO4 ↔ H+ + HSO4-
HSO4- ↔ H+ +SO4- (идет труднее)
Ba(OH)2 ↔ BaOH+ + OH-
BaOH+ ↔ Ba2+ + OH-
Соли:
средние:
NaCl↔ Na+ + Cl-
кислые:
NaHCО3 ↔ Na+ + HCO3-
HCO3- ↔ H+ + CO32- (идет очень сложно)
Сильные электролиты подчиняются теории Дебая-Хюккеля, слабые - Аррениуса.
Степень диссоциации
Кдис
=
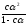 ≈Сα2
- закон
разбавления Оствальда.
≈Сα2
- закон
разбавления Оствальда.
Из уравнения следует, что с разбавлением раствора степень диссоциации электролитов увеличивается.
Их поведение исследовано Дебаем и Гюккелем, которые сформулировали теорию поведения сильных электролитов( Теория Дебая-Гюккеля).
Положения:
1. Сильные электролиты диссоциируют в водных растворах нацело αтеор= 100%
2.
В растворах сильных электролитов
существует взаимодействие между ионами:
каждый (+)-заряж. ион окружается оболочкой
из (-) – заряж. ионов, а (-) – заряж. ион
окружен соответственно (+)-заряж. ионами.
т.е. каждый ион заключен в своей атмосфере
из противоионов. Ионная атмосфера
тормозит движение ионов в р-ре, и сила
торможения определяется ионной силой
раствора (μi),
которая измеряется: μi
=
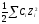
3.
За счет ионных взаимодействий степень
диссоциации сильных электролитов
отличается от 100% - кажущаяся степень
диссоциации. Чем больше концентрация
раствора – тем больше отличается степень
диссоциации от 100%. Кажущаяся степень
диссоциации определяется экспериментально
по электропроводности раствора. αкаж
=
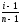 (
αкаж
определяется
с учетом изотонического коэффициента
i).
(
αкаж
определяется
с учетом изотонического коэффициента
i).
4. Концентрации сильных электролитов измеряются активностями (a).
a=f•c (в моль/л). f- коэффициент активности, c – концентрация в моль/л.
f- коэффициент активности – показывает отклонение реального раствора электролита от идеального.
В разбавленных р-рах f→ 1 концентрационный коэффициент активности - величины табулированы.
γ - термодинамический коэффициент активности (при давлении = 1 атм., t=250C (2980K) (величины γ также табулированы). f≠γ .
К слабым электролитам относятся амфотерные электролиты – это гидроксиды d и p элементов 2-х или 3-х заряженных катионов, в зависимости от рН среды могут диссоциировать как по кислотному, так и по основному типу и взаимодействовать со щелочами и кислотами. Они диссоциируют ступенчато, и на каждой ступени имеют собственную константу диссоциации.
По основному типу (рН <7): Zn(OH)2 ↔ ZnOH++ OH- (Кдис 1); ZnOH+ ↔ Zn2++OH-(Кдис 2). ( В водных растворах могут образовываться соответствующие основные соли).
По типу кислоты (рН>7): Zn(OH)2↔НZnO2- + H+ (Кдис 1); НZnO2- ↔ ZnO22+ + H+(Кдис 2). В водных растворах могут образовываться соответствующие кислые соли).
В избытке щелочи обр-ся только средние соли.
При сплавлении со щелочами: 2NaOH+Zn(OH)2→Na2ZnO2+2H2O
В примере с хромом (HCrO2 – хромистая кислота).
