
Фтизиатрия / Фтизиатрия
.PDF
контакте с бактериовыделите* лем он позволяет избежать инфицирования МБТ. При более длительном контакте здорового человека с источником инфекции мукоцили* арный клиренс способствует уменьшению числа микобактерий, проникающих в концевые отделы дыхательных путей. В результате, несмотря на происходящее инфицирование, вероятность заболевания туберкулезом снижается.
Нарушения мукоцилиар* ного клиренса, возникающие при остром или хроническом воспалении верхних дыхательных путей, трахеи и круп-
ных бронхов, а также при воздействии токсичных веществ, создают предпосылки для поступления МБТ в бронхиолы и альвеолы. В этих случаях вероятность аэрогенного инфицирования МБТ и заболевания туберкулезом при прочих равных условиях значительно увеличивается.
При алиментарном пути заражения МБТ возможность и исход первичного инфицирования в значительной степени зависят от состояния кишечной стенки и всасывающей функции кишечника.
В зависимости от места внедрения МБТ первоначально могут проникать в легкое, миндалины, кишечник и другие органы и ткани. Поскольку возбудители туберкулеза не выделяют экзотоксин, а возможности для их фагоцитоза на этом этапе весьма ограничены, присутствие в тканях небольшого числа микобактерий обычно проявляется не сразу. Микобактерии находятся внеклеточно, медленно размножаются, а окружающая их ткань сохраняет нормальную структуру. Такое состояние определяется как латентный микробизм, при котором макроорганизм проявляет толерантность к МБТ. Независимо от начальной локализации микобактерии с током лимфы довольно быстро попадают в регионарные лимфатические узлы, а затем лимфогематогенным путем распространяются по организму. Возникает первичная облигатная (обязательная) мико бактериемия. Микобактерии оседают в органах с наиболее развитым микроциркуляторным руслом — в легких, лимфатических узлах, корковом слое почек, эпифизах и метафизах трубчатых костей, ампуллярно*фимбриональных отделах маточных труб, увеальном тракте глаза.
МБТ, оседая в различных тканях, продолжают размножать*
40
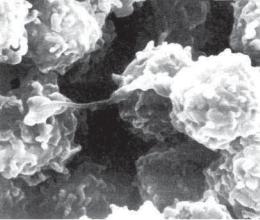
Рис. 3.3. Альвеолярные макрофаги. Электронограмма. х 6000.
ся. Популяция возбудителей туберкулеза может значительно увеличиться, прежде чем сформируется иммунитет и появится реальная возможность для их разрушения и элиминации.
В месте расположения микобактериальной популяции возникает неспецифическая защитная реакция — фагоцитоз. Первыми фагоцитирующими клетками, которые пытаются поглотить и разрушить МБТ, являются полинуклеарные лейкоциты. Однако их бактерицидный потенциал оказывается недостаточным для защитной функции. Полинуклеарные лейкоциты, вступившие в контакт с МБТ, погибают.
Вслед за полинуклеарами с МБТ взаимодействуют макрофаги (рис. 3.3). Первая фаза такого взаимодействия состоит в фиксации МБТ на клеточной мембране макрофага специальными рецепторами. Следующая, вторая фаза направлена на поглощение МБТ. Участок плазмолеммы макрофага погружается в цитоплазму и образуется фагосома, содержащая МБТ. Третья, завершающая фаза связана с формированием фаголи* зосомы, которая возникает при слиянии фагосомы и лизосо* мы макрофага. В этих условиях протеолитические лизосо* мальные ферменты могут оказывать расщепляющее действие на поглощенные МБТ и разрушать их (рис. 3.4).
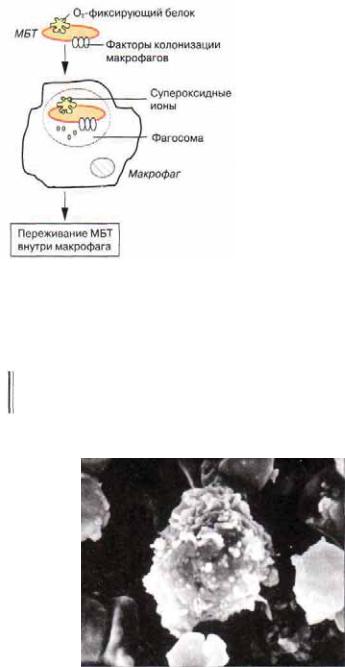
В большинстве случаев первичный контакт МБТ и макрофага происходит на фоне дисфункции лизосом фагоцитирующей клетки. Появление этой дисфункции связано с повреждающим воздействием на лизосомальные мембраны АТФ по ложительных протонов, сульфатидов и корд фактора, которые синтезируются МБТ. Дисфункция лизосом препятствует образованию фаголизосомы, и лизосомальные ферменты не могут воздействовать на поглощенные микобактерии. В этих случаях
41
|
макрофаг |
|
становится |
||||
|
своеобразным |
контей- |
|||||
|
нером |
для |
возбудителя |
||||
|
туберкулеза |
(рис. |
3.5). |
||||
|
Внутриклеточно |
распо- |
|||||
|
ложенные МБТ продол- |
||||||
|
жают |
расти, |
размно- |
||||
|
жаться |
и |
инициировать |
||||
|
образование |
|
веществ, |
||||
|
которые оказывают по- |
||||||
|
вреждающее |
|
действие |
||||
|
на |
клетку*хозяина. |
|||||
|
Макрофаг |
|
постепенно |
||||
|
погибает, |
и |
микобакте- |
||||
|
рии вновь |
попадают в |
|||||
|
межклеточное |
|
про- |
||||
|
странство. |
Такое |
взаи- |
||||
|
модействие МБТ и мак- |
||||||
Рис. 3.4. Взаимодействие МБТ и мак- |
рофага |
называют |
неза- |
||||
вершенным |
фагоцито- |
||||||
рофага [по М. А. Пальцеву]. |
|||||||
зом. Дальнейшая |
судьба |
||||||
|
|||||||
|
микобактерий |
и |
исход |
||||
первичного инфицирования зависят от способности организма активировать макрофаги и создавать условия для завершенного фагоцитоза.
В активации макрофагов и повышении устойчивости организма к действию МБТ ведущая роль принадлежит приобретенному клеточному иммунитету.
Рис. 3.5. Т*лимфоциты. Электронограмма. х 10 000.
42

Рис. 3.6. Активированный макрофаг. Электронограмма. х 6000.
В основе приобретенного клеточного иммунитета лежит эффективное взаимодействие макрофагов и лимфоцитов. Особое значение приобретает контакт макрофагов с Т*хелпе* рами (CD4+) и Т*супрессорами (CD8+). Макрофаги, поглотившие МБТ, экспрессируют на своей поверхности антигены микобактериальных клеток в виде пептидов. Они также выделяют в межклеточное пространство медиаторы, в частности интерлейкин*1 (ИЛ*1), которые активируют Т*лимфоциты (CD4+). В этих условиях Т*хелперы (CD4+) взаимодействуют с макрофагами и воспринимают информацию о генетической структуре возбудителя. Сенсибилизированные
Т*лимфоциты (CD4+;
CD8+) выделяют медиаторы*лимфокины — хематак* сины, гамма*интерферон, интерлейкин*2 (ИЛ*2), которые активируют миграцию макрофагов в зону расположения МБТ, повышают ферментативную и общую бактерицидную активность макрофагов (рис. 3.6, 3.7).
Активированные макрофаги способны усиленно генерировать весьма агрессив*
Рис. 3.7. Активированный макрофаг. Трансмиссионная электронограмма. х 14 000.
43
ные формы кислорода и перекись водорода, что сопровождается так называемым кислородным взрывом, воздействующим на фагоцитируемый возбудитель туберкулеза. Одновременно с участием L*аргини* на и фактора некроза опухоли*альфа (ФНО*α) образуется оксид азота (NO), который также обусловливает выраженный антимикобактери* альный эффект. Под влиянием всех этих
факторов способность микобактерий препятствовать образованию фаголизосомы значительно ослабевает. Завершающая стадия фагоцитоза, направленная на переваривание возбудителя, протекает благополучно, и МБТ подвергаются разрушающему действию лизосомальных ферментов (рис. 3.8).
При адекватном развитии иммунного ответа каждое последующее поколение макрофагов, вступающее во взаимодействие с туберкулезным возбудителем, становится все более им* мунокомпетентным. Высокий бактерицидный потенциал активированных макрофагов обеспечивает возможность разрушения поглощенных МБТ и защиту человека от возбудителя туберкулеза.
Выделяемые макрофагами медиаторы активируют и В*лимфоциты, ответственные за синтез иммуноглобулинов. Однако накопление в крови имуноглобулинов практически не повышает устойчивость организма к МБТ. Полезным можно считать лишь образование опсонизирующих антител, которые формируются к полисахаридным компонентам МБТ. Они обволакивают микобактерии и способствуют их склеиванию, облегчая последующий фагоцитоз.
При первичном инфицировании МБТ становление иммунитета происходит одновременно с медленным размножением микобактерий и развитием локальных воспалительных изменений. Повышение ферментативной активности макрофагов и лимфоцитов приводит к дополнительному синтезу веществ, инициирующих повышение сосудистой проницаемости и развитие воспалительной реакции. Такими веществами являются фактор роста, фактор переноса, кожно*реактивный фактор, ФНО*α, оксид азота. С их действием связывают появление у клеток повышенной чувствительности замедленного типа (ПЧЗТ) к антигенам МБТ. В месте локализации туберкулезно*
44
го возбудителя возникает специфическая клеточная реакция, способная ограничить распространение микобактерий. Под воздействием медиаторов иммунного ответа фагоцитирующие и иммунокомпетентные клетки устремляются к месту локализации микобактерий. Макрофаги трансформируются в эпите* лиоидные клетки и гигантские многоядерные клетки Пирого* ва—Лангханса, участвующие в ограничении зоны воспаления. Образуется экссудативно*продуктивная или продуктивная туберкулезная гранулема, которая по сути является морфологическим проявлением иммунной реакции организма на микобак* териальную агрессию. Формирование гранулемы свидетельствует о высокой иммунологической активности и способности организма локализовать туберкулезную инфекцию. Компактное расположение клеток гранулемы обеспечивает лучшие условия для взаимодействия фагоцитирующих и иммунокомпе* тентных клеток. На высоте гранулематозной реакции в гранулемах преобладают Т*лимфоциты, присутствуют и В*лимфоциты. В гранулеме находится множество макрофагов, которые продолжают выполнять фагоцитарную, аффекторную и эф* фекторную функции в иммунном ответе. Эпителиоидные клетки менее способны к фагоцитозу, они активно осуществляют пиноцитоз и синтез гидролитических ферментов. В центре гранулемы может появиться небольшой участок казеозно* го некроза, который формируются из тел макрофагов, погибших при контакте с МБТ.
Реакция ПЧЗТ появляется через 2—3 нед после инфицирования, а достаточно выраженный клеточный иммунитет формируется через 8 нед.
По мере развития иммунного ответа размножение микобактерий замедляется, их общее число уменьшается, специфическая воспалительная реакция затихает. Однако окончательной ликвидации возбудителя туберкулеза не происходит даже при полноценном взаимодействии макрофагов и Т*лим* фоцитов. Определенная популяция МБТ сохраняется в организме хозяина в виде живых, нередко биологически измененных особей (в частности, L*форм). Они локализуются в единичных туберкулезных гранулемах, окруженных плотной фиброзной капсулой. Сохранившиеся МБТ локализуются внутри* клеточно и предотвращают формирование фаголизосомы, поэтому для лизосомальных ферментов они недоступны. В связи с сохранением микобактерий противотуберкулезный иммунитет называют нестерильным. Оставшиеся в организме МБТ поддерживают популяцию сенсибилизированных Т*лимфоци* тов и обеспечивают достаточную эффективность защитных иммунологических реакций. Инфицированный микобактериями человек сохраняет их в своем организме весьма длительное время, иногда всю жизнь. При возникновении нару*
45

шений в иммунном балансе появляется реальная угроза активации сохранившейся микобактериальной популяции и заболевания туберкулезом.
Антимикобактериальная эффекторная функция макрофагов варьирует в зависимости от генетической структуры человека, его возраста, пола, гормонального фона, наличия или отсутствия сопутствующих заболеваний. Она зависит также от вирулентности МБТ.
Допускают, что особенности генетической структуры человека детерминируют функциональную активность макрофагов, Т* и В*лимфоцитов и тем самым способствуют развитию клеточного иммунитета или сдерживают его. Установлена ассоциация заболевания туберкулезом с наличием в генотипе человека определенных аллелей — HLA А11*В15 и HLA DR*2. Эти аллели рассматривают как генетические маркеры повышенной восприимчивости к возбудителю туберкулеза.
Приобретенный иммунитет снижается при СПИДе, сахарном диабете, язвенной болезни, злоупотреблении алкоголем, длительном применении наркотиков. Противотуберкулезный иммунитет ослабевает при голодании, стрессовых ситуациях, беременности, лечении гормонами или иммуно* депрессантами.
Для защиты от возбудителя туберкулеза определенное значение имеют гуморальные факторы естественной резистентности (комплемент, лизоцим, пропердин, интерферон и др.). Они приобретают существенное значение у новорожденных детей, имеющих физиологическую недостаточность иммунной системы и неспособных к формированию клеточного иммунитета. У взрослых этим факторам защиты от МБТ принадлежит второстепенная роль.
В целом риск развития туберкулеза у впервые инфицированного человека составляет около 8 % в первые 2 года после заражения, в последующие годы он постепенно снижается.
3.2. Клинически выраженный туберкулез
Недостаточная активация макрофагов и неэффективный фагоцитоз приводят к неконтролируемому размножению проникших в организм микобактерий и увеличению микобактериальной популяции в геометрической прогрессии. В течение 20 дней может появиться более 500 млн новых МБТ. Их взаимодействие с полинуклеарными лейкоцитами и макрофагами приводит к массовой гибели фагоцитирующих клеток. При этом в межклеточное пространство поступает большое коли*
46

чество медиаторов и протеолитических ферментов, повреждающих прилежащие ткани. Следствием является своеобразное «разжижение» тканей с формированием особой питательной среды, способствующей росту и размножению расположенных внеклеточно микобактерий.
Большая интенсивно размножающаяся популяция микобактерий индуцирует дисбаланс в иммунной защите: количество Т*супрессоров (CD8+) увеличивается, иммунологическая активность Т*хелперов (CD4+) уменьшается, наступает резкое усиление, а затем угнетение ПЧЗТ к антигенам МБТ. Возможности организма для локализации и отграничения возбудителя туберкулеза ухудшаются. Воспалительная реакция приобретает распространенный характер. Возникают выраженные нарушения микроциркуляции с повышением проницаемости сосудистой стенки и поступлением в ткани белков плазмы, лейкоцитов и моноцитов. В формирующихся туберкулезных гранулемах преобладает казеозный некроз, их клеточная составляющая выражена слабо. Инфильтрация наружного слоя полинуклеарными лейкоцитами, макрофагами и лимфоидны* ми клетками усиливается. Отдельные гранулемы сливаются, общий объем туберкулезного поражения увеличивается. Изменяется биологическая суть происходящего процесса — первичное инфицирование трансформируется в клинически выраженный туберкулез.
3.3. Морфология локальных изменений
Тканевая реакция в месте локализации МБТ первоначально имеет неспецифический характер. Такая реакция наблюдается в тканях независимо от вида возбудителя. Происходят нарушения микроциркуляции, повышение проницаемости сосудистой стенки, локальный отек тканей, инфильтрация зоны поражения лейкоцитами, моноцитами и другими форменными элементами крови. Первые специфические морфологические признаки туберкулезного воспаления появляются позднее, через 2—3 нед после инфицирования МБТ.
Специфическое воспаление. Развитие специфического для туберкулеза воспаления обусловлено иммунологическими сдвигами, которые возникают при взаимодействии макроорганизма с туберкулезным возбудителем. В связи с этим специфическую воспалительную реакцию при туберкулезе характеризуют как классический пример воспаления на иммунной основе.
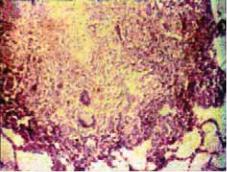
Основообразующим морфологическим элементом туберкулезного воспаления является бугорок, который чаще называют туберкулезной гранулемой.
47

Рис. 3.9. Туберкулезные очаги в легком. Фрагмент гистотопографиче* ского среза.
Визуализация туберкулезной гранулемы возможна при световой микроскопии (рис. 3.9).
Важнейшей отличительной чертой туберкулезной гранулемы является наличие центрально расположенной зоны творожистого, или казеозного, некроза — плотного аморфного тканевого детрита, образовавшегося вследствие повреждения и гибели фагоцитов. Зона казеозного некроза окружена несколькими слоями эпителиоидных клеток, макрофагов, лимфоцитов и плазматических клеток. Среди эпителиоидных клеток располагаются крупные многоядерные клетки Пирогова— Лангханса. В наружных отделах клеточного слоя можно увидеть полинуклеарные лейкоциты и фибробласты. Клеточные элементы, расположенные вокруг зоны казеозного некроза, образуют грануляционную ткань. В клетках, расположенных ближе к казеозно*некротическим массам, отмечаются признаки дистрофии и деструкции.
Специфическое воспаление захватывает различные морфологические структуры пораженного органа — клетки паренхимы, лимфатические и кровеносные сосуды. При туберкулезе легкого в специфическую воспалительную реакцию также вовлекаются бронхи.
Иммуноморфологические особенности специфического воспаления позволяют считать туберкулез гранулематоз* ным заболеванием.
Функциональное состояние паренхиматозных клеток в зоне поражения существенно нарушается. В них отчетливо вы*
48
являются признаки дистрофии и деструкции. Резко снижается резорбтивная функция лимфатических капилляров. Возникают повреждения эндотелия лимфатических капилляров с выходом лимфы в межклеточное пространство. Наблюдаются грубые нарушения микроциркуляции с тромбозом мелких кровеносных сосудов. Повреждения кровеносных сосудов обусловлены фиксацией в их базальном слое циркулирующих иммунных комплексов (ЦИК), которые в виде очаговых отложений можно обнаружить при электронной микроскопии. Кровеносные капилляры в туберкулезной гранулеме практически отсутствуют. Питание клеточных элементов осуществляется в основном путем омывания их тканевой жидкостью.
Клеточный состав гранулемы подвержен динамическим изменениям на разных стадиях ее развития. По преобладанию того или иного типа клеточных элементов выделяют эпите* лиоидно*клеточные, лимфоидные и гигантоклеточные туберкулезные гранулемы. В случаях преобладания зоны некроза гранулемы называют некротическими
Особенности клеточного состава гранулемы и выраженность некротических изменений зависят от характера тканевой реакции в зоне поражения. При продуктивной тканевой реакции в гранулеме преобладают эпителиоидные, макрофа* гальные, многоядерные гигантские клетки. Внешний отдел клеточного слоя содержит фибробласты, которые синтезируют коллаген. Некротические изменения в центре гранулемы выражены слабо, а иногда отсутствуют. Преобладание экссуда тивной тканевой реакции проявляется увеличением зоны некроза. Она занимает 1/3 или 1/2 общего объема гранулемы. В клеточном слое преобладают макрофаги и лимфоидные элементы с ограниченным присутствием эпителиоидных и гигантских клеток на границе с зоной казеозного некроза. Преимущественно альтеративная реакция характеризуется формированием некротических гранулем, в которых клеточный вал выражен крайне слабо, а иногда практически отсутствует.
Преобладание экссудативной тканевой реакции свидетельствует о прогрессировании туберкулезного воспаления. Ткань, окружающая отдельные гранулемы, пропитывается серозно* фибринозным экссудатом. Постепенно происходит слияние гранулем. В результате формируется туберкулезный очаг —па тологическое образование диаметром до 1,5 см (рис. 3.10). Прогрессирование очагов проявляется расширением зоны пе* рифокального воспаления, которое вначале может быть серозным, фибринозным или гнойным. Затем возникают признаки специфического воспаления — образуются новые туберкулезные гранулемы с выраженной зоной некроза, окруженной слоем из немногочисленных эпителиоидных и единичных гигантских клеток. Грануляционная ткань инфильтрируется макрофагами, лимфоидными элементами, а также полинук*
49
