
3 курс / Патологическая физиология / Основы общей патологии
.pdf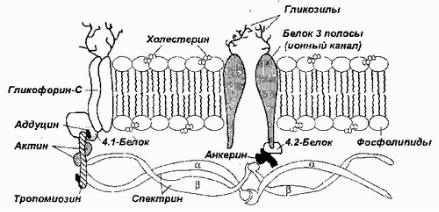
! |
261 |
Рис. 28Бел.IIIполосыантиген(к стареющихклеток)вмемранеэритроцитовпо(Х.Ф.Бунну)
Выясни,чторазличныеклеточныеосьповреждения эритроцитовотмутаций( — при микросфероцитозе,до
гиповитаминоза — при мегалобластическиханемиях )ускоряют экспрессиюмаркерастаренияукорачжизньэр .ваюттроцитов
Болеетого,устранениеснабженныхэтиммарккл,кактрокм |
аутофагоцитоза, |
ароль |
оказало,происходприучасть ити |
||
опсонинов,черезкоторыефагоцитыприкре |
пляютсякобреченным |
|
нагибельклеткам,выполняютфизиолауткгическиеантитела |
|
|
маркерустарения. |
|
|
Такимобр, илизомркерантигенстареющихклетококазался |
|
|
частьюфундаментальногомехз программированногонизма |
ентов,которые |
|
устранеизоргатехклеточныхниэлемязма |
||
исчерпаливследствповрежденийизнашиванияили свой |
|
|
генетичересур. ский |
|
|
Представленияовнутриклеточномгемп лизесредством |
|
|
фаг,какомеханизмецитозагибеликлеткровисуществовали |
|
клеток, |
ра,нонебылясенмолекулярныймеханизмотбора |
|
|
подлежустранению. щих |
|
|
Ещев году1884,всечерезгодпоткрытиясле И. И. Мечниковымфагоцитоза,ученикпервооткрывателя
А. О. Ковалевскийнаблюдалисчезнпровизорныхвениерганову личинокмухипручастиифагоцитовпророческипредположил, чтофагоцинетольконес защитныйлькомеханизм,сколько
! |
262 |
способ устранения собственных клеток, отработавших свою онтогенетическую программу.
Однако в дальнейшем внимание медиков сосредоточилось на защитной роли фагоцитоза и поколениям студентов и врачей казалась еретической сама мысль о том, что классический механизм защиты от чужого может быть также и способом повреждения своего.
Как это ни странно, Джордж Бернард Шоу, не имевший медицинского образования, устами одного из героев пьесы «Дилемма врача» в 1921 году высказал суждение, зазвучавшее после работ Маргарет Кей вполне современно: «Не происходит ли избыточная стимуляция фагоцитов? Не пожирают ли они, наряду с бациллами, и красные кровяные тельца, прикрепляясь к ним и разрушая их?»
После открытия антигена стареющих клеток можно говорить о конкретизации понятия «морфогенетическая роль фагоцитоза»,
введенного В. В. Максимовым. Оказывается, одним из неспецифических последствий [150] повреждения клетки или ее онтогенетического старения может быть индукция специального маркера, провоцирующего запрограммированную насильственную гибель клетки путем аутофагоцитоза, а сам этот механизм дополняет запрограммированное самоубийство клеток или апоптоз.
Предполагается, что в безъядерных постклеточных структурах типа эритроцитов должны существовать ультрадолгоживущие РНК маркера старения, экспрессируемые только после того, как в них произойдут с течением времени или вследствие клеточного повреждения какие-то структурные изменения. Таким изменением может быть, например, утрата полиаденилового «хвоста» молекулы РНК, которая происходит постепенно и может играть роль
клеточных «часов».
Повреждение клетки может ход этих часов ускорить.
По мнению Кей, антиген стареющих клеток может быть связан как с анионным транспортом, так и косвенно — с другим компонентом эритроцитарных мембран — гликофорином С-белком,
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

! |
263 |
обеспечитранспортглюкозывкрасныеающимкровяныеклетки (рис. 28)Известна. рольбелктретьполосывмеймбранно м заякориванииэлементовцитоскел.Экспрессиябелкатретьейта полморассмжетсы,какпопыткатриватьсяулучшизахва ь глюкозы,которыйвстареющихклеткахнарушаетсяили откоррекмеханионноготранспортароватьзмы.Одн,эт ко
формаадаптацииприводит кстимеханизмауляции,устраняющего стареющиеповрежденныеклетки.
Концепциямаркерастареющихклетможетпок,казатьк реализуетсязапрограммионтогенетическоеустранениеова ное клетмногоклетв организме,отвиммуннойсистемедячном
центральную роль «синхронизатора» биологическихчасов разлоргановитканейч. ых
Посутидела,кромезапрограммированногосамоубийства поврежденилионтогеизноклеткиетическишенной,или апоптоза,враспоряжениимногоклеточногоорганимеетсязма способзапрогр аммированнойнасильственнойгибетакихеток
— черезэкспрессиюособогомаркера,аутоиммунныйответ аутофагоц.Неисключено,чтоэтявлениявзаимосвязанытоз, посколькуизвестно,например,ч ельца,появляющиеся
результатеапоп,ус позараняются утемаутофагоцитоза.Влюбом случае,антигенстареющейклеткипредставляетсобойнекий спусковкрюч,иницииоопределенноейкующийазрушительное дляклетки,нонеобходимоедляоргзанизмапрограммированное событие. [151]
Весьмазаманчиваидеяповлиятьна |
экспрессиюбелкатретьей |
|
полосывопухолевыхклет,дабыкахсроихжизнититьк, |
|
|
разрабавнаствремяываемаяосновоположникамиящее |
|
|
представлобантигстареющихслетен.Кейокавторы |
|
|
предпринялисэтойцельюдажепо олучитьытку |
|
|
антиидиотипическиеинформациокопииантстареющихгенные |
|
|
клетокилисинтпептидытич,аналогскгомиенч амые |
|
|
(М. Кей,Дж. |
Маршалонис, 1991). |
|
Итак,последствияповрежклеточныхяд роднозначныния, таккакв лючаемыеприэтомгенетическиепрограммысаног нны
! |
264 |
и патогенны — в одно и то же время. Конкретный результат определяется влиянием множества факторов, по сути, пермиссивных по отношению к данному сигналу или воздействию.
ПОСЛЕДСТВИЯ ПОВРЕЖДЕНИЯ ОРГАНОИДОВ
Рассмотрим вначале последствия повреждения поверхностного аппарата клеток, включая плазматическую мембрану, подмембранную систему клетки и надмембранные структуры.
Повреждение плазмолеммы
Повреждение плазматической мембраны клеток, независимо от его причины (механический или осмотический разрыв, электрический пробой, излучения, ультразвук, поле СВЧ) вызывает ряд типовых патохимических изменений, которым соответствуют характерные патохимические и морфологические картины. Ю. А. Владимиров выделяет 4 основных типа повреждения плазматических мембран:
•Перекисное окисление их компонентов;
•Гидролиз фосфолипазами;
•Механо-осмотическое растяжение;
•Адсорбция на мембране избытка полиэлектролитов (1994).
Практически любые причины, вызывающие формирование активных свободных радикалов-окислителей (радиация, озон и высокие концентрации кислорода, яды-окислители, воспаление) вызывают в мембране перекрестное связывание сульфгидрильных групп поверхностных белков, сшивку липидных молекул и перекисное окисление жирных кислот. Вследствие этого могут срезаться или менять свое местоположение в мембране концевые участки трансмембранных гликопротеидов, в том числе, клеточных рецепторов, а также освобождаются токсичные для клеток продукты распада, например, малоновый диальдегид. Перекисные
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/

! |
265 |
измогутененияаутокаталитически,каск аднонарастая, распрострвдольмембраныивнутриклеточныеняться мембстр.Некоторспособныеанныеуктурыагенты, связывать сульфгидрильныегруппы,вчастнос,ионырту,свинца,тисеребра идругихтяжме,талловхыизводятстрояионныеканалы, повышаяпроницаемостьмембрсразудляк ,тионовдля анионов.
Проникновизбыткакальциякл,вызванноеткуниегипоксией илидействиемтяж ,талловактивируетлыхмембранные фосфолипазысм.( с. 154),развертывающиедальнейшгидрол й липби.днслогоя
Наначальной,обратимстадииклеточнп йвреждения,этого выражаеструкобразованиитцитоплазматическихурнося выпячиванийнаповерхностиклетки.Уклеток,обладающих микров,онисгрслаживатьсяутисчезатьнками.В
эпителиальныхклеткахнеспецифич еск,фимлогенетически древответомнраздражимиповрмое,пониеждениеет некоторымданным,служитьобразовфилоподий.Нарушаютсяние межклеточныеконтакты.
Вдальнейшем,прогрессирующееповреждениеклеточных мембранпривкфордитмиелиновыхрованию фигур,в результатедиссоциациибелковыхлипидныхкомпонентов мем,обнгидрофобныхныаженияфосфатидовзахватаводы, расслаивающеймембрану.
Принеобратимомповрежденииплазмонаблюдаютсяемме разрывы.Последствием [152] глубоповреждениякоголето чных мембранявляетсявыходсоставныхчастклеткимежклеточнуюй жидк.Этфеноменвызываетстьрядважныхпоследствийна тканеуровнеиучитываетсяомдиагностическоймедициной.
Многиевеществанормеприсутствуюттольковнутриклеточно. Такнапример, клеткинеобмениваютсяАТФпроизводятэто важнейшеемакроэргическоефо оединениефатноепо
эгоистпринципуческому — кажтолькодлсебяая (Дж. Л. Гордон, За1986)кажущиэгоиз.стоитважныймсяом принципмежклеточногосотрудничества:многоклеточном
! |
266 |
организме оно не основывается на иждивенчестве или паразитизме. Если клетки сотрудничают, они обмениваются энергией не в виде заимствования АТФ, а в форме совместной полезной работы. Скажем, кардиомиоциты предсердий не синтезируют АТФ на экспорт — в желудочки сердца, однако сокращение предсердий перерастягивает желудочки и способствует синтезу желудочковыми кардиомиоцитами дополнительных макроэргических эквивалентов. ДНК каждой клетки принадлежит только ей и не используется в качестве программного аппарата соседними клетками.
Вследствие этого, появление внеклеточной АТФ и ДНК — безусловный признак беды для защитных систем организма, так как это принципиальный маркер разрушения клеток! Не случайно внеклеточные ДНК и АТФ являются мощными хемоаттрактантами и привлекают в очаги клеточного повреждения фагоцитирующие лейкоциты, призванные «расчистить развалины».
Синдром цитолиза, сопровождающий глубокое повреждение плазматических мембран клеток, регистрируется по появлению в межклеточной жидкости или в крови избытка ферментов, субстратов и ионов, в норме преобладающих или присутствующих исключительно во внутриклеточном секторе. Так, при гепатолизе появляются сорбитолдегидрогеназа, глютамико-пировиноградная и глютамико-щавелевая трансаминазы, в норме присутствующие внутри гепатоцитов. Внутрисосудистый гемолиз сопровождается гемоглобинемией и билирубинемией свободным билирубином. Любой массированный цитолиз приводит к гиперкалиемии.
Патофизиологические нарушения функций плазматической мембраны при ее повреждении связаны, прежде всего, с утратой трансмембранных градиентов, активно поддерживаемых живой клеткой. Градиенты могут утрачиваться вследствие усиления протечек вызванного действием сульфгидрильных ядов или механическими разрывами. Но наиболее типичной причиной служит нарастающий по ходу развития клеточной гипоксии дефицит энергии. Основным потребителем энергии в клетке является натрий- калиевая АТФ-аза, утилизующая в покое до 30% энергии основного обмена. При энергодефиците функция этот» фермента нарушается в первую очередь, что ведет к деполяризации мембраны. Сходные
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
! |
|
|
|
267 |
|
|
градиентсоздающиесистемыподдерживцитоплазмеют |
|
|
|
|
||
относительноневысокуюконцентрациюкальция,способного |
|
|
|
|
||
существенноповлиянаработуцитоиьмитохондрийскелета, |
|
ескийкаскады. |
|
|
||
такженаарахидпротеолитичновый |
|
|
|
|||
Приповрежденииклеткимембранныйкал |
|
|
|
-натриевый |
||
градиентвсегдасглаживаетсянаблюдаетсяизбыток |
|
|
|
|
||
внутриклеточногонатрия,осмотическаяактивностькоторого |
|
|
|
|
||
удерживклеткеизбытокводы,аетвжевремявнеклетки |
|
якалия.Фокальноеповреждениеткани |
|
|
||
увеличиваетсяконцентраци |
|
|
|
|||
массивныйнекрозклетокорганизме |
|
-заэтсопровождаютсяго |
||||
местнизбкалияывочагеткмв спалениям/илисистемной |
|
|
|
|
||
гиперкали.Втожевре,умерстямиейгипоксическогопеньнная |
|
мутным |
||||
поврежденияклетвсегдапровк |
|
|
ождаетсяих " |
|||
набуханием",априбоглееубокойгипв ксиизможенбольший |
|
«баллонной |
||||
избытоквнутржидк»клеточнойпрявляющийсясти |
можетповлечьопасныедляее |
|
||||
дистрофией» |
. Набуханклеткие |
|
тпроцесс |
|||
соседейпоследствия.Ю. |
А. |
Владимировуказывает,чтоэто |
|
|||
можетнарушамикроцивтькани,переносящейкуляцию |
голодание,замыпорочныйкруг,ая |
|
|
|||
кислородное |
[153] |
|
Этиология |
|||
усилгипоксиювающийсм.(такжевыше,раздел« |
|
|
|
|||
патогенез»)Этоособенно. значимовт |
|
рансплантологии,имеющей |
|
|||
делоснарушениямикровоснабжетран плаледснтиявиеата |
|
|
|
|
||
гипоксическогонабуханегоклетокприхранении.Нея лько |
|
|
|
|
||
натриевый,нокальциевыйградиентсглажпривается |
|
|
|
|
||
поврежденииплазмолеммы. |
|
|
|
|
||
Какужеотмечалосьвыше, |
|
избытокв |
нутриклеточного |
|||
кальция |
активируетмембран |
|
-фосфолипазы А,приводяк |
|||
освобождениюизфосфолипидовсамойповрежденмембранойы |
|
|
|
|
||
арахки,дкслотызатемнкаскадновойраяпревтакращается |
|
|
|
|||
называемыеэйкозаноиды,являющиесядиаторамивоспаления. |
|
|
|
|
||
Приучас |
тииэтихмедиатоальтеклеткиперерастаетовац я |
|
|
|||
координирвовлекответ, с седтканющийныйиеевые |
|
|
|
|
||
структуры.Самажеповрмембражденвыпускаетнаружуя |
|
|
|
|
||
избытоквнутриклеточногокалия,станестабильнойовтся |
ымпотенциалом.Силы |
|
||||
электричепробиваетсясоб твеннки |
|
|
||||
поверхностнатяжепрепятсэлекнияогопробоютвуютическому |
|
|
|
|||
мембраныистягиваютдефектылипб .Однакогосл,воя |
|
|
|
|
||
! |
268 |
условиях повреждения клетки как целого действуют такие факторы, как активные кислородные радикалы и эндогенные детергенты, например мыла (см. ниже), способные разрыхлять бислой и облегчать его пробой.
Интересно, что мембранный холестерин является мощным стабилизатором липидного бислоя. Эта молекула, безосновательно превращенная пропагандистами здоровых диет в символ зла и патологии, в действительности является необходимым для клетки компонентом и сильно увеличивает резистентность плазматических мембран к электропробою и дезинтеграции (Ю. А. Владимиров, 1994). Но, увеличивая устойчивость клетки к одним повреждениям, высокий уровень мембранного холестерина способен заставить некоторые клетки вступать в атерогенез и/или претерпевать повреждения другого рода. Вязкая мембрана богатых холестерином гладкомышечных клеток затрудняет работу кальциевого насоса и ведет к стимуляции деления и пенистой трансформации этих клеток из-за нарастания концентрации свободного цитоплазматического кальция, что способствует формированию атером.
Жесткая мембрана насыщенных холестерином эритроцитов более прочна при механическом повреждении, но это делает красные кровяные клетки менее конфигурабильными при транспорте через капилляры и способствует ишемическим нарушениям микроциркуляции (Ю. М. Лопухин, 1986). В. М. Дильман (1981) считал низкий уровень холестерина одновременно фактором антириска для атеросклероза и фактором риска для канцерогенеза. Амбивалентность мембранного холестерина, как защитного для клеток и патогенного на тканевом уровне фактора — очень характерный пример «погрешимости» защитных механизмов.
Итак, при повреждении создается цепь последствий первичной альтерации плазмолеммы, которая включает:
1.Недостаточность натрий-калиевого насоса и функций ионных каналов;
2.Утрату физиологических трансмембранных ионных градиентов;
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
! |
269 |
3.Избывходнойтонатриякчныйводыклетку;
4.Набухание клетки;
5.Избывходнойтокальциячныйклетку;
6.Активациюмембранныхфосфолипаз;
7.Освобожденщенияипреварахк ;доновойслоты
8.Нарушениелокальнмикроциркуляции; й
9.Появлениевокругклеткилипимедвоспаленияныхиаторов.
Окислениеа рахидонкислнаступаетовответвойылюбое повреждеклеточноймембраныилрецепциюсамыхразных регуляторов — гормон,нейриоивмедиаторовмуноглобулинов.
Субстратиферменты,необходдляэтого,примыесущи |
тклеточнымструктурам |
|
практическивсемклеткаммногимпос |
||
организмакрайне(слабпродукцией |
эйкозаноидов отличаются |
|
эритроциты). |
[154] |
|
Всвязитакойунивепрсальностьюодукциюэйкозаноидов |
|
|
считаютодизнимаиболеедревнихтиповыхзащитныхстереотипов |
|
|
клеток. |
|
|
Универсальнаязначимостьэтог |
омеханизразвитиядлясамой |
|
различнпатологииможетбытьпрой ллюстрированахобытемя |
|
|
фактом,чтосамоепопулярнинаиболширокоеспектру |
— аспирин — действуетименно |
|
своегоприменениялекарство |
||
качествеблокасинекоторыхтезораэйкозанои |
дов. |
|
Эйкозаноидыненакапв л,всегдаеткахиваютсясинтезируются зановоипредставляют собоймедиаторнуюсистемуострой
клеточнойреакциинаповреждение .Онибыстронактивируются всистемномкровпоэтомудействтокетольконаклеу,ютку котораяих бразует,иеесоседей.Поскихэффектограниченльку очагом,гдеониформируются,эйкозанпредставляютбойиды аутокоидыилипаракринныерегуляторы.Рассмотримосновные
! |
270 |
этапы арахидонового |
каскада (С. Бергстрём, Б. Самуэльссон, |
Дж. Вейн, 1982). |
|
При повреждении мембран происходит переход просеринэстеразы в активную серинэстеразу. Последняя мобилизует при участии кальция и метилтрансферазы фосфатидилсерин, который превращается в фосфатидилхолин. Фосфолипаза А2, стимулируемая особым активирующим белком (PLAP), освобождает из фосфатидилхолина арахидоновую кислоту. Последняя может также образоваться из диацилглицерина, формируемого из мембранных фосфолипидов ферментом фосфолипазой С. Фосфолипазы ингибируются глюкокортикоидными гормонами, с чем, отчасти, связан противовоспалительный эффект этих регуляторов.
Свободная арахидоновая кислота окисляется в двух альтернативных путях образования липидных медиаторов. Один из этих путей контролируется ферментом циклооксигеназой и приводит к образованию простаноидов, к которым принадлежат
простагландины и тромбоксаны.
Циклооксигеназа блокируется салицилатами, например, аспирином, а также индометацином, ибупрофеном и другими нестероидными противовоспалительными агентами.
Другой путь осуществляется при участии фермента липооксигеназы и активирующего этот энзим мембранного белка
FLAP. Он ведет к эйкозаполиеновым кислотам и лейкотриенам.
Получены избирательные ингибиторы липооксигеназного пути арахидонового каскада, например зилевтон (рис. 29).
Циклооксигеназный путь начинается с появления циклической эндоперекиси арахидоната — простагландина G2 (2 обозначает количество двойных связей в боковой цепи).
Затем формируется простагландин Н2 (PgH2), а из него — наиболее биологически активные PgD2, PgE2, PgF2α, а в эндотелии и гладкомышечных клетках сосудистой и бронхиальной стенки — также и циклический PgI2, известный как простациклин.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
