
6 курс / Неонатология / Неонатология_Н_П_Шабалов_7_е_издание_Том_2_2020
.pdfТаблица 20.11. Дифференциальная диагностика НЭК
Системные болезни |
Гастроинтестинальные болезни |
|
Родовая черепно-спинальная |
Заворот кишки. |
|
травма, цере-бровисцеральный |
Мальротация. |
|
синдром. Перинатальные |
||
|
||
инфекции. Сепсис. |
Некротический колит. |
|
Геморрагическая болезнь |
Колит при болезни Гиршпрунга. |
|
новорожденных. Синдром |
Инвагинация. |
|
заглоченной крови. |
||
|
||
Постасфиксический некроз кишки |
Тромбоэмболия пупочных артерий. |
|
|
Спонтанная перфорация кишки. Стресс-язва в |
|
|
первые 5 дней жизни. Мекониальный илеус. |
|
|
Аллергия к белку коровьего молока |
Лечение. Интенсивная терапия дает положительные результаты у 6070% больных НЭК, в остальных случаях требуется хирургическое вмешательство.
Консервативное лечение предусматривает:
•отмену энтерального питания;
•декомпрессию желудка и кишечника;
•полное и полноценное парентеральное питание;
•антибактериальную терапию;
•медикаментозное воздействие на парез кишечника;
•ферментотерапию и пробиотики;
•иммунотерапию.
При установленном диагнозе НЭК кормление ребенка полностью прекращают, переводя его на полное парентеральное питание на 5-7 дней, затем постепенно начинают вводить сцеженное грудное молоко, при его отсутствии - безлактозные формулы (смеси).
С целью кишечной декомпрессии применяют отсасывание через постоянный назогастральный зонд при отрицательном давлении не более минус 6080 мм рт.ст.
Адекватное парентеральное питание - один из ключевых методов лечения ребенка с НЭК. Ребенок, не получающий адекватной питательной поддержки, голодающий ребенок, гомеостатические механизмы которого повреждены. Принципы парентерального питания изложены в главах 6 и 8.
Антибактериальные препараты и их режимы при НЭК строго не детерминированы, но тактика врача должна быть гибкой, и начало НЭК на фоне анти-биотикотерапии требует смены антибиотиков. Наиболее эффективно назначение ванкомицина по 10 мг/кг внутривенно 3-4 раза в день и метронидазола 15 мг/кг в сутки внутривенно в 2 введения. Применяют также цефалоспорины
III-IV поколений в сочетании с аминогликозидами, карбапенемы. Смену антибиотиков проводят в соответствии с результатами бактериологического исследования крови, перитонеальной жидкости и стула. Длительность курса антибиотиков при I стадии НЭК небольшая - 3-5 дней, при IIА стадии - 7-10 дней, при IIБ-III стадии - 14 дней.
Иммунотерапию проводят иммуноглобулинами для внутривенного введения, оптимально содержащими иммуноглобулины М (Пентаглобин♠). Последний вводят в течение трех дней подряд.
При тяжелом НЭК проводится осторожная коррекция гиповолемии и нарушений свертывания крови переливанием свежезамороженной плазмы 1015 мл/кг, тромбоцитной массы, инфузия глюкозо-солевых растворов, калия. В целях улучшения оксигенации и коррекции ацидоза показана ИВЛ, при септическом шоке и циркуляторной недостаточности назначают инотропные средства (допамин, добутамин). Назначение инотропов, вазоконстрикторов и вазодилататоров должно тщательно контролироваться и подбираться по показателям центрального и периферического кровотока (оптимально по результатам допплеровского исследования), диуреза, КОС и ЦВД и корректироваться инфузионной терапией. Полное парентеральное питание предусматривает и ежедневное введение витаминно-минеральных комплексов (см. главу 6). Важно помнить, что слишком быстрое увеличение нагрузки липидами при парентеральном питании повышает риск НЭК.
Абсолютным показанием к хирургическому лечению является пневмопери-тонеум. Однако своевременная декомпрессия брюшной полости позволяет снизить интраабдоминальное давление и восстановить артериальный кровоток, оксигенацию и сердечный возврат. Поэтому при симптоматике IIIА стадии показан лапароцентез и дренирование брюшной полости. Если в течение 24-48 ч не наступает улучшения состояния, проводится лапаротомия и удаление некротизированных тканей и воспалительного экссудата. Эта тактика более раннего оперативного лечения позволяет предотвратить переход в IIIБ стадию и снизить летальность.
Одним из самых тяжелых осложнений хирургического лечения НЭК является синдром короткой кишки, который более подробно описан в следующем разделе.
Прогноз. Летальность при НЭК остается высокой и в разных отделениях реанимации и интенсивной терапии колеблется от 9 до 28%, особенно среди детей с массой менее 1500 г. Примерно треть детей требуют хирургического вмешательства, летальность в этой группе составляет 40-50%. Среди выживших детей возможны отдаленные осложнения НЭК: стриктуры толстой кишки, синдром короткой кишки, а также неврологические изменения, связанные с последствиями сепсиса и шока. Дети с НЭК нуждаются в длительном (в течение 1-3 лет) реабилитационном лечении под наблюдением хирурга, гастроэнтеролога, невропатолога, окулиста, поскольку рациональная восстановительная терапия может существенно улучшить качество жизни детей, даже при наличии отдаленных последствий.
Профилактика. На современном этапе развития неонатологии НЭК не может быть полностью устранен, но некоторые профилактические меры с учетом механизмов его развития должны предприниматься для его предупреждения. В нескольких рандомизированных исследованиях показана эффективность пробиотиков (Bifidobacteriae bifidum, Lactobacillus GG) и назначаемого внутрь IgA, а также протективная роль грудного молока. Раннее начало вскармливания грудным молоком достоверно снижает частоту НЭК. Однако расширение объема питания должно быть постепенным, не превышать 20 мл/кг/сут и проводиться с обязательной оценкой индивидуальной толерантности к пище. Считается, что среди положительных эффектов антенатального применения стероидов при угрозе преждевременных родов есть и уменьшение вероятности развития НЭК у недоношенного ребенка (вероятно, вследствие снижения активности синдрома «фетального системного воспалительного ответа»).
20.2.15. Синдром короткой кишки
Синдром короткой кишки (СКК) - это кишечная недостаточность, которая является результатом обширной резекции тонкой кишки. В определении СКК подразумеваются тяжелая мальабсорбция нутриентов и водно-электролитные нарушения, которые ставят пациента в зависимость от парентерального питания (ПП). Большинство случаев СКК
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
возникает в периоде новорожденности и является результатом хирургических операций при врожденных аномалиях или тяжелом некротическом энтероколите.
К счастью, тонкая кишка имеет большие функциональные резервы и 40-50% ее может быть резецировано без существенных метаболических и трофических последствий. При удалении более 75% нутриционный статус и дальнейшее развитие ребенка могут поддерживаться благодаря ПП, при остаточной длине ТК более 80 см ПП обычно не требуется, даже при остаточной длине около 40 см 94% детей выживают без необходимости постоянного ПП.
Этиология. У новорожденных причины СКК включают некротический энтероколит (НЭК), атрезию, протяженный интестинальный аганглиоз и маль-ротацию с кишечной непроходимостью. Гастрошизис обычно сопровождается СКК вследствие тех же механизмов: заворота, атрезии или НЭК. СКК, развившийся при НЭК, протекает обычно более тяжело, чем СКК другой этиологии, и требует более длительной госпитализации. Вероятно, это связано с большей степенью кишечной недостаточности вследствие поражения слизистой оболочки остаточной кишки.
Патогенез. В результате обширной резекции тонкой кишки происходят следующие нарушения.
Водно-электролитные потери
На ранних стадиях после резекции могут быть значительные водно-электролитные потери, при этом наблюдается снижение электрической резистентности и повышение проницаемости оставшегося отрезка кишки. Резекция подвздошной кишки приводит к попаданию большого количества желчных кислот и липидов в толстую кишку. Здесь они метаболизируются микрофлорой
до деконъюгированных желчных кислот и жирных кислот, которые усиливают секрецию в ТК.
Тонкая кишка имеет особенности функционирования на всем своем протяжении. Существуют важные различия между тощей и подвздошной кишками, в дистальных отделах подвздошной кишки существуют специфические сайты всасывания для некоторых витаминов, желчных кислот, поэтому иле-альная резекция приводит к их мальабсорбции. Различия между тощей и подвздошной кишками касаются также проницаемости межэпителиальных промежутков между энтероцитами, определяющих способность к абсорбции воды и электролитов против осмотического градиента. Тощая кишка имеет большую проницаемость, чем подвздошная, а та, в свою очередь, более проницаема, чем толстая. Межэпителиальные соединения между энтероцитами в подвздошной кишке относительно непроницаемы для воды и электролитов, что ограничивает обратную диффузию натрия в межклеточное пространство и полость кишки. Поэтому резекция подвздошной кишки приводит к большей потере воды и электролитов.
Толстая кишка - важнейшее место всасывания натрия и воды, она имеет большие резервные возможности, поэтому больные с сохранной толстой кишкой меньше страдают от недостатка воды и электролитов.
Нарушения транспорта и кишечный дисбиоз
Массивная резекция кишечника сопровождается снижением гастродуоде-нальной моторики, замедлением эвакуации и продвижения по кишке. Хотя это обеспечивает более длительный контакт всасываемых пищевых веществ с эпителием кишки, медленный транзит может быть одним из факторов усиленного микробного роста, который развивается у 2/3 детей с СКК. Это препятствует своевременной отмене ПП и переходу на
энтеральное питание (ЭП) и способствует развитию воспалительных изменений в слизистой оболочке тонкой кишки (СОТК).
Нарушения пищеварения и всасывания
После полной резекции тощей кишки может наблюдаться лишь небольшая стеаторея, в то же время потеря всего 10 см подвздошной кишки вызывает выраженную стеаторею из-за мальабсорбции желчных кислот. Несмотря на компенсаторное повышение синтеза желчных кислот в печени, их пул значительно снижается, что нарушает мицеллообразование и приводит к нарушению всасывания жиров и жирорастворимых витаминов.
Другие факторы, усиливающие стеаторею, включают: инактивацию панкреатических ферментов вследствие повышения желудочной секреции, кишечный дисбиоз и панкреатическую недостаточность, вторично развивающуюся при недостаточности питания.
В зависимости от протяженности резекции развивается дисахаридазная, в частности лактазная, недостаточность, которая пропорциональна длине резецированной кишки. Нарушения пищеварения значительно нарастают при наличии воспаления в кишечнике, в частности при НЭК.
Желудочная гиперсекреция
Гиперсекреция соляной кислоты в желудке обычно транзиторна и пропорциональна резецированной длине кишки. При этом возможны формирование гастродуоденальных язв и эрозий, кровотечения из них, а также мальабсорбции вследствие инактивации панкреатических ферментов и нарушения формирования мицелл. Закисление двенадцатиперстной кишки может нарушать всасывание глюкозы. Гиперсекреция является результатом гипергастринемии, которая развивается вследствие недостаточности гастринингибирующего пептида, синтезируемого тонкой кишкой.
D-лактоацидоз
Рецидивирующий D-лактоацидоз является нечастым осложнением СКК. Невсосавшиеся вследствие резекции тонкой кишки углеводы ферментируются лактобациллами толстой кишки до D- и L-изомеров молочной кислоты. L-лак-таты далее метаболизируются с помощью L-лактатдегидрогеназы, но подобного пути не существует для D-изомеров. В этом случае у пациентов развиваются тяжелый ацидоз и значительные нарушения сознания.
Преходящая псевдообструкция
Обширная резекция тонкой кишки у новорожденных может привести к расширению и нарушению моторики кишки с развитием тяжелой псевдообструкции. Остаточная кишка часто контаминирована микрофлорой. К счастью, псевдообструкция обычно устраняется параллельно с адаптацией слизистой оболочки.
«Адаптация» - термин, который применяется для обозначения процесса прогрессивного улучшения при кишечной недостаточности вследствие потери длины кишки. Он состоит в повышении толерантности к энтеральному питанию, что позволяет постепенно уменьшать объем ПИП. В процессе адаптации кишка увеличивается в диаметре, удлиняется и истончается. Ворсинки становятся длиннее, крипты глубже, с большим количеством клеток в пролифера-тивной зоне. Эти изменения можно наблюдать уже через сутки после резекции. Количество энтероцитов возрастает. Ранее предполагалось, что энтероциты не становятся более активными и что всасывание на единицу поверхности слизистой
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
оболочки остается неизменным, но позднее было доказано, что активность мембранных ферментов и РНК-переносчика Na/глюкозы также возрастает.
Существует ряд факторов, способных влиять на адаптацию. Полостные ну-триенты ускоряют процесс адаптации, в то время как при длительном полном ПИП развивается атрофия СОТК. Непищевые факторы также могут играть существенную роль - это энтеральные гормоны, в частности, энтероглюкагон, эпидермальный фактор роста (EGF), инсулиноподобный фактор роста (IGF-1), простагландины, полиамины.
Лечение. Успешное лечение детей с СКК требует участия разных специалистов. Длительное ведение лучше осуществлять нутриционной бригадой, состоящей из гастроэнтеролога, хирурга, фармаколога, диетолога, микробиолога и нутриционных сестер.
Основные задачи ведения пациентов с СКК и пути их решения
Поддержание питания:
•парентеральное питание;
•коррекция специфических дефицитов. Усиление интестинальной адаптации:
•частичное энтеральное питание;
•олигосахариды или короткоцепочечные жирные кислоты;
•диетические модули. Контроль над диареей:
•адсорбенты.
Лечение псевдообструкции:
•прокинетики;
•антибиотики внутрь.
Периоды лечения СКК
Период 1: ранний послеоперационный период. Он занимает 1-2 нед, когда выражен парез кишечника и могут быть большие потери через энтеростому или назогастральный зонд. Парентерально вводятся жидкость, электролиты, раствор Глюкозы♠, а со 2-3-го дня требуется полное ПП. Парентеральное питание является необходимым этапом ведения больных с СКК, так как позволяет сохранить им жизнь. У большинства пациентов это лишь временной мостик, который дает возможность адаптироваться кишке, но у других ПП вынуждено продолжаться месяцы и годы. По данным А.И. Чубаровой (2006), средний срок перехода на ЭП у детей, оперированных по поводу невоспалительных заболеваний кишечника, составил 42 дня, по поводу НЭК без перитонита - 53 дня, НЭК с перитонитом - более 100 дней.
В этот период необходимо скрупулезное внимание к водно-электролитному балансу с возмещением потерь дополнительно к расчетному количеству.
Период 2: введение энтерального питания при поддержании парентерального. Когда проходят явления послеоперационного пареза кишечника, следует начинать энтеральное питание (ЭП) через назогастральный зонд. ЭП даже в незначительном количестве имеет несколько важных преимуществ. Прежде всего, оно обеспечивает контакт нутриентов со слизистой оболочкой кишки, благодаря чему возникает адаптивный ответ. Раннее ЭП редуцирует холестаз, вызванный ПП, и способствует уменьшению количества осложнений.
Выбор энтерального питания. Когда у матери есть молоко, то предпочтительно кормление ребенка ее сцеженным молоком через зонд, поскольку грудное молоко
содержит иммунные, гормональные и ростовые факторы, в частности, эпидермальный фактор роста, полиамины.
При отсутствии грудного молока выбор смеси при СКК имеет эмпирический характер. Однако, учитывая обычно развивающуюся лактазную недостаточность, предпочтительно использовать безлактозные формулы (смеси). Выбор между цельным белком, белковыми гидролизатами и аминокислотными формулами (смесями) базируется на немногочисленных объективных доказательствах, но следует учитывать, что после массивной резекции укорачивается
время контакта нутриентов с ферментами, поэтому использование гидролизо-ванного белка может обеспечивать более быстрое всасывание. По данным А.И. Чубаровой (2006), белковые гидролизаты лучше переносятся детьми с СКК, чем формулы (смеси) с цельным белком, их введение сопровождается менее частыми диспепсическими симптомами. Формулы (смеси) с ди- и трипеп-тидами не уступают по переносимости аминокислотным смесям, они усваиваются так же быстро, как аминокислотные, но имеют более низкую осмолярность. На практике стартовой обычно является формула (смесь), содержащая белковый гидролизат, полимеры глюкозы и смесь длинно- и среднецепочечных триглицеридов (ДЦТ/СЦТ): «Альфаре», «Нутрилон-Пепти-Гастро». Сначала формулу (смесь) вводят в зонд микроструйно постоянно в половинном разведении со скоростью не более 1 мл/кг в час, затем скорость увеличивают в 2 раза, только после этого увеличивают концентрацию. Суточный объем формулы (смеси) постепенно увеличивают до порога толерантности, который определяют по началу диареи и большому желудочному аспирату. Общее энергопотребление (суммарно парентерально и энтерально), обеспечивающее адекватный рост и развитие ребенка, должно быть не менее 120 ккал/кг в сутки, суточное потребление белка - не менее 3 г/кг, жира - 6 г/кг, углеводов - 14-16 г/кг. Постоянная инфузия питательной смеси способствует лучшим прибавкам в весе и более полному усвоению нутриентов. Поэтому у больных с СКК, особенно в начале введения ЭП, строго соблюдают принцип постоянного введения. По мере адаптации пища может постоянно вводиться только ночью и бо-люсно днем. Это обеспечивает возможность питания через рот, что также важно, так как зондовое и парентеральное питание в течение нескольких месяцев может вызвать серьезные проблемы с возобновлением обычного питания в дальнейшем.
У большинства пациентов с СКК удается отменить ПП, но иногда лишь спустя месяцы и годы. У тех, кто остается зависимым от ПП, важно исключить другие возможные причины диареи: бактериальную контаминацию кишки, анатомические изменения (стриктуры, синдром слепой петли). Пациентам, которым невозможно отменить ПП, необходимо постараться организовать его в домашних условиях. Пролонгированное ПП осуществляют через центральный венозный катетер длительного пользования туннельного типа или имплантированную порт-систему, которые требуют специального ухода для профилактики осложнений: катетер-ассоциированных инфекций, тромбоза.
Продолжительность ПП у 60% детей не превышает 18 мес, у 80% - 36 мес. Недоношенные дети быстрее адаптируются, что позволяет закончить ПП в более ранние сроки. В случаях обширной резекции и сохранения зависимости от ПП в дальнейшем (после 1 г) возможно применение препарата глюкагонопо-добного пептида - тедуглутида (Ревестивρ) 0,05 мг/кг в сутки с целью роста и адаптации кишки.
Возможна хирургическая реконструкция остаточной кишки: продольное удлинение или последовательная поперечная энтеропластика (STEP). При осложненных формах СКК, прежде всего при развитии печеночной недостаточности, может быть показана трансплантация тонкой кишки и печени.
КОНТРОЛЬНЫЕ ВОПРОСЫ
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
1.Расскажите об особенностях пищеварения у новорожденных.
2.Назовите причины первичных (желудочно-кишечных) и вторичных
(симптоматических) форм рвот и срыгиваний у новорожденных и наметьте пути их дифференциальной диагностики.
3.Какова классификация функциональных расстройств ЖКТ у детей раннего возраста?
4.Что такое младенческие колики и какова тактика их лечения?
5.Перечислите причины расстройств дефекации и тактику лечения.
6.Какие возбудители наиболее часто являются причинами острых кишечных инфекций у новорожденных и детей раннего возраста и каков патогенез диареи при них?
7.При каких заболеваниях развивается хроническая диарея?
8.Расскажите о причинах и патогенезе некротического энтероколита.
9.Что такое «синдром короткой кишки» и какова тактика лечения при нем?
Глава 20. ЗАБОЛЕВАНИЯ ЖЕЛУДОЧНО-КИШЕЧНОГО ТРАКТА
20.1. СИНДРОМ РВОТ И СРЫГИВАНИЙ
Рвота - непроизвольное и стремительное выбрасывание содержимого пищеварительного тракта, в основном желудка, через рот (иногда и через нос), которое является результатом активного сокращения брюшных мышц и диафрагмы и, в меньшей степени, самого желудка. Рвота часто является защитной реакцией пищеварительной системы на попадание или образование в организме токсических или других вредных веществ. Рвота представляет собой сложный рефлекторный акт, который осуществляется с участием рвотного центра (рис. 20.1). Этот центр локализуется в продолговатом мозге в области ретикулярной формации. Вблизи него расположены дыхательный, со-судодвигательный, кашлевой и другие вегетативные центры. Все они тесно связаны не только в анатомическом, но и в функциональном отношении, вследствие этого рвота сопровождается реакциями, обусловленными раздражением этих центров (изменением дыхания, циркуляторными расстройствами, саливацией). Рядом с рвотным центром, снаружи от гематоэнцефалического барьера, находится пусковая хеморецептивная зона. Возбуждение рвотного центра происходит при повышении внутричерепного давления, под воздействием импульсов со стороны лабиринта, при раздражении рефлексогенных зон (глотка, коронарные сосуды, брюшина, мезентериальные сосуды, желчные протоки). Повышение давления в желудке, различных отделах тонкой и толстой кишки также может вызвать рвоту. Пусковая хеморецептивная зона реагирует непосредственно на воздействие химических веществ (лекарств, токсинов), импульсы оттуда передаются рвотному центру. Рвотные импульсы иногда сочетаются с болевыми. Очень сильная боль любого генеза может вызвать рвоту.
Афферентные импульсы достигают рвотного центра через блуждающий и симпатический нервы, эфферентные идут по V, IX, X парам черепно-мозговых нервов к нёбу, глотке, гортани, пищеводу, желудку, диафрагме, а через спинной мозг - к поперечно-полосатой мускулатуре грудной клетки и брюшной стенки. Нейромедиаторами рвотных реакций являются дофамин и энке-фалины.
Рвоте может предшествовать тошнота, сопровождающаяся вегетососуди-стыми реакциями. У новорожденных она может проявляться беспокойством,
отказом от еды, высовыванием кончика языка, выталкиванием соски, бледностью, тахикардией.
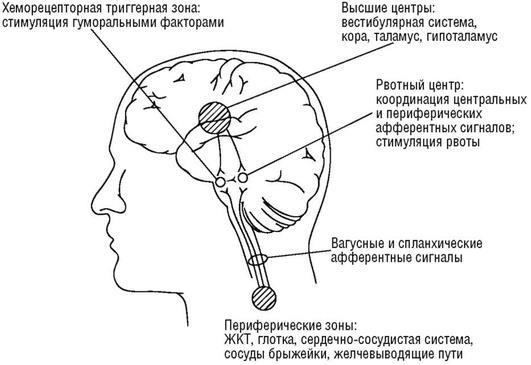
Рис. 20.1. Рвотный центр и его связи
Срыгивания отличаются от рвоты тем, что при этом съеденная пища выделяется без усилий, без выраженных сокращений мускулатуры брюшной стенки. Общее состояние ребенка не нарушается, выброс желудочного содержимого менее энергичен, ребенок как бы «сливает» молоко изо рта сразу или через небольшой промежуток после кормления. Срыгивания не сопровождаются вегетативными симптомами, не отражаются на поведении, аппетите, настроении ребенка.
Склонность к срыгиваниям - одна из характерных черт новорожденных и детей первых месяцев жизни. Это обусловлено определенными особенностями строения верхних отделов пищеварительного тракта в этом возрасте. Слабость кардиального сфинктера при хорошо развитом пилорическом; горизонтальное расположение желудка и форма его в виде «мешка»; высокое давление в брюшной полости, наконец, горизонтальное положение самого ребенка и большой объем питания, который он начинает получать уже к двухнедельному возрасту (1/5 от массы тела в сутки), предрасполагают к возникновению срыгиваний у вполне здоровых новорожденных.
В основе функциональных рвот и срыгиваний у детей первых месяцев жизни могут лежать разные механизмы:
•нарушение координации глотания и перистальтики пищевода;
•низкая саливация;
•недостаточная перистальтика желудка и кишечника;
•замедленная эвакуация из желудка;
•повышение постпрандиального растяжения желудка;
•пилороспазм.
В большинстве случаев эти механизмы являются результатом незрелости как нейровегетативной, так и интрамуральной и гормональной системы регуляции моторной
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
функции, по мере созревания этих систем функциональные рвоты и срыгивания самопроизвольно проходят в течение первого полугодия жизни.
Срыгивания и рвоты могут быть одним из важных симптомов многих заболеваний. По классификации Э. Керпель-Фрониуса (1975), рвоты можно разделить на две группы.
I. Первичные - когда патология, как причина, находится в желудочно-кишечном тракте.
II. Вторичные - когда причина находится вне пищеварительного тракта.
С точки зрения лечебных мероприятий, важно дальнейшее подразделение желудочнокишечных форм на функциональные и органические. Последние у новорожденных сводятся к порокам развития желудочно-кишечного тракта. Вторичные (симптоматические) рвоты можно условно разделить на три основные группы причин:
1)инфекционные заболевания;
2)церебральная патология;
3)нарушения обмена веществ.
20.2. ПЕРВИЧНЫЕ (ЖЕЛУДОЧНО-КИШЕЧНЫЕ) ФОРМЫ СРЫГИВАНИЙ И РВОТ
20.2.1. Функциональные формы срыгиваний и рвот
К функциональным следует относить заболевания желудочно-кишечного тракта, при которых нарушения моторной функции, лежащие в основе регур-гитации, не связаны с органическим препятствием для прохождения пищи. Срыгивания могут рассматриваться как одна из форм функциональных расстройств ЖКТ.
Срыгивания чаще одного раза в день наблюдаются у 67% здоровых детей до 4-месячного возраста. Многие родители считают срыгивания проявлением патологии; 24% обращаются по этому поводу к врачу в первые 6 мес жизни ребенка. Однако у большинства здоровых детей они самопроизвольно проходят в течение первого года жизни, сохраняясь лишь у 5% детей 10-12 мес. И поэтому в случаях нормального развития ребенка в целом, отсутствия каких-либо других патологических симптомов срыгивания могут расцениваться как функциональные.
С другой стороны, срыгивания могут быть проявлением и органических заболеваний, таких как гастроэзофагеальная рефлюксная болезнь (ГЭРБ), аномалии ЖКТ и другой патологии. Недоношенность, задержка развития, врожденные аномалии орофарингеальной зоны, грудной клетки, легких, ЦНС, сердца, другие пороки ЖКТ являются факторами риска органических причин рвот и срыгиваний. Нарушение весовых прибавок, появление таких симптомов тревоги, как
кровь в рвотных массах, скрытая кровь в стуле, анемия или отказ от пищи, затруднение глотания, должны склонять врача к оценке в пользу ГЭРБ. Более того, срыгивания, ассоциированные с ранним насыщением, отказом от пищи или выраженным беспокойством и криком, сопровождающиеся или не сопровождающиеся нарушениями развития, могут быть следствием болей или эмоционального возбуждения ребенка и вряд ли могут расцениваться как функциональные. Во всех этих случаях необходимо рентгенологическое и эндоскопическое исследование (см. ниже). Срыгивания, продолжающиеся в течение всего первого года жизни, требуют исключения врожденной аномалии, прежде всего мальротации или антропилорической обструкции. Аллергия к белку коровьего молока может быть причиной частых срыгиваний у детей с проявлениями атопического дерматита.
В соответствии с Римскими критериями IV (2016), критериями функционального характера срыгиваний у ребенка от 3 нед до 12 мес, здорового в других отношениях, являются следующие:
1)срыгивания 2 и более раз в день на протяжении 3 нед и более;
2)отсутствие отрыжки, рвоты с кровью, аспирации, апноэ, задержки развития, трудностей при проглатывании пищи и вскармливании, необычных поз.
В случаях соответствия этим критериям ребенка не следует подвергать излишним инвазивным исследованиям. Для правильной оценки клинической ситуации очень важным является анамнез и характер естественного течения синдрома регургитации, в частности спонтанное улучшение, поэтому первой задачей лечения является успокоение родителей. Эффективное успокоение включает следующее: (1) чуткое, внимательное отношение к высказанным и невысказанным опасениям и страхам родителей и точные ответы на их вопросы, такие как: Что случилось с моим ребенком? Опасно ли это? Пройдет ли это? Что мы можем сделать? и (2) обещание продолжить динамическое наблюдение и оценку. Симптомы можно уменьшить некоторыми изменениями в уходе. Следует рекомендовать более частое кормление, обязательно в положении сидя с ребенком на руках, когда его головка приподнята на 45-60°. После кормления следует подержать ребенка в вертикальном положении («солдатиком»). При недостаточной эффективности этих мер для детей на естественном вскармливании можно рекомендовать загустители грудного молока. Загуститель разводят в небольшом количестве сцеженного молока и дают в начале кормления грудью. При искусственном вскармливании назначают формулы (смеси) с загустителями. В качестве загустителей в формулах (молочных смесях) используют рисовый или картофельный крахмал («Энфамил АР», «НАН Комфорт АР», «Нутрилак АР») или камедь бобов средиземноморской акации («Фрисовом АР», «Нутрилон Комфорт АР»). Формулы (смеси) с крахмалом назначают в полном объеме, а смеси с камедью дают в отдельном рожке в конце кормления, после приема стандартной смеси, начиная с 30,0 мл, затем при необходимости дозу повышают и подбирают индивидуально. Метаанализ 14 рандомизированных
исследований эффективности формул (смесей) с загустителями при функциональных срыгиваниях подтвердил их умеренную эффективность независимо от типа загустителя.
Положение ребенка на левом боку и с возвышенным головным концом также уменьшает срыгивания. Медикаментозные препараты обычно не редуцируют симптомы, поэтому назначаются только в случае установленного диагноза ГЭРБ.
20.2.2. Гастроэзофагеальная рефлюксная болезнь
Этиология и патогенез. Нижний пищеводный сфинктер (НПС) представляет собой скорее физиологическое, чем анатомическое понятие и характеризуется зоной повышенного давления, распространяющейся от желудка на 1-2 см выше диафрагмы. В формировании запирательного механизма НПС участвует целый ряд компонентов:
1)мышечный;
2)диафрагмальный;
3)сосудистый;
4)клапан Губарева;
5)угол Гиса.
В отношении давления НПС у новорожденных в литературе имеются противоречивые данные: при манометрии оказалось, что давление НПС уже после рождения составляет 2021 мм рт.ст., что лишь немногим ниже, чем у взрослых. Однако пищеводно-желудочный переход у новорожденных расположен на уровне ножек диафрагмы, замыкание кардии обеспечивается клапанным аппаратом Губарева, основную роль играет угол Гиса. У здоровых детей грудного возраста угол Гиса меньше или равен 90°. Увеличение его более
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
