
6 курс / Неонатология / Неонатология_Н_П_Шабалов_7_е_издание_Том_2_2020
.pdf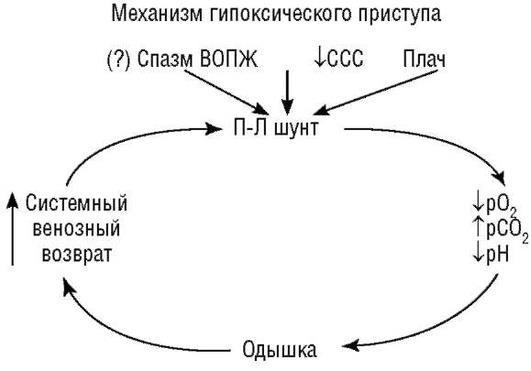
началом тахикардии, одышки и усилением цианоза, что может привести к судорогам, потере сознания и иногда к смерти (рис. 19.7).
Рис. 19.7. Механизм гипоксического приступа
Физикальное исследование позволяет выявить цианоз у большинства больных, а также последствия гипоксии в виде утолщения ногтевых фаланг пальцев с деформацией ногтей (в виде часовых стекол). Эти изменения появляются через 6-12 мес после развития видимого цианоза. Аускультативно определяется
грубый систолический шум вдоль левого края грудины, связанный с градиентом давления на легочном стенозе. При очень маленьком легочном кровотоке шум может ослабевать и даже исчезать. При полной атрезии ЛА слышен лишь систолодиастолический шум артериального протока или аортолегочных кол-латералей. ЭКГ обычно показывает умеренное отклонение вправо, отражая гипертрофию правого желудочка. На рентгенограмме сердце обычно нормальных размеров с характерной тенью в виде «башмачка» c закругленным и приподнятым контуром верхушки и западающим контуром ЛА. УЗИ является основным диагностическим методом, позволяющим определить все анатомические детали, что достаточно для определения тактики хирургического лечения. Только крайняя форма ТФ с атрезией легочной артерии требует зондирования полостей сердца с контрастным исследованием сосудистого русла легких и определения анатомии аортолегочных коллатералей. Без хирургического лечения около 30% больных погибают в сроки до 6 мес жизни. Наиболее частая причина смерти - гипоксия, которая имеет тенденцию усиливаться с возрастом. Другие потенциально смертельные осложнения - это полицитемия, тромбо-тическая легочная артериальная обструкция, церебральные тромбозы и абсцессы и подострый бактериальный эндокардит.
Лечение грудного ребенка с ТФ направлено на предотвращение гипокси-ческих приступов путем своевременной коррекции анемии, дегидратации, гипотензии и ацидоза. Наличие гипоксического криза требует немедленной дачи кислорода, морфина (0,1-0,2 мг/кг) или Обзидана♠ (0,01-0,15 мг/кг внутривенно медленно). При безуспешности этих мер следует переводить ребенка на ИВЛ, компенсировать КОС крови и ставить вопрос об экстренном хирургическом лечении. Хирургическое лечение включает создание системно-легочных шунтов и радикальную коррекцию порока. Паллиативной операцией
выбора в настоящее время считают создание анастомоза между подключичной артерией и ветвью ЛА. Операция выполняется через боковую торакотомию и возможна даже у очень маленьких новорожденных при условии владения микрохирургической техникой. Этот анастомоз можно выполнять при помощи сосудистого протеза (модифицированного), не пересекая подключичную артерию, и собственной подключичной артерии (классической). Данное оперативное вмешательство названо операцией по Блелоку-Таусигу (по фамилиям авторов, впервые ее выполнивших). Летальность при ней в группе больных до 1 года составляет 1-5%. Радикальная коррекция порока может осуществляться в любом возрасте при соответствующем техническом оснащении и высокой квалификации хирурга. Радикальная коррекция заключается в закрытии дефекта МЖП заплатой и устранении легочного стеноза. Для определения показаний к операции наибольшее значение имеет адекватность развития ветвей легочной артерии и отсутствие выраженной гипоплазии левого желудочка. Техника устранения стеноза ЛА зависит от анатомии стеноза. У 70% больных приходится резецировать клапан ЛА, расширяя ее фиброзное кольцо заплатой. У большинства пациентов после операции сохраняется небольшой градиент давления на легочной артерии, создающий систолический шум и имеющий тенденцию к уменьшению с годами. Можно регистрировать наличие резидуальных (остаточных) ДМЖП, которые чаще являются незначимыми и могут
самостоятельно закрываться. Редким, но опасным осложнением является создание во время операции полной поперечной блокады, что требует имплантации электрокардиостимулятора. Большинство больных после операции живут полноценной жизнью, но около 3-5% больных погибают внезапно вследствие аритмий.
Отдельную разновидность составляет ТФ с агенезией (отсутствием) клапана ЛА (3-6% всех больных с ТФ). Порок характеризуется аневризматическим расширением легочных артерий, что может приводить к компрессии трахеи и бронхов и легочным проблемам в раннем возрасте. Радикальная коррекция обычно проводится с использованием протеза для замещения легочной артерии. В настоящее время протезами выбора являются консервированные антибиотиками крупные сосуды: аорта и ЛА с клапанами. Аортальный гомографт используется также для радикальной коррекции тетрады Фалло с полным отсутствием ствола ЛА (атрезией).
19.9.4. Транспозиция магистральных сосудов
Транспозиция магистральных сосудов (ТМС) представляет собой такое состояние, при котором аорта и легочная артерия отходят от несоответствующих желудочков: аорта - от правого, а легочная артерия - от левого. Это приводит к тому, что мало оксигенированная системная венозная кровь выбрасывается в системную циркуляцию, а высокооксигенированная венозная кровь из легочного возврата - в легочную циркуляцию. Таким образом, легочная и системная циркуляция происходят параллельно, в отличие от одной замкнутой цепи кровообращения в норме. Такой тип кровообращения совместим с нормальной внутриутробной жизнью, но после рождения может осуществляться только при наличии хотя бы минимального смешивания между кругами циркуляции, которое позволяет какой-то части оксигенированной крови достигать жизненно важных органов. ТМС - относительно частый порок сердца, составляющий около 5-7% всех ВПС. Это самый частый порок, требующий медикаментозного или хирургического лечения в первые 3 мес жизни. Без лечения 30% детей погибают в течение 1-й недели жизни, 50% - в течение месяца, 70% - в течение 6 мес, 90% - в течение года. Около 70% детей не имеют сопутствующих сердечных аномалий и поэтому с рождения находятся в глубокой гипоксии. Микроциркуляторное смешивание может поддерживаться за счет артериального протока, который обычно закрывается в течение 1-й недели, что определяет наихудший прогноз у этой группы детей. Наиболее частым сопутствующим пороком является ДМЖП (30%), который обычно уменьшает гипоксию, но часто приводит к выраженной гиперволемии легких, что проявляется у этих детей сердечной
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
недостаточностью и ранним развитием обструктивных заболеваний в легочных сосудах и необратимой легочной гипертензией.
Клинические проявления. ТМС относительно редко сочетается с экстракар-диальными аномалиями (9%). Большинство больных - мужского пола (70%).
Масса тела при рождении обычно нормальная или выше нормы. Наиболее постоянным признаком является гипоксия на 1-2-й неделе жизни. РaО2 редко превышает 30-35 мм рт.ст., рСО2 обычно нормальное или слегка повышенное - до 45 мм рт.ст. Характерно незначительное повышение рО2 в ответ на вдыхание чистого кислорода. Сердечная недостаточность более выражена у детей с сопутствующим ДМЖП или ОАП и проявляется одышкой, кардиоме-галией, гепатомегалией, тахикардией, хрипами в легких и редко - периферическими отеками.
При физикальном обследовании можно определить наличие гиперактивности сердца с выраженным сердечным толчком, смещенным медиально. Аускульта-тивная картина непостоянна. В большинстве случаев имеется негромкий систолический шум по левому краю грудины и акцент II тона, объясняющийся близким расположением аорты к грудной клетке. Более выраженный систолический шум чаще наблюдается при наличии значимого стеноза легочной артерии. На рентгенограмме определяется кардиомегалия, узкий сосудистый пучок, сердце в виде «яйца», лежащего на боку, усиление сосудистого рисунка. Однако в первые дни и недели жизни патологические изменения на рентгенограмме, ЭКГ и аускультативные изменения могут отсутствовать. У детей с простой ТМС (без ДМЖП), имеющих большой ОАП и хорошие условия для смешивания, состояние может резко ухудшаться при закрытии артериального протока.
Диагностика. Основным методом диагностики является двухмерная эхо-кардиография с цветной допплерографией. Это исследование показано в срочном порядке каждому новорожденному с цианозом, у которого заподозрен ВПС.
Лечение. Новорожденный c плохим межциркуляторным смешиванием и выраженной гипоксемией должен быть срочно направлен в лечебное учреждение, имеющее опыт лечения таких детей. Реанимационные мероприятия включают ИВЛ (при необходимости), внутривенную инфузию простаглан-дина Е1 (простина) в дозе 0,1 мкг/кг в минуту для поддержания проходимости ОАП, коррекцию метаболического ацидоза бикарбонатом натрия. Обычно такими мерами удается поддержать артериальное рО2 на уровне 35-40 мм рт.ст., что позволяет отложить на несколько дней решение вопроса о хирургическом лечении. Операцией выбора для больного с ТМС и интактной МЖП, а также с наличием сопутствующего большого ДМЖП или ОАП является ранняя анатомическая коррекция (артериальное переключение). Больным с интактной межжелудочковой перегородкой она должна выполняться в возрасте до 2 нед жизни, так как левый желудочек быстро теряет мышечную массу, работая против низкого сосудистого сопротивления легких. Больным с большим ДМЖП или ОАП, имеющим системное давление в левом желудочке, операция может быть отложена до 2-3 мес, но не далее, из-за риска развития необратимых изменений в легочных сосудах, а также риска смерти вследствие неконтролируемой СН. Операция предусматривает отсечение магистральных сосудов выше клапанов в условиях искусственного кровообращения и перемещения их к соответствующим желудочкам. Раздельно перемещаются во вновь конструируемую аорту коронарные артерии. В клиниках, имеющих большой
опыт, летальность при таких операциях составляет 5-8%. Если радикальную операцию в ранние сроки выполнить невозможно из-за неблагоприятной для артериального переключения анатомии, возможно выполнение операции предсердного переключения или гемодинамической коррекции. При помощи внутрипредсердной заплаты или собственных тканей предсердий кровоток из полых вен направляется к митральному клапану, а кровоток из легочных вен - к трикуспидальному клапану, и таким образом
устраняется системная гипок-семия. Основной недостаток гемодинамической коррекции в том, что правый желудочек продолжает нести системную нагрузку, что неблагоприятно сказывается в отдаленном периоде. Оптимальный срок для этих операций - 6-8 мес. Для повышения выживаемости больных до этого возраста в период новоро-жденности принято производить паллиативное создание ДМПП для улучшения межциркулярного смешивания (баллонная атриосептостомия). Процедура выполняется трансвенозным путем под рентгенологическим контролем или контролем эхокардиографии. При наличии сопутствующего стеноза легочной артерии паллиативной операцией может быть создание подключично-легочно-го анастомоза по Блелоку. Сочетание ТМС с большим ДМЖП и стенозом легочной артерии требует радикальной коррекции, которая предусматривает создание внутрижелудочкового тоннеля между ДМЖП и устьем аорты для создания путей оттока из левого желудочка в аорту и одновременного протезирования ствола легочной артерии при помощи синтетического протеза или человеческой консервированной аорты (гомографта). Оптимальный возраст проведения операции - 3-4 года при условии оптимальной анатомии (сбалансированность желудочков, субаортальное расположение ДМЖП, достаточное развитие ветвей легочной артерии).
19.9.5. Аномалия Эбштейна
Аномалия Эбштейна характеризуется нарушением развития правого атриовентрикулярного (трикуспидального) клапана со смещением линии прикрепления его створок в полости правого желудочка, что обычно приводит к недостаточности клапана. Возвращение крови в правое предсердие из желудочка ведет к повышению в нем давления, увеличению его объема, появлению шунтирования крови через овальное отверстие справа налево, что нарушает процесс закрытия этого отверстия в раннем возрасте, приводит к системной гипоксемии. Аномалия имеет широкий спектр клинических проявлений, зависящих в первую очередь от степени смещения клапана в полость правого желудочка и от степени его неполноценности. Существуют формы, не имеющие клинических проявлений, и тяжелые поражения, приводящие к гибели в период новорож-денности. Цианоз у новорожденных часто имеет обратное развитие после естественного снижения легочного сосудистого сопротивления, наступающего в течение первых 1-2 мес жизни. Повторное наступление цианоза возможно в подростковом или взрослом возрасте, что отражает снижение возможности правого желудочка поддерживать нормальный легочный кровоток с увеличением право-левого шунтирования через межпредсердное сообщение. Слабость и одышка при физической нагрузке - обычные симптомы. Значительная дилата-
ция правого предсердия, а также аномалии проводящей системы сердца приводят к частому появлению аритмий, в большинстве случаев в виде пароксизмаль-ной наджелудочковой тахикардии.
Рентгенография показывает кардиомегалию при выраженных формах. Систолический шум может быть зарегистрирован вдоль края грудины. ЭКГ может зарегистрировать различные нарушения ритма и увеличение правого предсердия, о чем говорит появление высокого зубца Р. Аномалия Эбштейна часто сочетает в себе WPW-синдром (синдром укорочения интервала P-Q), что требует обязательного предварительного аритмологического обследования. Проводят электрофизиологическое транспищеводное исследование по выявлению патологических пучков проведения в предсердии и порой с последующей абляцией («пережиганием») этих путей. Точная диагностика достигается эхо-кардиографическим исследованием.
Хирургическое лечение рекомендуется тем больным, у которых имеются выраженные симптомы и высокий риск смерти, если не будет проведена операция. Плохими прогностическими факторами являются выраженная кардио-мегалия (кардиоторакальный индекс более 0,65), выраженный цианоз, сердечная недостаточность, низкая толерантность к физической нагрузке, появление симптомов в раннем возрасте, за
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
последние 10 лет - пластика трикуспидаль-ного клапана (ТК). Суть операции - конусная реконструкция ТК с мобилизацией створок собственного клапана и созданием максимально лучшей коапта-ции (смыкания) клапана, создание «конуса». При умеренных анатомических изменениях также возможно выполнение пластических операций на клапане. При экстремальных формах, когда полость правого желудочка очень маленькая, выполняют операции как при единственном желудочке. Суть операции: гемодинамическая коррекция с перенаправлением потоков крови (венозной и артериальной) таким образом, чтобы они не смешивались внутри сердца. Операции предусматривают направление системного венозного возврата непосредственно в легочное русло, минуя сердце. Этому предшествовали экспериментальные работы, доказавшие, что центральное венозное давление является достаточной движущей силой для легочного кровотока. Важными условиями являются хорошее развитие легочного сосудистого русла, низкое легочное сосудистое сопротивление и хорошая функция миокарда. Впервые выполнили эти операции Гленн и Фонтен, поэтому они называются их именами - операция Гленна и операция Фонтена.
19.9.6. Тотальный аномальный дренаж легочных вен
Тотальный аномальный дренаж легочных вен (ТАДЛВ) составляет приблизительно 1% всех ВПС. Это состояние, при котором вся кровь, возвращающаяся из легких, попадает в системное венозное русло и возвращается в правое предсердие. Наполнение левых отделов сердца возможно только через меж-предсердное сообщение (овальное окно или ДМПП). Анатомически это характеризуется наличием коллектора для легочных вен, располагающегося за левым предсердием и не связанного с ним. Кровь из коллектора дренируется через аномальные вены в верхнюю полую вену (супракардиальный тип - 45%),
в коронарный синус (кардиальный тип - 25%), в систему нижней полой вены (инфракардиальный тип - 20%). Смешанный тип наблюдается редко. Более половины больных имеют нарушение оттока по аномальным венам вследствие анатомических причин и чаще всего погибают в первые дни жизни от отека легких и малого сердечного выброса. Больные, не имеющие обструкции легочного венозного возврата, страдают от увеличения легочного кровотока и чаще всего погибают без хирургического лечения в возрасте до 1 года от сердечной недостаточности и легочных инфекций. Лишь небольшая часть больных имеют шанс дожить до взрослого возраста, имея высокий риск развития обструктив-ного заболевания сосудов легких и необратимой легочной гипертензии. Эхокардиография - основной диагностический метод, хотя в сложных случаях определить место дренирования легочного кровотока можно только при помощи катетеризации полостей сердца с селективной ангиопульмонографией. У новорожденных с очень малыми размерами ДМПП состояние может улучшиться после проведения трансвенозной баллонной атриосептостомии по Рашкинду, что позволяет отложить в ряде случаев радикальную коррекцию ВПС на несколько месяцев. Больные с обструкцией легочного венозного возврата нуждаются в ранней хирургической коррекции. Операция заключается в создании широкого анастомоза между коллектором легочных вен и левым предсердием с одновременным закрытием аномального пути оттока из коллектора и дефекта межпредсердной перегородки. Обструкция легочных вен - наиболее частое осложнение отдаленного периода, чаще всего проявляющееся в течение первого года после операции.
19.9.7. Трикуспидальная атрезия
Трикуспидальная атрезия (ТА) - врожденная аномалия, характеризующаяся отсутствием непосредственного сообщения между правым предсердием и правым желудочком, различной степенью гипоплазии правого желудочка и наличием дефекта межпредсердной перегородки. ТА составляет 1-5% всех ВПС и является третьей по частоте аномалией, вызывающей цианоз, после тетрады Фалло и транспозиции магистральных сосудов.
Различают два основных гемодинамических варианта порока: с уменьшенным легочным кровотоком (70%) и увеличенным легочным кровотоком. Степень легочной волемии зависит от наличия и размеров ДМЖП, наличия и степени стеноза легочной артерии, а при атрезии легочной артерии - от наличия артериального протока или других аортолегочных коллатералей. При любом варианте системный и легочный венозный возврат смешиваются в левом предсердии, но при легочной гиперволемии относительная доля оксигенированной крови, попадающей в сердце, выше, что обусловливает меньшую выраженность цианоза, но приводит к объемной перегрузке левого желудочка и сердечной недостаточности, а в последующем - к развитию обструктивных изменений в легочных сосудах. Наибольшая смертность неоперированных больных наблюдается в первые недели жизни: от гипоксии - в группе с уменьшенным легочным кровотоком и от сердечной недостаточности - у детей с увеличенным легочным кровотоком.
Диагноз ставится на основании эхокардиографии. На 1-м году жизни рекомендуется только паллиативное хирургическое лечение. У детей с уменьшенным легочным кровотоком выполняют подключично-легочный анастомоз по Блелоку. Детям с увеличенным легочным кровотоком требуется операция сужения легочной артерии (операция Мюллера) для уменьшения сердечной недостаточности и профилактики развития легочной гипертензии. Пациенты со сбалансированным легочным и системным кровотоком могут оставаться без операции до 4-5 лет. Специально для коррекции ТА была разработана операция, предусматривающая направление системного венозного возврата непосредственно в легочное русло, минуя сердце (операция Фонтена). Для успешного проведения операции пациент должен соответствовать определенным критериям операбельности:
•давление в ЛА должно быть низким - менее 15 мм рт.ст.;
•сократительная способность левого желудочка должна быть хорошей, ди-астолическая его функция - нормальной;
•ветви ЛА - хорошо развиты;
•регургитация на системном атриовентрикулярном клапане - отсутствовать;
•синусовый ритм - нормальный;
•оптимальный минимальный возраст >4 лет.
Операция Фонтена применяется и при других формах единственного желудочка во всех случаях, когда двухжелудочковая коррекция невозможна, а у больного низкое сосудистое сопротивление в легких.
19.9.8. Стеноз легочной артерии
Стеноз легочной артерии (СЛА) с интактной межжелудочковой перегородкой - ВПС, характеризующийся нарушением нормального кровотока из правого желудочка в систему легочной артерии. Препятствие кровотоку может располагаться в области выходного тракта правого желудочка, клапана легочной артерии или являться комбинированным поражением. Диапазон клинических проявлений очень широк и зависит от места и выраженности сужения. Частичное сращение створок клапана ЛА по комиссурам считается гемодинамически незначимым, если градиент давления на клапане не превышает 30 мм рт.ст., что обычно сопровождается лишь систолическим шумом вдоль левого края грудины и не характеризуется признаками перегрузки и гипертрофии правого желудочка на ЭКГ и рентгенограмме. Другая крайность - полная атрезия клапана, что обычно сопровождается гипоплазией правого желудочка, кровоснабжением легких через артериальный проток, наличием ДМПП со сбросом справа налево, что приводит к системной артериальной гипоксемии. У таких детей имеются выраженная гипоксия и СН
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
сразу после рождения, зависимость от проходимости артериального протока (протокозависимый ВПС), и без лечения они погибают в первые дни и недели жизни. Диагноз ставится на основании эхокардиографии. Новорожденные с атрези-ей клапана легочной артерии находятся в критическом состоянии. Лечение их должно включать назначение простагландина Е1, коррекцию метаболического
ацидоза. Необходим срочный перевод в кардиохирургический стационар, в котором имеется опыт лечения новорожденных. Хирургическое лечение должно включать восстановление кровотока между правым желудочком и легочной артерией (открытая или закрытая вальвулотомия) и, как правило, создание системно-легочного шунта (подключично-легочный анастомоз). Артериальный проток и ДМПП у детей раннего возраста обычно не закрывают. Этим детям часто требуется продленная терапия простагландином Е1 для поддержания проходимости ОАП и снижения сосудистого сопротивления легких. Изолированный СЛА, не сопровождающийся выраженным расстройством кровообращения и цианозом на первом году жизни, обычно подлежит коррекции в возрасте 3-4 лет, причем предпочтение отдают методу трансвенозной баллонной дилатации клапана. Сочетание клапанного стеноза с подклапанным сужением требует проведения операции в условиях искусственного кровообращения. То же самое относится к случаям, когда фиброзное кольцо клапана узкое, а также когда диспластичный клапан, несмотря на ликвидацию сращения створок, создает препятствие кровотоку.
19.9.9. Артериальный ствол
Артериальный ствол (АС) - редкая аномалия, составляющая менее 1% всех ВПС. При этом состоянии системная, легочная и коронарная циркуляции осуществляются из одного магистрального сосуда, который соединяется с сердцем при наличии одного полулунного клапана. ДМЖП является составной частью порока. Умеренный цианоз может наблюдаться в раннем возрасте вследствие смешивания крови на уровне желудочков и магистральных сосудов, однако доминирующим симптомом является СН, возникающая вследствие легочной гиперволемии. Увеличение легочного кровотока наблюдается сразу после естественного снижения легочного сосудистого сопротивления в период новорожденности и является основной причиной смерти детей в возрасте до 1 года. Характерно раннее развитие обструктивного заболевания легочных сосудов с развитием необратимой легочной гипертензии у большинства больных после 1 года жизни. Это обстоятельство диктует необходимость ранней коррекции порока, даже в случае, когда СН поддается контролю консервативными мерами.
Паллиативное хирургическое лечение в настоящее время применяется редко в связи с его неудовлетворительными отдаленными результатами и сложностью последующей радикальной коррекции. В настоящее время большинство хирургов предпочитают выполнять радикальную коррекцию в первом полугодии жизни, предпочтительнее до 3-5 мес. Операция заключается в закрытии ДМЖП таким образом, что левый желудочек соединяется заплатой с устьем артериального ствола. Ветви ЛА отсекаются от ствола и соединяются с правым желудочком при помощи клапаносодержащего кондуита. В настоящее время для этого предпочитают использовать аортальный гомографт, или кондуит, - комбинированный клапансодержащий протез, состоящий из клапана вены крупного рогатого скота - Contegra. Последний требует замены с возрастом. Летальность в сериях операций составляет 15-20%. Послеоперационные проб-
лемы чаще всего связаны с нарушением работы гомографта (стеноз вследствие пролиферации интимы или недостаточность клапана). Если операция выполняется детям более старшего возраста, могут быть осложнения, связанные с персистирующей или прогрессирующей легочной гипертензией.
19.9.10. Единственный желудочек
Единственный желудочек (ЕЖ) - аномалия, характеризующаяся наличием двух АВклапанов, соединяющихся лишь с одним желудочком. Более 80% сердец с одним желудочком имеют также рудиментарную полость второго желудочка, от которой отходит один из магистральных сосудов. В большинстве случаев доминирующим желудочком является левый (78%), реже правый (18%), в 4% случаев - неопределенной морфологии. ТМС наблюдается в 85% случаев. ЕЖ составляет около 4% всех ВПС. Клинические проявления зависят в первую очередь от состояния легочного кровотока. На сбалансированный легочный кровоток указывает САТ (насыщение гемоглобина кислородом) от 75 до 85%. Уменьшенный легочный кровоток характеризуется гипоксией с САТ ниже 75%, увеличенный - соответственно САТ выше 85%. Легочный стеноз или атрезия легочной артерии встречается у более чем половины больных, обусловливая различную степень гипоксии начиная с периода новорожденности. При отсутствии легочного стеноза гемодинамика не отличается от таковой при большом ДМЖП. При этом характерны легочная гиперволемия, сердечная недостаточность в раннем возрасте и развитие обструктивного заболевания легочных сосудов после 2 лет жизни.
Диагностика осуществляется с помощью эхокардиографии. Катетеризация сердца позволяет определить степень развития легочной гипертензии у старших детей, а также источники кровоснабжения легких при атрезии легочной артерии.
Лечение. Хирургическое лечение может быть в виде паллиативных операций гемодинамической и радикальной коррекций. Больным с уменьшенным легочным кровотоком выполняют системно-легочные анастомозы (операция наложения подключично-легочного анастомоза по Блелоку). Больным с увеличенным легочным кровотоком показано оперативное сужение легочной артерии в возрасте до 3 мес для контроля сердечной недостаточности и предотвращения развития обструктивных изменений в легочных сосудах. Окончательная коррекция заключается в операции Фонтена (см. подраздел «Трикуспидальная атрезия») либо в операции септации ЕЖ, во время которой при помощи синтетической заплаты создается вся межжелудочковая перегородка.
19.9.11. Синдром гипоплазии левых отделов сердца
Синдром гипоплазии левых отделов сердца (ГЛОС) - термин, используемый для характеристики целого спектра аномалий сердца, сопровождающихся недоразвитием аорты, левого желудочка, аортального клапана, митрального клапана или, что более характерно, комбинацией этих пороков. Наиболее типичны атрезия аортального клапана, резкая гипоплазия восходящей аорты, причем кровоснабжение аорты осуществляется через артериальный проток.
Синдром является четвертой по частоте врожденной патологией сердца, встречающейся в раннем возрасте, и ответствен за 25% смертей из-за сердечной патологии в течение 1-й недели жизни. Большинство новорожденных с ГЛОС рождаются с нормальной массой и не имеют сопутствующих внесердечных аномалий. При физикальном исследовании у них можно отметить умеренный цианоз и одышку. Нормальное закрытие артериального протока у этих больных приводит к ухудшению коронарного и системного кровотока и, следовательно, к прогрессирующей сердечной недостаточности, ацидозу и смерти. Выживание более 1 мес наблюдается редко, при умеренно выраженных формах синдрома. Диагностика осуществляется при помощи эхокардиографии. Первыми неотложными мероприятиями являются назначение простагландина Е1 (просте-нон) в дозах 0,05-0,1 мкг/кг в минуту для поддержания проходимости артериального протока, коррекция ацидоза, перевод на ИВЛ, инотропная поддержка.
Лечение. Хирургическое лечение сложно и в современных условиях дает большую летальность. В некоторых центрах наличие синдрома является показанием для неонатальной пересадки сердца. Паллиативная коррекция по Норвуду заключается в
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
реконструкции восходящей аорты и создании атрезии легочной артерии с подключичнолегочным анастомозом в период новорож-денности или методикой по Сано с использованием синтетического кондуита или клапансодержащего протеза-гомографта между единственным правым желудочком и легочной артерией. За последнее десятилетие анализируется опыт лечения ГЛОС по результатам клиник мира. Часть операций проводится через предварительную «гибридную» операцию, которая заключается в раздельном суживании ЛА (легочной артерии) и стентировании открытого артериального протока (ОАП). Это способствует снижению сопротивления сосудов малого круга кровообращения, помогает стабилизировать состояние ребенка и легче перенести последующую операцию Норвуда I. Сроки от 6 мес до 1,5-2 лет. Ряд предварительных операций проводят без стентирования ОАП, только раздельным суживанием ветвей ЛА, но это требует более быстрого проведения операции Норвуда I в последующем (примерно в 2-3 недели жизни), т. к. ребенок «требует» постоянного внутривенного введения простина (простагландина Е) для поддержания открытого артериального протока. В дальнейшем (через 6-12 мес) производятся реконструктивные операции, аналогичные таковым при единственном желудочке (операции Гленна и Фонтена, см. подраздел «Трикуспидальная атрезия»).
19.9.12. Стеноз аорты
Стеноз аорты (СА) - сужение на пути оттока крови из левого желудочка. По расположению относительно клапанного кольца аорты различают клапанные, надклапанные и подклапанные СА.
Клапанный стеноз аорты - один из наиболее часто встречающихся ВПС. У мужчин встречается в 2 раза чаще, чем у женщин. Наличие клапанного СА чаще всего связано с аномалией количества створок - наибольший удельный вес имеет двухстворчатый аномальный клапан. Клапанные СА прогрессируют с течением времени. Степень выраженности стеноза оценивают по градиенту
давления (степени снижения систолического давления крови при прохождении через суженный участок аорты). Градиент давления определяется при УЗИ или зондировании сердца.
Клиническая картина характеризуется наличием систолического шума изгнания, проводящегося по току крови на сосуды шеи. Другие симптомы встречаются редко, развитие недостаточности кровообращения нехарактерно. Рентгенологическое исследование при СА малоинформативное, не существует и четкой корреляции между степенью стеноза и изменениями на ЭКГ.
У части больных уже в период новорожденности выявляются признаки НК. В этих случаях говорят о критическом клапанном стенозе аорты. Таким больным показано срочное оперативное лечение.
Подклапанные СА чаще всего связаны с наличием подклапанных фиброзных мембран или гипертрофией миокарда в выходном отделе левого желудочка. Подклапанные СА часто сочетаются с аномалиями дуги аорты (20%) и ДМЖП (17%). Клинические проявления близки к таковым при клапанных стенозах.
Надклапанные СА - сужение над клапаном аорты различной протяженности. Это редкий вид патологии, который часто имеет семейный характер. В большинстве случаев надклапанный СА ассоциирован с синдромом Вил-лиямса, т. е. помимо СА включает типичное изменение лицевого черепа - лицо эльфа, умственную отсталость, периферические стенозы почечных и легочных артерий и гипокальциемию. Гемодинамически надклапанный СА отличается от других СА гипертензией коронарных сосудов, приводящей к раннему развитию кардиосклероза.
Все дети подлежат обязательному УЗИ для уточнения степени и характера СА.
Лечение. При выявлении градиента более 50 мм рт.ст. больные подлежат оперативному лечению - открытой вальвулотомии или баллонной дилатации (в случае клапанного СА) или иссечению структур, затрудняющих отток из левого желудочка. Больные с надклапанным СА подлежат зондированию перед операцией, что связано с высокой частотой сопутствующих сосудистых аномалий. В послеоперационном отдаленном периоде у части больных отмечается рестенозирование, требующее повторного оперативного лечения, поэтому после операции больные подлежат ежегодному УЗИ.
19.9.13. Атриовентрикулярный канал
В основе пороков группы АВК лежит нарушение развития «эндокардиальных подушек», формирующих клапанный аппарат атриовентрикулярного соединения и прилежащие к нему участки межпредсердной и межжелудочковой перегородок. Различают «неполный» АВК, включающий «первичный» ДМПП и аномалию створок митрального клапана, и «полный» АВК, включающий «первичный» ДМПП, приточный ДМЖП и общий для обоих желудочков клапан.
Изменения ЭКГ типичны для всех пороков группы АВК и заключаются в отклонении электрической оси сердца резко влево в сочетании с полной блокадой правой ножки пучка Гиса.
Степень нарушения гемодинамики при «неполном» АВК определяется выраженностью митральной регургитации у больного, при «полном» АВК - наличием ДМЖП и степенью регургитации на едином АВ-клапане.
УЗИ и зондирование сердца позволяют установить точный диагноз и оценить степень поражения клапанов и выраженность ЛГ.
Сроки оперативного лечения больных с «неполным» АВК определяются степенью выраженности митральной недостаточности. Если недостаточность невелика, то операция производится после 1 года жизни и заключается в закрытии ДМПП заплатой и пластике створок митрального клапана. При резко выраженной митральной регургитации операция производится в более раннем возрасте.
В послеоперационном периоде нередко сохраняется умеренная митральная недостаточность. Около 10% больных нуждаются в протезировании митрального клапана в отдаленном периоде.
Дети с «полным» АВК подлежат раннему (до 6 мес) оперативному лечению в связи с быстрым развитием необратимой ЛГ. Производится радикальная коррекция порока, заключающаяся в закрытии заплатами ДМПП и ДМЖП и разделении общего АВ-клапана на митральную и трикуспидальную порции. В послеоперационном периоде проблему представляет лечение нарушений ритма и недостаточности митрального и трикуспидального клапанов.
19.9.14. Коарктация аорты
Коарктация аорты (КА) - сужение аорты, которое может быть различной протяженности и почти всегда располагается дистальнее места отхождения левой подключичной артерии. По частоте занимает 5-6-е место среди ВПС и нередко сочетается с другими пороками (ОАП, ДМЖП, стеноз аорты, аномалии митрального клапана). Почти никогда не сочетается с пороками, создающими нарушение оттока из правого желудочка. Существует несколько вариантов классификации КА, однако с клинической точки зрения важно различать, откуда нисходящая аорта получает кровь: из левого желудочка («взрослый» тип КА) - постдуктальная КА - или из правого желудочка через легочную артерию и артериальный проток («детский» тип) - предуктальная КА.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
