
6 курс / Неонатология / Неонатология_В_2_х_томах_Том_1_Шабалов_Н_П_2020
.pdf
Способ применения и дозы: доза у новорожденных: 0,1 мл/кг.
Препарат добавляется в растворы глюкозы, электролитов и аминокислот. Смешивание растворов должно проводится в асептических условиях. Может вводиться в центральную и периферические вены. Полученный раствор необходимо использовать в течение 24 ч.
В табл. 8.15 приведены рекомендуемые суточные потребности недоношенных детей в витаминах.
Таблица 8.15. Рекомендуемые суточные дозы витаминов при парентеральном питании новорожденных по «Avery's diseases of the newborn», 2018 (цит. по Vanek V.W. et al., 2012)
Витамин |
Доношенные (суточная |
Недоношенные (суточная доза на кг |
|
доза) |
массы) |
Жирорастворимые |
|
|
Витамин А, МЕ |
2300 |
700-1500 |
Витамин D, МЕ |
400 |
40-160 |
Витамин Е, МЕ |
7 |
2,8-3,5 |
Витамин К, мкг |
200а |
10а |
Водорастворимые |
|
|
Витамин В6, мкг |
1000 |
150-200 |
Витамин В12, мкг |
1 |
0,3 |
Витамин С, мг |
80 |
15-25 |
Биотин, мкг |
20 |
5-8 |
Фолиевая кислота, |
140 |
56 |
мкг |
|
|
Ниацин, мг |
17 |
4,0-6,8 |
Пантотенат, мг |
5 |
1-2 |
Рибофлавин, мкг |
1400 |
150-200 |
Тиамин, мкг |
1200 |
200-350 |
Примечание. а - эта доза не исключает введение 0,5-1,0 мг в родах.
Витамины при парентеральном питании
Одновременно с началом проведения парентерального питания назначаются водорастворимые витамины. Солувит Н (Soluvit-N) применяется для удовлетворения суточной потребности тиамина мононитрата, рибофлавина натрия фосфат дигидрата, никотинамида, пиридоксина гидрохлорида, натрия пантотената, натрия аскорбата, биотина, фолиевой кислоты, цианокобаламина. Потребность составляет 1 мл/кг в сутки. Раствор Солувита Н добавляют к растворам Глюкозы♠ (5, 10, 20%), жировой эмульсии или в раствор для парентерального питания (центральный или периферический доступ). Потребность в жирорастворимых витаминах покрывается назначением Ви-талипида Н (витамины А, D2, E, K1). Назначается в зависимости от гестацион-ного возраста и массы тела, одновременно с назначением жировой эмульсии. Потребность - 4 мл/кг в сутки. Виталипид Н детский добавляется в жировую эмульсию. Полученный раствор перемешивают легким покачиванием, затем используют для парентеральных инфузий.
Доза витамина А высока, так как 60-80% его при внутривенном введении теряется вследствие адгезии на пластиковых катетерах и за счет фотооксидации. Не следует вводить недоношенным детям избыток водорастворимых витаминов, так как недоношенные, в отличие от доношенных, не могут их вывести.
Таблица 8.16. Раннее парентеральное питание: стратегия и время достижения необходимых доз для детей с ОНМТ (Ann. Nutr. Metab., 2011)
Показатель |
Первые сутки |
2-5-й день жизни |
6-7-й день жизни (цель) |
|
жизни |
|
|
Глюкоза♠ |
5 мг/кг в минуту |
Увеличить ежедневно или |
Для оптимального роста |
|
|
чаще (норма в крови 6,7- |
достичь 90-100 ккал/кг в |
|
|
8,3 ммоль/л) |
день |
Аминокислоты |
≥2,0 г/кг в день |
Увеличить до 4,5 г/кг в |
|
|
|
день |
|
Липиды |
Через 24 ч (не |
Увеличить до 3,0 г/кг в |
|
|
позднее 2-го дня) |
день |
|
|
1,0 г/кг в день |
|
|
Например, у недоношенных детей низкий клиренс рибофлавина, и избыточные дозы приведут к высоким уровням его в крови.
Раннее парентеральное питание: стратегия и время достижения необходимых доз для детей с ОНМТ (табл. 8.16).
Общая энергетическая ценность (калораж). Для детей менее 1500 г необходимо достичь
≥65 ккал/кг в день к 5-му дню жизни с постепенным увеличением в дальнейшем (к 7-10- му дню) до 90-100 ккал/кг в день при парентеральном питании и 120-135 ккал/кг в день - при энтеральном.
Глюкоза♠. Поскольку дети с ОНМТ часто нетолерантны к вводимой Глюкозе♠, начинать инфузию лучше с 5-7,5% раствора. Последующее увеличение концентрации таким детям целесообразно проводить на 2,5% в день или через день. Некоторые дети могут переносить только самое малое увеличение - на 1% в день. Как правило, для большинства детей достаточно не более 20-22 г/кг Глюкозы♠ в день. При необходимости увеличить калораж для адекватного роста возможно назначение 25 г/кг в день. Однако избыточное введение Глюкозы♠ может привести к повышенному образованию СО2, что повлечет за собой обострение дыхательной недостаточности у детей с легочной патологией. Существуют рекомендации для детей с почечной недостаточностью - при крайнем ограничении объема жидкости увеличить процент Глюкозы♠ до 30%. Вместе с тем введение раствора более чем 20% Глюкозы♠ в центральные линии увеличивает риск развития тромбозов вен. Максимально допустимая концентрация вводимой в
периферические вены Глюкозы♠ - 12,5%.
Аминокислоты. Каждый клиницист должен знать о неотложной необходимости начала введения аминокислот (АК) после рождения. Дети с ЭНМТ ежедневно теряют 1,5% общего уровня белка, если от введения АК воздерживаются. Следовательно, целью раннего парентерального питания является ограничение катаболизма и сохранение эндогенных запасов белка. В соответствии с этой целью, многочисленные исследования четко продемонстрировали как безопасность, так и эффективность раннего введения АК, даже при низкой калорической нагрузке.
При острой почечной недостаточности количество вводимых аминокислот сокращают, а детям с тяжелой хронической почечной недостаточностью необходимо ограничить их введение до 1,5-2 г/кг в день.
У детей, получающих белок из расчета не более 3-4,5 г/кг в день, гиперам-мониемия обычно не развивается. И только в случае необъяснимой упорной сонливости целесообразно проверить уровень аммония.
Описывают, что белковая недостаточность у недоношенных детей распознается по «симптому флага» (название связано с тем, что в результате изменения цвета волос создается впечатление их полосатой окраски). С улучшением белкового статуса волосы снова приобретают нормальную окраску. Мы не встречались с этим симптомом в практической работе.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Растворы аминокислот для недоношенных детей должны содержать таурин (к примеру, Аминовен♠ содержит 0,4 г/л таурина). Применение парентеральных растворов без таурина у детей с незрелой почечной системой приведет к снижению его уровня в организме, что повлечет за собой повреждение развивающегося мозга и сетчатки глаз.
Мониторирование толерантности к белку у недоношенного ребенка оптимальнее проводить по уровню в сыворотке транспортных протеинов: ретинол-связанного протеина, преальбумина (транстиретина), трансферрина и альбумина. Ретинолсвязанный протеин и преальбумин имеют более короткий период полураспада (12 ч и 2 дня соответственно), поэтому их содержание лучше коррелирует с балансом азота и они более чувствительные показатели потребностей в протеинах и калориях у новорожденных. Для сравнения: у альбумина период полураспада - 20-21 день. Снижение уровня этих протеинов, а также отсутствие прибавки массы тела (при достаточной энергетической ценности) и пастозность указывают на неадекватное поступление белка. Жиры. Полноценное ПП новорожденных обязательно должно включать в себя жировую эмульсию как наиболее выгодный источник энергии и незаменимых жирных кислот. В первый день жизни недоношенных новорожденных, по крайней мере, 45-55 ккал/кг в день должны быть предусмотрены для удовлетворения минимальных энергетических потребностей (ESPGHAN, 2018).
В настоящее время предпочтение отдается использованию СМОФлипи-да♠ - уникальной комбинации свойств 4 типов масел: Соевое масло (30%) восполняет потребности незаменимых ЖК; MCT (30%) - среднецепочеч-ные триглицериды - являются источником быстродоступной энергии; Оливковое масло (25%) - источник МНЖК; Fish Oil - рыбий жир (15%) необходим для развития ЦНС, сетчатки глаз, обладает противовоспалительным и иммуномодулирующим эффектом. Дополнительно введен витамин Е (200 мг α- токоферола) для предотвращения ПОЛ и уменьшения окислительного стресса. Использование СМОФлипида позволяет снизить провоспали-тельные реакции, уменьшить неблагоприятное влияние жиров на функции печени: снизить риск холестаза, риск формирования бронхолегочной ди-сплазии и ретинопатии недоношенных. Рекомендован для длительного полного ПП новорожденных, состав максимально приближен к жировому составу материнского молока.
Жиры, если нет противопоказаний, начинают вводить с первых суток (0,5- 1,0 г/кг в сутки). Затем, если ребенок толерантен к липидам, эту дозу увеличивают на 0,5 г/кг в сутки до максимальной - 3 г/кг в сутки.
Внутривенное введение липидов недоношенным детям ограничивают до 2 г/кг в сутки и менее при следующих состояниях:
•уровень непрямого билирубина выше 200 мкмоль/л (при уровне билирубина выше 300 мкмоль/л введение липидов прекращают);
•наличие легочной патологии;
•тяжелая легочная гипертензия;
•генерализованная инфекция;
•уровень триглицеридов более 150 мг/дл.
У недоношенных детей возможно затруднение с выведением жировых эмульсий, развивается гипертриглицеридемия. По этой причине наибольшие сложности с выведением жировых эмульсий возникают у детей с ЭНМТ, с ЗВУР и с постнатальной гипотрофией. При постоянной инфузии в течение 24 ч выведение происходит лучше, чем при периодических введениях. Как правило, доза составляет 0,12 г/кг в час (3 г/кг в сутки) и при круглосуточном введении переносится хорошо.
8.4.2. Энтеральное питание
Определенные трудности, возникающие при кормлении недоношенных детей, вызваны их физиологической незрелостью.
1.Способность к сосанию и глотанию, координация этих рефлексов не развиты до 32-33-й недели гестации; кроме того, зрелость сосательно-глотатель-ного рефлекса также зависит от постнатального возраста (в целом - от постменструального).
2.Малый объем желудка и удлинение времени эвакуации его содержимого при несформированном нижнем пищеводном сфинктере приводят к склонности к срыгиваниям и рвоте.
3.Способность кислотообразования и продукции пепсиногена в желудке низкая.
4.Снижена перистальтика кишечника, что приводит к вздутию живота, перерастяжению кишечника.
5.Снижена активность лактазы (показатель транзиторный, так как с началом энтерального кормления активность фермента быстро нарастает).
6.Всасывание жиров - низкое из-за пониженной продукции солей желчных кислот и панкреатической липазы, сниженной способности к образованию мицелл.
7.Расщепление белков - неполное.
8.Секреция иммуноглобулинов в кишечнике и иммунологический ответ снижены.
9.Уровень клеточной пролиферации и миграции в стенке кишечника низкий. Кроме того, необходимо учитывать, что также снижена функциональная активность следующих органов:
•печени - незрелость ферментативной активности для гликогенолиза и глюконеогенеза;
•почек - снижена способность сохранять такие важные электролиты, как натрий и хлориды; поэтому в первые недели жизни необходимо
дополнительно вводить в правильно рассчитанных количествах жидкость и электролиты;
• легких - это приводит к необходимости длительной вентиляционной поддержки и кислородотерапии, при которых для продолжения развития и созревания легочной ткани и ее функции требуются большие затраты энергии и белка.
При решении практических задач по энтеральному кормлению недоношенных детей нам необходимо ответить на четыре основных вопроса: когда начинать, в каком объеме, чем и каким методом кормить.
Первый вопрос: когда начинать энтеральное питание? Стремление к раннему энтеральному питанию недоношенного ребенка естественно, и это для него не новость, не является вновь приобретаемым умением, ибо внутриутробно он ежедневно заглатывал амниотическую жидкость. К концу III триместра беременности плод поглощает около 500 мл амниотической жидкости в день, получая тем самым около 3 г белка в день, - и это составная часть его питания.
Длительное полное парентеральное питание (ППП) после рождения приводит к атрофии слизистой оболочки и задержке развития ЖКТ. В связи с этим применяется с первых часов жизни трофическое (для слизистой оболочки ЖКТ) питание. Введение грудного молока в желудочно-кишечный тракт недоношенных детей стимулирует его совершенно уникальным образом, особенно значимо для их здоровья, по данным последних
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
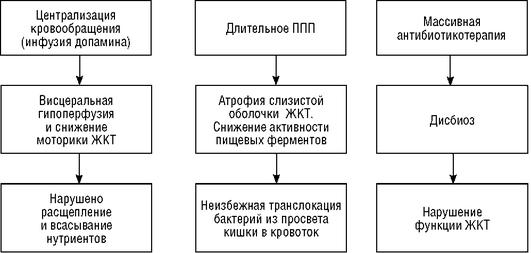
исследований, и нельзя упустить возможность вводить через зонд молозиво при интенсивной терапии недоношенных детей.
Положительная роль раннего трофического энтерального питания представлена в табл.
8.17.
Таблица 8.17. Положительная роль раннего трофического энтерального питания
Введение |
Терапевтические эффекты |
Что лечим? |
грудного молока |
|
|
или смеси |
|
|
Первые порции - |
Повышение активности функции |
Гипербилирубинемию |
«капли» |
печени. Повышение концентрации |
недоношенных. |
нутриента |
интестинальных гормонов. |
Транзиторную гормональную |
|
Повышение секреции инсулина |
|
|
недостаточность. |
|
|
|
|
|
|
Нетолерантность к глюкозе |
>1% суточной |
Повышение функциональной |
Ферментативную |
потребности в |
зрелости |
недостаточность ЖКТ |
энергии |
|
|
10-15% суточной |
Созревание и рост ЖКТ |
Нарушенное и недостаточное |
потребности в |
|
всасывание питательных |
энергии |
|
веществ |
24 мл/кг в сутки |
Моторный эффект |
Динамическую |
|
|
непроходимость ЖКТ |
В целом |
Cнижение массы тела. Быстрая |
«Особые болезни» |
|
прибавка массы тела. Cнижение |
недоношенных детей |
|
частоты БЛД. Cнижение на 30% |
|
|
инфекционной заболеваемости |
|
Схема 8.3. Причины затруднения адекватного энтерального питания недоношенных детей
Энтеральное питание затруднено при проведении интенсивной терапии (схема 8.3).
Вмировой литературе приводится очень большой диапазон начального объема трофического питания: приблизительно от 0,1 до 20 мл/кг в день, чаще 10-14 мл/кг в день.
Внастоящее время рекомендуют больший объем, но только при использовании грудного молока, а не искусственных смесей.
Необходимо отметить, что в отечественной практике накоплен длительный опыт успешного раннего минимального энтерального вскармливания недоношенных детей (Хазанов А.И., 1977-1987; и др.). В настоящее время этот метод продолжает
использоваться на начальных стадиях энтерального питания. Особенностью описываемой отечественной методики является постепенное осторожное, но постоянное ежедневное наращивание объема энтерального кормления под контролем функции ЖКТ (в отличие от вышеописанной тактики, когда нередко одинаковый объем - 10-14 мл/кг вводится в течение 2 нед).
Принять решение, когда начать энтеральное кормление у детей с ОНМТ и ЭНМТ, часто затруднительно. При этом учитываются: гестационный возраст, данные о перинатальной патологии, текущее клиническое состояние (стабилизация, т. е. нет сброса SaO2 на манипуляции, тепловая защита, нормализация респираторной функции), функционирование ЖКТ (меконий отходит) и индивидуальные факторы. Выбор оптимального времени должен быть строго индивидуальным для каждого ребенка и
меняться в соответствии с различным течением болезни у разных детей. Наш опыт позволяет успешно начинать раннее трофическое энтеральное кормление у наиболее стабильных детей даже с ЭНМТ в конце первого дня жизни, строго придерживаясь отработанной «схемы введения недоношенного ребенка в энтеральное питание».
Целесообразно проведение профилактики обтурационной кишечной непроходимости.
Состояние ребенка стабильное. Время проведения манипуляции - не менее 2 ч после рождения. Метод выполнения - желудочный зонд № 4-6 вводится
в анус на глубину 10 см (свободное введение). Объем вводимого изотонического раствора натрия хлорида - 10 мл/кг комнатной температуры шприцом через катетер (свободное введение). После введения физиологического раствора катетер извлекается. Если меконий не получен, повторить процедуру через 12 ч.
Второй вопрос: объем питания в различные периоды постнатальной жизни. Расчет должен быть основан на потребностях ребенка в калориях и нутриентах и ежедневно корректироваться.
Потребности в питательных ингредиентах. В целом, потребность в питательных веществах у недоношенных детей выше, чем у доношенных, вследствие их более ускоренного роста.
Калории. Энергетические потребности детей с низкой массой тела при рождении складываются из следующих затрат на физиологические процессы:
•основной обмен 50 ккал/кг в день;
•тепловой баланс 10 ккал/кг в день (при термонейтральном окружении!);
•физическая активность 15 ккал/кг в день.
Всего на основные жизненные функции - 75 ккал/кг в день:
•специфическое динамическое действие пищи 8 ккал/кг в день;
•потери с фекалиями 12 ккал/кг в день;
•рост ребенка 25 ккал/кг в день.
Всего на дополнительные потребности - 45 ккал/кг в день.
Общие энергетические потребности - 120 ккал/кг в день.
Существуют определенные факторы, которые увеличивают или уменьшают потребности в калорийной нагрузке. Большие затраты - у детей с ЗВУР (130140 ккал/кг в день) вследствие более высокого уровня метаболизма и ускоренного роста, что относится и к детям с ЭНМТ. Энергетические потребности увеличиваются также при стрессовых состояниях: усиление метаболизма (сепсис, лихорадка); проблемы мальабсорбции
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
(синдром короткой кишки); хронические легочные заболевания. Увеличиваются энергозатраты и при нарушении необходимых условий режима выхаживания (нестабильность теплового окружения, большие потери жидкости, обогрев лучистым теплом без дополнительного укрытия). Тип вскармливания также влияет на потребности в калориях. 90 ккал/кг при парентеральном питании по эффективности для организма равняются 120 ккал/кг, введенным энтерально. В некоторых обстоятельствах продолженное введение питания (микроструйное), в отличие от болюсного, может нарушить утилизацию энергии.
Необходимо отметить некоторые отличительные особенности энергетического баланса у детей с ЭНМТ (до 28 нед гестации). Средняя энергетическая потребность с началом роста
уних составляет 130 ккал/кг в день. Известно, что даже рутинные процедуры по уходу за детьми с массой тела до 1000 г, состояние которых стабильно, могут повышать потребление кислорода и энергии на 10%. У таких детей небольшие ритмические колебания температуры в инкубаторе (всегда присутствующие) индуцируют параллельно ритмические изменения температуры тела, т. е. энергетические траты на терморегуляцию
уних более высокие, в то время как энергетические запасы обеднены, их накопление происходит на более поздних сроках беременности.
У детей с ЭНМТ более узкий диапазон «терпимости» недостатка энергии. Для них достаточное обеспечение энергией - жизненно важно, так как недостаточное
поступление калорий приводит к тем нарушениям, которые лежат в основе их особых заболеваний:
•снижаются продукция сурфактанта и его выделение;
•уменьшается защита от токсического действия кислорода, инфекции и баро- /волюмотравмы;
•нарушаются восстановительные способности поврежденных клеточных и внеклеточных компонентов;
•подавлены как рост легких (выражающийся в репликации клеток), так и их структурная дифференцировка;
•истощаются резервы дыхательной мускулатуры, особенно диафрагмы, это приводит к длительным затруднениям при «уходе от ИВЛ» и кислородо-терапии или проявляется приступами апноэ (мышечное утомление).
Наконец, неправильное вскармливание влияет как непосредственно на управление вентиляцией в ЦНС, так и косвенно, изменяя метаболизм, приводя к нарушениям КОС. Оба эти фактора имеют значение в патогенезе развития бронхолегочной дисплазии у детей с низкой массой.
В среднем энергетические потребности недоношенных детей составляют (энтеральное и парентеральное питание вместе):
•1-7-10 дней - 50-120 ккал/кг;
•2-3 нед - 130-140 ккал/кг;
•1-2 мес - 140-150 ккал/кг.
Таблица 8.18. Сводные данные питательных потребностей недоношенных детей
Нутриенты |
Условные периоды |
|
|
|
|
|
|
|
транзиторный |
период |
первый год жизни |
|
период |
метаболической и |
|
|
|
|
|
|
|
клинической |
|
|
|
|
стабилизации |
|
|
|
|
|
|
|
|
с 1-го по 7-й |
с 8-го дня до |
после выписки из |
|
|
день жизни |
выписки из |
отделения |
|
|
|
отделения |
|
|
|
|
интенсивной |
|
|
|
|
терапии |
|
|
Белки г/кг (9-12% общей |
2,5-3,5 |
3,5-4,5 |
(<1000 г) |
3,5 - до 6-9 мес |
калорийности) |
|
3,0-3,6 |
(>1000 г) 3,5 |
откорректированного |
|
|
(ППП) |
|
возраста |
|
|
|
|
|
Жиры г/кг (40-55% общей |
0,5-3,6 |
4,5-6,8 |
|
4,4-7,3 |
калорийности при |
|
|
|
|
энтераль-ном питании - |
|
|
|
|
ЭП, 2540% - при |
|
|
|
|
парентеральном питании - |
|
|
|
|
ПП) |
|
|
|
|
Углеводы (35-55% общей |
5,0-20,0 |
7,5-15,5 |
7,5-15,5 |
|
калорийности при ЭП, 50- |
|
|
|
|
60% - при ПП) |
|
|
|
|
Белки. Потребности недоношенных детей в белках и других ингредиентах (табл. 8.18) были определены при помощи факторного анализа в соответствии с уровнем накопления их внутриутробно. Установлено, что потребность в белке, соответственно уровню отложения его плодом, составляет 3,5-4,0 г/кг в день. Для поддержания оптимального роста ребенок должен получать с белками 9-12,4% общей калорийной нагрузки в сутки. Количество белка и энергетические потребности взаимосвязаны. Если энергетические потребности не восполнены, то синтез белков будет угнетен, а окисление аминокислот повышено. Ребенок не будет прибавлять в весе, несмотря на большое количество потребляемого белка!
Углеводы. У недоношенных детей имеется транзиторное затруднение усвоения лактозы, так как активность кишечной лактазы снижена до 38 нед гестации. К тому же частые нарушения функции кишечника (лечение антибиотиками, диарея, недостаточное питание) снижают активность лактазы, так же как и других дисахаридаз. Однако это состояние кратковременно и практически не вызывает заметных осложнений. Ферменты для полимеров глюкозы достаточно активны у детей менее 1500 г, и такие полимеры хорошо усваиваются и утилизируются. Углеводы пищи должны покрывать приблизительно 3555% общего суточного калоража.
Жиры. У детей с ОНМТ снижено усвоение и всасывание жиров вследствие недостаточного количества желчных солей и низкой активности липазы. В то же время такие дети нуждаются в адекватном количестве питательных жиров для роста, для всасывания жирорастворимых витаминов и кальция. Важно, чтобы в специализированные смеси для недоношенных детей, наряду с ненасыщенными длинноцепочечными триглицеридами, были введены среднецепочечные триглицериды, так как всасывание последних не зависит от количества выделяемой желчи. Желательно, чтобы в целом потребляемые жиры обеспечивали 40-55% общего суточного калоража.
Витамины и минералы. Дети с ОНМТ имеют повышенные потребности в некоторых витаминах и минералах. После рождения водорастворимые витамины не накапливаются в ощутимых количествах (за исключением витамина В12), и поэтому необходимо вводить их, чтобы избежать дефицита.
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
Быстрый рост недоношенных детей и отсутствие накопления внутриутробно требуют, в
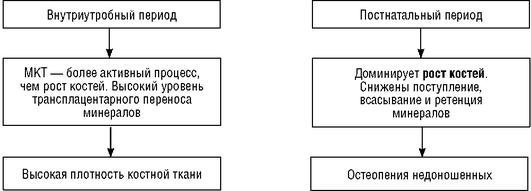
первую очередь, повышенного количества кальция, фосфора, а также витамина D для оптимальной минерализации костей. Эти повышенные потребности в сочетании с неадекватным введением данных минералов с питанием (особенно в период интенсивной терапии) часто приводят к остеопении недоношенных - заболеванию, характеризующемуся недостаточностью органической матрицы и минерализации костной ткани (МКТ).
Остеопения - метаболическая болезнь костей недоношенных - появляется, когда минерализация костей значительно снижена, если сравнивать с плодом или ребенком такого же постконцептуального возраста (схема 8.4). Выделить эту группу риска по развитию остеопении необходимо с самого рождения (до появления рентгенологических признаков на 6-8-й неделе жизни), так как они требуют динамического обследования на этот предмет и особых доз кальция и фосфора.
Схема 8.4. Минерализация костной ткани (МКТ) у плода и недоношенного новорожденного ребенка
Частота остеопении имеет отрицательную корреляцию с массой тела при рождении и гестационным возрастом:
•менее 1500 г - 30% детей;
•менее 1000 г - 50% детей;
•менее 800 г - 73% детей.
Наибольшее количество случаев остеопении описано у недоношенных детей с бронхолегочной дисплазией (БЛД), у детей с ЭНМТ, находящихся на грудном вскармливании без обогатителей, и у тех недоношенных, которые вскармливались стандартной смесью для доношенных детей. У детей с БЛД дефицит кальция и фосфора развивается вторично, вследствие повышенного выведения минералов с мочой в результате диуретической терапии фуросемидом и/или терапии стероидами, наиболее повреждающее действие при их сочетании.
Дефицит кальция и фосфора - основная причина остеопении, также как в дальнейшем и рахита у недоношенных. Попытки лечить большими дозами витамина D при отсутствии адекватной минерализации кости - тщетны, бесполезны и потенциально опасны.
Необходимо подчеркнуть, что особенно выражен недостаток фосфора. А поскольку в костной ткани кальций может быть только в комплексе с фосфором, то при недостатке фосфора кальций будет выводиться с мочой. Важно вводить вместе кальций и фосфор. Введение только кальция:
1)не восполнит полный минеральный дефицит;
2)может вызвать гиперкальциемию;
3) может увеличить гиперкальциурию.
Необходимо также учитывать, что даже при достаточном введении кальция и фосфора низкий статус по витамину D, дефицит цинка и назначение диуретиков - всегда будут способствовать развитию остеопении. Для диагностики основное значение имеют:
•повышение уровня щелочной фосфатазы (ЩФ) более 400-500 МЕ/л;
•уровень фосфора в сыворотке может быть снижен менее 2,0 ммоль/л;
•уровень кальция в сыворотке повышен или нормальный;
•уровень кальция в моче повышен;
•уровень фосфора в моче обычно снижен.
Необходимо регулярное еженедельное мониторирование этих параметров. Несмотря на то, что эти биохимические маркеры не строго специфичны, ЩФ больше 800 МЕ/л и Р сыворотки крови менее 3,5 мг/100 мл (данные A. Lucas) указывают на значительно выраженную остеопению. Огромное большинство случаев - субклинические. Даже при уровне ЩФ более 1000 МЕ/л только 1012% детей имеют клиническую манифестацию. Клиническая картина остео-пении с переломами и респираторными нарушениями встречается относительно нечасто. Однако даже «молчаливая» остеопения может иметь персистирующие последствия - снижение роста к 18 мес (данные A. Lucas).
В настоящее время в некоторых учреждениях возможно подтверждение снижения плотности костной ткани ультразвуковой денситометрией. В ДГБ № 17 Санкт-Петербурга при проведении данного исследования выявлены дополнительные факторы риска развития остеопении: рождение детей из двоен и троен, после артифициальных способов оплодотворения, применение у матерей до и во время беременности гормональных препаратов, у детей с ЗВУР. Поскольку метод безболезненный, простой, не требует длительного времени, целесообразно также проведение ультразвуковой денситометрии при дальнейшем катамнестическом наблюдении, что позволяет корректировать назначение фосфатов, кальция и витамина D. Особенно это важно для детей с БЛД, поскольку умеренные респираторные нарушения; одышка, втяжение межреберий у них часто обусловлены именно остеопенией, а не патологией дыхательной системы. Проведение дифференциальной диагностики оберегает их от избыточного лечения ингаляционными кортикосте-роидами.
Недоношенные дети способны абсорбировать витамин D и преобразовывать его в активную форму (1,25-гидроксихолекальциферол). Начинать дополнительное назначение витамина D следует после стабилизации состояния недоношенного ребенка, с началом его активного роста. Ежедневное введение 400 МЕ витамина D достаточно для более зрелых недоношенных детей, хотя рекомендуемый диапазон - от 400 до 800 МЕ в день. Профилактическая доза 1000 МЕ рекомендована для детей с ЭНМТ. Дополнительно надо вводить кальций: в первый месяц жизни - 120 мг/кг в сутки, со второго месяца - 60 мг/кг в день, фосфор - 60 и 30 мг/кг в день соответственно. При развитии остеопении и отсутствии снижения уровня в крови ЩФ и накопления фосфатов - дозы фосфатов, кальция и витамина D увеличивают.
Запасы железа у детей менее 1500 г снижены, и уже к 2-3-месячному возрасту у них может развиться железодефицитная анемия. Усвоение железа из грудного молока происходит лучше, чем из искусственных смесей. Профилактическая доза дополнительного введения железа составляет 2 мг/кг в день (суточная потребность), лечебная - 6 мг/кг в день. Дополнительное введение железа как для детей, вскармливаемых грудным молоком, так и для получающих смеси, должно начинаться в возрасте 2
Рекомендовано к покупке и изучению сайтом МедУнивер - https://meduniver.com/
