
5 курс / Госпитальная педиатрия / 3 том Респираторная медицина
.pdf
Раздел 19
Вено-артериальная экстракорпоральная мембранная оксигенация
Вено-артериальная ЭКМО — это метод экстракорпоральной поддержки, применяемый для коррекции нарушений насосной функции сердца при отсутствии или наличии сопутствующих расстройств газообменной функции легких. Вено-артериальная ЭКМО может полностью заменить функции сердца/сердце–легкие и используется для тяжелых форм кардиогенного шока или рефрактерного сердца. Возможность периферической канюляции позволяет использовать этот метод практически в любой чрезвычайной ситуации.
Показания:
•кардиогенный шок — сердечный индекс <2,0 л/мин/м2;
•гипотензия — систолического АД <90 мм рт.ст. (взрослые);
•среднее АД <60 мм рт.ст.;
•лактат-ацидоз;
•максимальная инотропная поддержка:
○добутамин — 10 мкг/кг/мин;
○эпинефрин (Адреналин♠) — 0,3 мкг/кг/мин;
•давление заклинивания капилляров легочной артерии >20 мм рт.ст.
Противопоказания:
•несохранность ЦНС;
•необратимое нарушение функции сердца/легких (при отсутствии перспектив для трансплантации);
•хр. ЛГ >IIb–III стадий;
•онкология III–IV стадий;
•выраженная печеночная недостаточность и почечная недостаточность;
•прогрессирующая полиорганная недостаточность;
•острое расслоение аорты (однако метод выбора при проведении операций на торакоабдоминальной аорте);
•ожирение >140 кг.
Вено-венозная экстракорпоральная мембранная оксигенация
Вено-венозная ЭКМО (рис. 19.16) является одним из направлений экстракорпоральной поддержки легких, основанной на замещении газообменной функции у пациентов с острой или хронической дыхательной недостаточностью, сопровождаемой выраженной артериальной гипоксемией и/или гиперкапнией. Обеспечивает газообмен венозной крови (оксигенация и элиминация СО2): SaO2 — 90%, paO2 — 70 мм рт.ст.,
Линия возврата
Оксигенатор
Помпа
Линия забора крови
Рис. 19.16. Схема подключения вено-венозной экстракорпоральной мембранной оксигенации
400

Дыхательная недостаточность
paCO2 — 35–45 мм рт.ст. Создает режим функционального покоя для легких путем снижения травматичности ИВЛ. Применяется при:
•осложненных формах пневмоний (бактериальные, вирусные, H1N1);
•ОРДС;
•аспирационном синдроме;
•остром астматическом статусе;
•АП;
•«мостике» к трансплантации легких;
•массивном легочном кровотечении;
•баротравме легких;
•ранениях легких;
•ожогах (термические, химические) верхних дыхательных путей;
•асфиксиях (утопление).
Показания:
•при гипоксии, вызванной нарушениями респираторной функции, постановка ECLS рекомендована при риске смерти 50% и строго показана при достижении риска смертности 80%:
○50% риск смерти ассоциирован paO2/ FiO2 <150 на FiO2 >90% и/или при индексе Murray 2–3,
○80% риск смерти ассоциирован paO2/ FiO2 <100 на FiO2 >90%;
•нарушения утилизации СО2 (paCO2 >60–80 mm Hg);
•острый кардиореспираторный коллапс;
•жесткие режимы вентиляции (FiO2 = 1,0; пиковое давление во время вдоха = 35 см вод.ст.):
○индекс оксигенации (Oxygenation Index) = (среднее АД×FiO2×100)/paO2:
индекс оксигенации ≥40 >80% (риск летального исхода,
индекс оксигенации = 25–40 >50% (риск летального исхода);
○альвеолярно-артериальный градиент оксигенации:
AaDO2 = FiO2×(760 – 47) – (paCO2/0,8) – paO2,
AaDO2 >610×8 ч >79% (риск летального исхода),
резкое ухудшение состояния,
paO2 <50 мм рт.ст.×4 ч,
paO2 <40 мм рт.ст.×2 ч,
pH <7,15×2 ч;
○неразрешимая гипотензия.
Противопоказания:
•абсолютные:
○возраст >75 лет;
○респираторный дистресс-синдром взрослых более 7 дней;
○лейкопения — лейкоциты >1,5;
○тромбоцитопения — тромбоциты <50.
Видеальных условиях объемная скорость кровотока при проведении вено-венозной ЭКМО должна быть равной минутному объему кровообращения или сердечному выбросу, что позволяет достигнуть «артериализации» всей венозной крови, притекающей к правому предсердию: скорость, улучшающая артериальную оксигенацию, составляет у новорожденных и детей младшего возраста 120–150 мл/кг/мин, а у взрослых — более 50–70 мл/кг/мин. Если целью ЭКМО является устранение гиперкапнии, достаточно поддержания объемной скорости кровотока 30 мл/кг/мин. Объемная скорость для достижения значимого вклада в артериальную оксигенацию должна быть не менее 25% от минутного.
Показателем эффективности вено-венозной ЭКМО следует считать повышение уровня на-
сыщения О2 артериальной крови (SaO2) выше 88–90%. Рекомендуется достигнуть более высо-
ких значений SaO2, что позволит более значимо увеличить доставку О2, компенсировать кислородное голодание, а также реально уменьшить напряженность проводимой ИВЛ, снизив величину
дыхательного объема, частоты дыхания и FiO2 инспираторного потока.
Следует заметить, что неправильное взаиморасположение дренажной и возвратной венозных канюль или двухпросветной венозной канюли приводит к рециркуляции или обратному дренажу «артериализованной» крови обратно в экстракорпоральный контур. Гиповолемия, сниженная функция правого желудочка, а также гиперволемический или гиперкинетический тип центральной гемодинамики, сопровождаемый повышенным минутным объемом кровообращения, превышающим объемную скорость экстракорпорального кровообращения, приводит к шунтированию венозной крови мимо мембранного оксигенатора. На величину рециркуляции «артериализованной» крови влияют взаиморасположение дренажной и возвратной канюль, объемная скорость экстракорпорального кровотока, величина сердечного выброса, размер и объем правого предсердия. Важным моментом является правильное расположение дренажной канюли в просвете нижней полой вены, без ее проникновения в полость правого предсердия, а возвратной канюли — в верхней полой вене. При таком расположении канюль
○необратимые тяжелые сопутствующие засоздается меньше условий для рециркуляции окболевания, потенцирующие полиоргансигенированной крови. Повышением эффектив-
ную недостаточность; |
ности вено-венозной ЭКМО являются устранение |
○ онкозаболевание; |
гиперволемии посредством диуретической и/или |
○ абсолютная лейкопения — лейкоцины <1,5; |
заместительной почечной терапии, коррекция ги- |
○ ИВЛ (FiO2 1,0) >48 ч; |
пердинамического состояния кровообращения за |
•относительные: |
счет снижения дозировок симпатомиметиков или |
○ сепсис; |
применения β-адреноблокаторов. |
401

Раздел 19
Вено-артериовенозная экстракорпоральная мембранная оксигенация
Показания для вено-артериовенозной ЭКМО:
•переход от вено-артериальной к вено-артери- овенозной ЭКМО — это выраженные нарушения функции сердца и газообмена в легких и отсутствие эффективной оксигенации при проведении периферической вено-артери- альной ЭКМО, что требует перенаправления части артериализованной крови через малый круг и левые отделы сердца к верхней части туловища;
•переход от вено-венозной ЭКМО к вено-арте- риовенозной ЭКМО — это развитие плохо поддающегося коррекции нарушения насосной функции сердца, что требует перенаправления части «артериализованной» крови в большой круг кровообращения.
Артериовенозная самопоточная экстракорпоральная мембранная оксигенация
Метод артериовенозной ЭКМО основан на движении крови по экстракорпоральному контуру, которое осуществляется за счет градиента давления между артериальной (бедренная артерия) и венозной (бедренная вена) системой большого круга кровообращения. Пропускная способность оксигенатора составляет 0,8–1,5 л/мин (чем выше градиент, тем больше крови проходит через оксигенатор), что является достаточным для эффективного удаления СО2 из организма. Это основная функция данной системы, так как через оксигенатор проходит артериальная кровь.
Показания:
•обратимые заболевания легких на основании клинико-инструментальных данных или биопсии;
•отсутствие эффекта при жестких режимах вентиляции;
•соотношение pаO2/FiO2менее 100 мм рт.ст.;
•гиперкапния (pаСO2 >70 мм рт.ст.);
•PEEP — до 15 см вод.ст.;
•невозможность снизить фракцию кислорода во вдыхаемом воздухе до 70% в течение 8 ч;
•«мост» к трансплантации легких.
Противопоказания:
•септический шок с низким средним артериальным давлением;
•облитерирующий эндартериит;
•сердечная недостаточность;
•тяжелое поражение периферических артерий;
•противопоказания к назначению антикоагулянтов.
Положительные и отрицательные эффекты ве- но-венозной ЭКМО и вено-артериальной ЭКМО приведены в табл. 19.31.
Канюляция для экстракорпоральной мембранной оксигенации
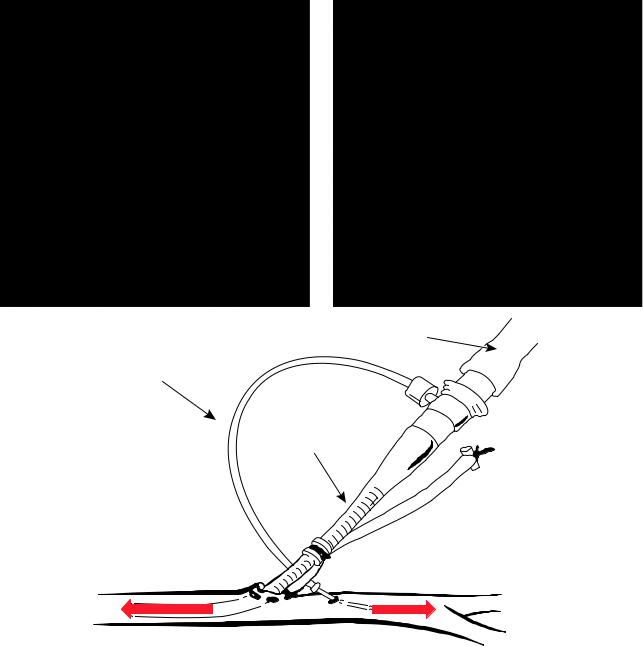
Венозные и артериальные канюли осуществляют забор крови и последующий возврат ее в организм после прохождения через оксигенатор (рис. 19.17). Канюли выпускаются различными производителями, имеют сходные строение, скоростные и резистивные характеристики. Канюли могут быть установлены как пункционным (чрескожным), так и открытым (хирургическим) способом. Правильный подбор диаметра и длины канюль влияет на адекватность кровообращения и процедуры ЭКМО, особенно при периферической методике ее проведения. В настоящее время используются тонкостенные канюли, стенки которых усилены металлической спиралью, что предотвращает возникновение перегибов канюли.
Для проведения артериовенозной ЭКМО у новорожденных применяют усиленные металлической спиралью катетеры диаметром от 8 Fr до 14 Fr. Для вено-венозной ЭКМО используют
Таблица 19.31. Плюсы и минусы вено-венозной и вено-артериальной экстракорпоральной мембранной оксигенации
ЭКМО |
Плюсы |
Минусы |
|
|
|
Вено-венозное |
● Возможность избежать артериальной |
● Может иметь место неадекватная доставка |
|
канюляции. |
кислорода. |
|
● Обеспечивает прямую легочную |
● Не обеспечивает прямой поддержки сердца. |
|
оксигенацию. |
● Высокий риск рециркуляции |
|
● Улучшает коронарную оксигенацию. |
|
|
● Уменьшает риск неврологических |
|
|
нарушений. |
|
|
● Поддерживает сердечный выброс. |
|
|
● Можно использовать вазопрессоры |
|
Вено-артериальное |
● Обеспечивает сердечно-легочную |
● Увеличивает постнагрузку левого желудочка. |
|
поддержку. |
● Снижает пульсовое давление. |
|
● Уменьшает преднагрузку правого |
● Коронарная оксигенация кровью из левого |
|
желудочка. |
желудочка. |
|
● Нет риска рециркуляции крови. |
● «Оглушенный» миокард. |
|
● Лучшая доставка кислорода |
● Влияет на церебральную ауторегуляцию |
|
|
(ухудшает миогенные реакции церебральных |
|
|
артерий и вызывает нарушения эндотелиальной |
|
|
функции) |
402
|
Дыхательная недостаточность |
двухпросветные канюли диаметром 12 Fr и 15 Fr. |
для предотвращения кровопотери. При артери- |
Часто канюляция для вено-венозной ЭКМО у но- |
альной канюляции через просвет бедренной ар- |
ворожденных представляет собой небольшую хи- |
терии существует риск возникновения ишемии |
рургическую операцию. Однако можно произве- |
нижней конечности, что может быть устранено ее |
сти катетеризацию вены двухпросветной канюлей |
изолированной перфузией через дополнительную |
при помощи проводника. У детей и взрослых |
канюлю или однопросветный катетер, установ- |
канюли для вено-венозной ЭКМО часто уста- |
ленный в антероградном направлении в просвет |
навливают чрескожно при помощи проводника. |
поверхностной бедренной артерии ниже места от- |
Когда требуется канюляция артерии (при артери- |
хождения глубокой бедренной артерии. |
овенозной ЭКМО), а пункция сосуда и введение |
Удаление канюли, установленной открыто, тре- |
канюли с помощью проводника невозможны, для |
бует вмешательства сосудистого хирурга. Если ка- |
этого необходимо хирургическое выделение арте- |
нюляция была проведена с помощью проводника |
рии. Важно учитывать, что необходим тщательный |
и без лигирования сосуда, после удаления канюли |
гемостаз при выполнении открытой канюляции |
необходимо лишь наложить кожный шов. |
Артериальная магистраль
Магистраль для перфузии нижней конечности
Артериальная канюля
Ретроградная перфузия |
Антероградная перфузия |
|
Бедренная артерия |
Рис. 19.17. Канюляция для экстракорпоральной мембранной оксигенации
403

Раздел 19
Газообмен и гемодинамика при экстракорпоральной мембранной оксигенации
При увеличении скорости кровотока через оксигенатор возрастает количество кислорода, доставляемого больному. Чтобы удалить больший объем СО2, необходимо увеличить поток газовой смеси. Одним из основных различий между современной и ранее применявшейся методикой ЭКМО является принцип сохранения функционального покоя легких. Во время ЭКМО легкие больного раздуты, но не перерастянуты. Более того, важно, чтобы ИВЛ осуществлялась при низком пиковом давлении, с низкой частотой и низкой фракциональной концентрацией кислорода во вдыхаемой смеси. Обычно при ЭКМО используют следующий режим ИВЛ: частота вентиляции — 10–12 в минуту, FiO2 — до 30%, PEEP — 5–6 см вод.ст.
Гемодинамические эффекты вено-венозной ЭКМО и вено-артериальной ЭКМО различаются. При вено-артериальной ЭКМО сердечный выброс представляет собой сумму собственного сердечного выброса больного и объемной скорости ЭКМО. Поскольку существует смешивание крови в периферической артерии, наиболее точным методом оценки адекватности доставки кислорода является измерение насыщения кислородом смешанной венозной крови. Насыщение крови, взятой из венозной линии, кислородом более 70% указывает на адекватную оксигенацию. Вено-венозная ЭКМО не влияет на сердечный выброс больного. При этом типе ЭКМО происходит рециркуляция и смешивание венозной крови в большей степени, чем при вено-артериальной ЭКМО. Поэтому для оценки адекватности вено-венозной ЭКМО необходимо производить анализ газового состава артериальной крови больного. Мониторинг основных показателей системной гемодинамики (инвазивное измерение систолического, среднего, диастолического, пульсового АД, центрального венозного или правопредсердного давления) необходим для регулирования параметров работы системы ЭКМО и коррекции лекарственной терапии (дегидратация, волемическая нагрузка, вазодилататоры, вазопрессоры или кардиотонические препараты и т.п.). С помощью современных методик легко производится измерение давления в легочной артерии (заклинивающего или окклюзионного), непрерывное измерение ключевых параметров гемодинамики: СО — сердечный выброс, SVV/SV — вариабельность ударного объема/ ударный объем, SVR — общее периферическое сосудистое сопротивление и насыщение кислородом центральной венозной крови. При вено-артериаль- ной ЭКМО необходимо контролировать остаточный кровоток по малому кругу, преднагрузку левых отделов сердца. Инвазивный мониторинг позволяет объективизировать процесс поэтапного отхождения от вспомогательного кровообращения на фоне по-
степенного разрешения миокардиальной недостаточности. С помощью мониторинга центральной гемодинамики (измерение давления в правом предсердии и давления заклинивания легочной артерии) во время ЭКМО оценивается уровень волемии; кроме того, измерение сердечного выброса дает представление о насосной функции сердца как важнейшей детерминанты эффективности ее проведения.
Отлучение от экстракорпоральной мембранной оксигенации
Отлучение от ЭКМО проводится при восстановлении функций легких и включает в себя следующее.
•На протяжении 6–24 ч постепенно снижается производительность ЭКМО каждый час на 5–10% до 25% не менее 250 мл/мин при коррекции вентиляционных (респираторных) настроек аппарата ИВЛ.
•Остановка на 5–10 мин с оценкой кардиореспираторной функции и принятия решения.
•Деканюляция, сосудистая реконструкция.
•Проведение контрольных лабораторных исследований.
Осложнения при экстракорпоральной мембранной оксигенации
При проведении ЭКМО возможно развитие целого ряда осложнений. Среди них:
•механические:
○повреждение сосудов при канюляции,
○тромбообразование в контуре ЭКМО,
○воздушная и материальная эмболии,
○разрыв контура ЭКМО,
○отказ системы безопасности и мониторинга,
○снижение функции оксигенатора,
○отказ работы насоса,
○отказ работы теплообменника;
•неврологические:
○нарушения мозгового кровообращения,
○судороги;
•геморрагические:
○гемолиз,
○коагулопатия потребления,
○тромбоцитопения,
○кровотечение в полости, в месте канюляции;
•сердечно-сосудистые:
○оглушенный миокард (снижение фракции выброса более чем на 25% от исходного и возвращается к норме спустя 48 ч),
○гипертензия — риск кровотечения и острых нарушений мозгового кровообращения,
○аритмии,
○тампонада сердца;
•легочные:
○пневмоторакс,
○легочное кровотечение;
404

Дыхательная недостаточность
•ренальные:
○олигурия (обычно вначале ЭКМО),
○острый тубулярный некроз;
•желудочно-кишечные:
○желудочно-кишечное кровотечение (в результате стресса, ишемии),
○прямая гипербилирубинемия, желчные камни (при гемолизе, длительном голодании, полном парентеральном питании, приеме диуретиков);
•септические осложнения;
•водно-электролитные расстройства.
При ЭКМО изменяется концентрация лекарства в крови в связи с увеличением объема распределения (необходима коррекция дозировки).
Протокол ведения больных при экстракорпоральной мембранной оксигенации
Во время ЭКМО необходимо производить точный мониторинг водного баланса больного. Важно максимально уменьшить поступление жидкости, что достигается ограничением внутривенных назначений, применением диуретиков и гемофильтрации. Регулярное исследование газового состава крови, кислотно-щелочного состояния, электролитного состава, определение уровня лактата, гемоглобина, общего белка, активированного времени свертывания крови, активированного частичного тромбопластинового времени, свободного гемоглобина и других лабораторных показателей является обязательным компонентом динамического наблюдения за пациентами во время проведения ЭКМО.
Определение газового состава крови позволяет оценить эффективность работы мембранного оксигенатора (пробы крови до и после оксигенатора), его вклад в системную оксигенацию и элиминацию СО2. При вено-артериальной ЭКМО пробы крови берутся из лучевой и/или бедренной артерий, из правого предсердия; при вено-венозной ЭКМО также желательно определение газового состава крови из легочной артерии. При проведении периферической вено-артериальной ЭКМО через канюли, установленные в бедренные сосуды, целесообразно исследование газового состава крови из бедренной и лучевой артерий для выявления и устранения неравномерности оксигенации и pаСО2 между верхней и нижней частями туловища.
При вено-артериальной ЭКМО оптимальным считают уровень pH 7,35–7,45, pаO2 150–250 мм рт.ст., pаCO2 35–45 мм рт.ст.; величина SvO2 (на входе в оксигенатор) должна составлять ≥70%, а SaO2 на выходе из оксигенатора — выше 95%. На фоне вено-венозной ЭКМО минимально допустимым является уровень SaO2 — 85%. Снижение SaO2 крови на выходе из оксигенатора менее 95% указывает об уменьшении газообменной способности и о необходимости его замены. Необходимо
непрерывное определение насыщения венозной и артериализованной крови в дренажной и возвратной магистралях экстракорпорального контура с помощью специальных приборов — оксиметров.
Для предотвращения свертывания крови в экстракорпоральном контуре необходима инфузия гепарина, при этом ориентируются на значения активированного времени свертывания крови, производя забор проб каждый час. Необходимо отметить, что активированное время свертывания крови может зависеть от ряда факторов, включая анемию, гипофибриногенемию, тромбоцитопению и другие дефициты факторов свертывания, что может потребовать привлечения в ряде случаев других лабораторных тестов. При ЭКМО активированное время свертывания крови обычно поддерживают
впределах 160–200 с, в зависимости от скорости потока: чем выше скорость потока оксигенатора, тем ниже уровень активированного времени свертывания крови. В случае кровотечения оно должно поддерживаться на меньших значениях.
Гемоглобин у больного поддерживают на высоких значениях — 12–14 г/дл (объем заборов крови должен быть минимальным). Во время ЭКМО происходит разрушение тромбоцитов в экстракорпоральном контуре, что делает необходимым их постоянное возмещение. Обычно при ЭКМО число тромбоцитов поддерживают выше 75 000
в1 мм3 (если имеет место кровотечение, необходимо придерживаться более высоких значений концентрации тромбоцитов).
Список литературы
См. 
19.5. Трансплантация легких
Е.А. Тарабрин, Н.А. Карчевская, М.Ш. Хубутия, А.Г. Чучалин
Этапы развития трансплантации легких
вмире. Вклад российских ученых
вмировую трансплантологию
История трансплантологии началась в России
вначале 1940-х годов и тесно связана с именем со-
ветского ученого Владимира Петровича Демихова (рис. 19.18, см.  ).
).
В1946 г. Демиховым, впервые в мире, было успешно пересажено собаке второе сердце, а вскоре он смог полностью заменить сердечно-ле- гочный комплекс, что стало мировой сенсацией. Через два года он начал эксперименты по пересадке печени, а еще через несколько лет впервые
вмире заменил сердце собаки на донорское. Это доказывало возможность проведения подобной операции на человеке.
В1952–1953 гг. В.П. Демихов разработал метод маммарно-коронарного шунтирования. Он по-
405

Раздел 19
пробовал вшивать внутреннюю грудную артерию в коронарную ниже места ее поражения. Впервые он проделал эту операцию на собаке в 1952 г. — неудачно, и только через год удалось преодолеть главное препятствие, возникающее при наложении шунта, — недостаток времени.
В1954 г. Демихов разработал способ пересадки головы вместе с передними конечностями от щенка на шею взрослой собаки и успешно реализовал его.
В1960 г. В.П. Демихов издал монографию
«Пересадка жизненно важных органов в эксперименте» (рис. 19.19, см.  ), которая в то время была первым в мире руководством по трансплантологии и долгие годы оставалась единственным.
), которая в то время была первым в мире руководством по трансплантологии и долгие годы оставалась единственным.
За рубежом его труд оценили по достоинству. Книгу мгновенно перевели на несколько языков
ипереиздали в Нью-Йорке, Берлине и Мадриде. Ее автор стал во всем мире признанным научным авторитетом — его стали назвать не иначе как отцом трансплантологии.
Дважды, в 1960 и 1963 гг., к Демихову приезжал на стажировку южноафриканский кардиохирург из Кейптауна Кристиан Барнард. Именно эти стажировки, по словам самого Барнарда, окончательно убедили его в том, что пересадка сердца человеку возможна.
Кристиан Барнард стал знаменит на весь мир, когда 3 декабря 1967 г. осуществил первую в мире пересадку сердца человеку. Примечательно то, что сразу же после окончания операции Барнард позвонил Владимиру Петровичу, поблагодарил и попросил разрешения называть его своим учите-
лем. Среди стажеров Демихова был и знаменитый кардиохирург Майкл Дебейки.
Работы Демихова получили международное признание. Ему присвоено звание почетного доктора медицины Лейпцигского университета, почетного члена Королевского научного общества в Уппсале (Швеция), а также Ганноверского университета, американской клиники Майо. Он является обладателем почетных дипломов научных организаций разных стран мира. Владимир Петрович Демихов — признанный основоположник мировой трансплантологии.
Медицина, и в частности трансплантология, не стояла на месте, а продолжала активно развиваться.
В1963 г. Харди впервые пересадил легкое человеку и обнаружил, что пересаженное легкое может участвовать в газообмене. К сожалению, пациент вскоре умер от почечной недостаточности.
Втечение последующих двух десятилетий ни одна из более 40 попыток трансплантации легких не была успешной.
Дальнейшее развитие трансплантологии стало возможным только после открытия иммуносупрессивных препаратов. В 1983 г. в Канаде Джоелом Купером была выполнена первая успешная односторонняя пересадка легких, а тремя годами спустя — двусторонняя.
С 1990 г. количество сообщений о трансплантациях легких в разных странах начало резко увеличиваться. В настоящее время во всем мире осуществляется около 4000 трансплантаций легких ежегодно (рис. 19.20).
|
4500 |
|
|
|
|
|
4000 |
|
|
|
40333973 |
|
|
|
|
37553752 |
|
|
|
|
|
|
|
|
3500 |
|
|
|
3459 |
|
|
|
|
|
|
трансплантаций |
|
|
|
|
3180 |
3000 |
|
|
|
2907 |
|
|
|
|
2841 |
||
|
|
|
|
2706 |
|
2500 |
|
|
|
2482 |
|
|
|
|
|
||
|
|
|
|
2140 |
|
2000 |
|
|
|
19031938 |
|
Количество |
|
|
|
16351713 |
|
|
|
|
|
||
1500 |
|
|
141714451494 |
|
|
|
|
12961300 |
|
||
|
|
|
|
||
|
|
|
1160 |
|
|
1000 |
|
|
1055 |
|
|
|
|
|
874 |
|
|
|
|
|
|
|
|
|
|
|
|
664 |
|
|
500 |
|
|
385 |
|
|
|
|
|
160 |
|
|
5 |
6 |
32 |
69 |
|
|
|
|
|||
|
0 |
|
|
|
|
|
1985 1986 1987 1988 1989 1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 |
||||
|
|
|
|
Годы |
|
|
|
|
Двусторонняя трансплантация легких |
Односторонняя трансплантация легких |
|
Рис. 19.20. Количество ежегодных трансплантаций легких и тип процедуры (The Registry of the International Society for Heart and Lung Transplantation)
406

Дыхательная недостаточность
Селекция реципиентов. Показания и противопоказания к трансплантации легких
Наиболее распространенными показаниями к трансплантации легких в мире являются ХОБЛ, ИЛФ, муковисцидоз, эмфизема в результате дефицита α-1-антитрипсина и идиопатическая ЛАГ.
На долю данных нозологий приходится примерно 85% трансплантаций легких, выполняемых во всем мире.
К остальным 15% относятся заболевания, которые охватывают спектр конечных стадий заболеваний от саркоидоза до ЛАМ и лангергансоклеточного гистиоцитоза (рис. 19.21).
Трансплантацию легких следует рассматривать для пациентов с терминальными стадиями заболеваний легких, у которых наблюдается ухудшение клинического состояния, несмотря на максимальное медикаментозное или хирургическое лечение.
Как правило, кандидаты на трансплантацию имеют ограниченную продолжительность жизни в течение ближайших двух лет.
Кроме того, идеальный кандидат не должен иметь какой-либо дисфункции других органов или медицинской проблемы, которая может поставить под угрозу исход трансплантации.
Рекомендации по отбору реципиента
Рекомендации по отбору реципиента были разработаны Международным обществом трансплантации сердца и легких и включают [1]:
•клинически и физиологически тяжелые заболевания легких, для которых медицинская терапия неэффективна или недоступна;
•риск смерти от прогрессирования болезни легких без трансплантации составляет >50% в течение ближайших двух лет;
•вероятность выживания — по крайней мере в течение 90 дней после трансплантации легких >80%;
•отсутствие внелегочной медицинской коморбидности, которая могла бы существенно ограничить продолжительность жизни в первые 5 лет после трансплантации;
•удовлетворительный психосоциальный профиль и система помощи и поддержки.
|
4000 |
|
|
|
3500 |
|
|
|
3000 |
|
|
трансплантаций |
2500 |
|
|
2000 |
|
|
|
|
|
|
|
Количество |
1500 |
|
|
1000 |
|
|
|
|
|
|
|
|
500 |
|
|
|
0 |
|
|
|
1990 1991 1992 1993 1994 1995 1996 1997 1998 1999 2000 2001 2002 2003 2004 2005 2006 2007 2008 2009 2010 2011 2012 2013 2014 |
||
|
|
Годы |
|
|
ХОБЛ без дефицита |
ХОБЛ с дефицитом |
Муковисцидоз |
|
α-1-антитрипсина |
α-1-антитрипсина |
|
|
Идиопатические |
Интерстициальные заболевания |
Ретрансплантация |
|
интерстициальные |
легких, кроме идиопатических |
|
|
пневмонии |
интерстициальных пневмоний |
|
Рис. 19.21. Количество ежегодных трансплантаций легких в зависимости от нозологии (The Registry of the International Society for Heart and Lung Transplantation)
407

Раздел 19
Абсолютные противопоказания к трансплантации легких [1]
1.Трансплантация легких не может быть предложена пациентам, имеющим онкологические заболевания в анамнезе. Но пациенты, имеющие онкологическое заболевание более чем 2-годичной давности с низкой вероятностью рецидива, могут обсуждаться на предмет включения в лист ожидания трансплантации легких. Однако наиболее разумно включать в лист ожидания пациентов, имеющих 5-летний период наблюдения после радикального излечения онкологического процесса.
2.Значительная дисфункция других жизненно важных органов (сердце, печень, почки, головной мозг).
3.Атеросклеротические заболевания, с подозрением или подтвержденной терминальной ишемией или дисфункцией коронарных артерий, не подлежащих реваскуляризации.
4.Острое нестабильное состояние, включающее сепсис, инфаркт миокарда, печеночную недостаточность и др.
5.Геморрагический диатез, не подлежащий медикаментозной коррекции.
6.Неконтролируемая или плохо контролируемая инфекция легочной или внелегочной локализации.
7.Активный туберкулез.
8.Значительная деформация позвоночника и грудной стенки, которая, как ожидается, может провести к серьезным рестриктивным изменениям после трансплантации.
9.Ожирение 2-й–3-й степени (ИМТ более 35 кг/м2). 10. Невыполнение рекомендаций по медикаментозной терапии как в настоящее время, так и по данным анамнеза, что увеличивает риски невыполнения рекомендаций после транс-
плантации легких.
11. Психиатрическое или психологическое состояние, ассоциированное с неспособностью к кооперации с медицинским персоналом и/ или невозможностью придерживаться комплексной медикаментозной терапии.
12. Отсутствие адекватной или надежной социальной поддержки.
13. Выраженные ограничения функционального статуса с крайне низким реабилитационным потенциалом.
14. Активное табакокурение.
15. Наркотическая или алкогольная зависимость.
Относительные противопоказания к трансплантации легких [1]
1.Возраст старше 65 лет в ассоциации с низким физиологическим резервом и другими относительными противопоказаниями.
2.Ожирение 1-й степени (ИМТ от 30 до 34,9 кг/м2).
3.Выраженный или прогрессирующий дефицит массы тела.
4.Тяжелый остеопороз.
5.Предыдущие обширные хирургические вмешательства на грудной клетке с резекцией легкого.
6.ИВЛ и/или ЭКМО (но при тщательной селекции кандидатов, при отсутствии дисфункции со стороны других органов и систем ИВЛ и ЭКМО могут выступать в качестве «мостика» к трансплантации легких, и пациенту может быть выполнена операция).
7.Колонизация или инфицирование высокоустойчивыми или высоковирулентными бактериями, грибами и определенными штаммами микобактерий.
8.ВИЧ-инфекция (возможно обсуждение трансплантации легких при ВИЧ-инфекции при условии контролируемости заболевания с отрицательным результатом РНК ВИЧ в крови и при нахождении на комбинированной антиретровирусной терапии).
9.Наличие вирусного гепатита В или С (трансплантация легких возможна при отсутствии признаков цирроза и портальной гипертензии).
10.Отсутствие последовательной и надежной системы психосоциальной поддержки.
11.Такие заболевания как СД, системная гипертензия, эпилепсия, язвенная болезнь или ГЭР следует оптимально контролировать перед
включением в лист ожидания.
Направление в трансплантационный центр и оценка кандидата на трансплантацию занимает много времени, и в идеале этот процесс должен быть завершен до того, как состояние пациента приблизится к тяжелому.
Таким образом, отправлять пациентов с прогрессирующим заболеванием легких на обследование в трансплантационный центр необходимо тогда, когда пациенты еще способны пройти стандартную обширную многопрофильную оценку, чтобы определить потенциальные риски и преимущества оперативного лечения в каждом конкретном случае.
Направление в трансплантационный центр не означает, что пациент будет обязательно включен в лист ожидания трансплантации легких.
Только после всесторонней оценки самого пациента, его семьи специалисты трансплантационной команды будут совместно решать, включать ли пациента в лист ожидания трансплантации легких.
Оценка потенциального реципиента
Для оценки потенциального реципиента проводятся следующие исследования.
•Лабораторные тесты:
○общий анализ крови;
○коагулограмма;
408

Дыхательная недостаточность
○железо, общая железосвязывающая способность сыворотки, ферритин;
○глюкоза, гликированный гемоглобин;
○полная метаболическая панель (электролиты, печеночные ферменты, креатинин и т.д.);
○тест на беременность у женщин детородного возраста;
○анализ мочи;
○мозговой натрийуретический пептид;
○уровень витамина Д;
○тип групп крови и кросс-матч (АВ0);
○высокочувствительные методы и твердофазная оценка для HLA I и II антител;
○котинин сыворотки и мочи;
○токсикологический скрининг для пациентов, имеющих в анамнезе указания на употребление наркотиков или подозреваемых в употреблении наркотиков в настоящее время.
•Оценка инфекционного статуса:
○ЦМВ IgG/IgM;
○вирус Эпштейна–Барр IgG/IgM;
○гепатит В и С;
○вирус простого герпеса IgG/IgM;
○ВИЧ;
○Varicella Zoster IgG/IgM;
○Coccidioides IgG/IgM;
○Toxoplasma IgG/IgM;
○Strongyloides IgG;
○туберкулиновый кожный тест;
○культуральное исследование мокроты, в том числе на кислотоустойчивые микобактерии.
•Тесты для оценки дыхательной функции:
○спирометрия до и после бронхолитика;
○легочные объемы;
○ДСЛ по монооксиду углерода;
○тест с 6-минутной ходьбой;
○газовый анализ артериальной крови.
•Имидж-диагностика патологии органов грудной клетки:
○рентгенография органов грудной клетки;
○КТ органов грудной клетки;
○вентиляционно-перфузионное сканирование легких.
•Оценка функции сердца:
○ЭКГ;
○эхокардиография;
○катетеризация правых отделов сердца для пациентов с ЛГ.
•Дополнительные обследования:
○остеоденситометрия;
○колоноскопия (если возраст более 50 лет);
○маммография и гинекологическое обследование для женщин;
○исследование специфического антигена простаты и пальцевое ректальное исследование предстательной железы (для мужчин);
○стоматологическое обследование.
•Оценка ГЭР и оценка желудка:
○pH-метрия;
○импедансный pH зондовый мониторинг;
○эзофагеальная манометрия;
○эзофагодуоденоскопия. Вышеперечисленные обследования могут быть
дополнены и другими, если это необходимо для более точной оценки состояния пациента.
Направление в трансплантационный центр [1]
Параметры, при которых уже необходимо направлять пациентов на обследование в специализированный центр, включают следующие показатели.
•Прогрессирующая, несмотря на отказ от курения и адекватную медикаментозную терапию, ХОБЛ: потребность в дополнительной оксигенотерапии, BODE-индекс от 5 до 6;
pаСО2 >50 мм рт.ст. и/или pаО2 <60 мм рт.ст. или ОФВ1 <25% от нормы.
•Пациентов с типичной КТ-картиной, характерной для ИЛФ или морфологически верифицированной ОИП или НИП, вне зависимости от функциональных показателей следует направлять для оценки в трансплантационный центр.
•ИЗЛ, ассоциированные с системными заболеваниями, саркоидоз или ЛКГ, которые имеют III или IV функциональный класс по критериям Нью-Йоркской кардиологической ассоциации, т.е. жалуются на одышку при минимальной физической нагрузке, или их состояние ассоциировано с прогрессивным ухудшением.
•Дополнительные параметры, которые необходимо оценить у пациентов с ИЗЛ: ФЖЕЛ <80% от должного и диффузионная способность по монооксиду углерода менее 40% от должного или дополнительная потребность в кислороде как в покое, так и при физической нагрузке.
•Пациенты с легочными сосудистыми заболеваниями, с III или IV функциональным классом по критериям Нью-Йоркской кардиологической ассоциации, несмотря на усиление терапии, должны быть рассмотрены для возможной трансплантации легких. Пациенты с легочной веноокклюзионной болезнью и легочным гемангиоматозом должны быть оцене-
ны во время постановки диагноза.
•К показаниям для направления пациентов с муковисцидозом в трансплантационный центр относятся: ОФВ1 <30% от должного; расстояние, пройденное в тесте с 6-минутной ходьбой <400 м; развитие ЛГ, а также развитие угрожаемого для жизни кровохарканья, не контролируемого эмболизацией.
Показания для включения в лист ожидания трансплантации легких в зависимости от нозологии [1]
ИЗЛ:
•снижение ФЖЕЛ более чем на 10% в течение ближайших 6 мес наблюдения (5% снижение
409
