
- •Тема 1. Кинематика поступательного движения
- •Тема 2. Кинематика вращательного движения
- •Тема 3. Динамика поступательного движения
- •Тема 4. Работа и энергия
- •Тема 5. Динамика вращательного движения
- •2. Элементы специальной теории относительности и механики сплошных сред
- •Тема 6. Основы специальной теории относительности
- •3. Термодинамика и молекулярная физика.
- •Тема 8. Феноменологическая термодинамика
- •Тема 9. Молекулярно-кинетическая теория
- •Тема 10. Элементы физической кинетики
- •4. Электричество и магнетизм
- •Тема 11. Основные характеристики и закономерности электростатики
- •Тема 12. Проводники и диэлектрики в электрическом поле
- •Тема 13. Постоянный электрический ток
- •Тема 14. Основные характеристики и закономерности магнитостатики
- •Тема 15. Вещество в магнитном поле
- •Тема 16. Явление электромагнитной индукции
- •Тема 17. Основы теории Максвелла для электромагнитного поля. Электромагнитные волны
- •5. Колебания и волны
- •Тема 18. Свободные гармонические колебания
- •Тема 19. Затухающие и вынужденные колебания. Сложение колебаний
- •Тема 20. Волны. Уравнение волны. Энергия волны
- •6. Волновая оптика
- •Тема 21. Интерференция света
- •Тема 22. Дифракция света
- •Тема 23. Поляризация света
- •Тема 24. Распространение света в веществе
- •7. Квантовая оптика
- •Тема 25. Тепловое излучение
- •Тема 26. Фотоэлектрический эффект
- •Тема 27. Эффект Комптона. Давление света
- •8. Квантовая физика и физика атома.
- •Тема 28. Атомная физика
- •Тема 29. Оптические квантовые генераторы
- •Тема 30. Элементы квантовой механики
- •9.Элементы ядерной физики и физики элементарных частиц. Физическая картина мира.
- •Тема 32. Основы физики атомного ядра
- •Тема 33. Элементарные частицы и фундаментальные взаимодействия
Тема 9. Молекулярно-кинетическая теория
В молекулярно-кинетической теории пользуются идеализированной моделью идеального газа,согласно которой считают, что:
1) собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда;
2) между молекулами газа отсутствуют силы взаимодействия;
3) столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
В газе молекулы большую часть времени находятся так далеко друг от друга, что силы взаимодействия между ними практически равны нулю. Можно считать, что кинетическая энергия молекул газа много больше потенциальной, поэтому последней можно пренебречь.
В молекулярной физике и термодинамике состояние газа характеризуется совокупностью трех макропараметров р, V, Т, которые называются параметрами состояния.
Температура — одно из основных понятий, играющих важную роль не только в термодинамике, но и в физике в целом. Температура— физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В соответствии с решением XI Генеральной конференции по мерам и весам (1960) в настоящее время можно применять только две температурные шкалы — термодинамическую и Международную практическую,градуированные соответственно в кельвинах (К) и в градусах Цельсия (°С). В Международной практической шкале температура замерзания и кипения воды при давлении 1,013 10sПа соответственно О и 100°С (репервые точки).
Давлениев системе СИ измеряется в Па (паскаль): 1Н/м2=1 Па. Часто пользуются и внесистемными единицами давления: 1 мм рт. ст.=133,3 Па; техническая атмосфера 1 ат = 750 мм рт. ст.105Па; нормальная (физическая) атмосфера: 1атм=760мм рт.ст.1,013. 105Па.
Основным уравнением кинетической теории газов называется соотношение, связывающее давление (величину, измеряемую на опыте) со скоростью или кинетической энергией молекулы газа.
 (3)
(3)
Данное выражение называется основным уравнением молекулярно-кинетической теории идеальных газов.Это уравнение как раз и устанавливает связь между давлением и скоростью, вернее среднеквадратичной скоростью.
Введем
 – среднюю кинетическую энергию
хаотического поступательного движения
одной молекулы, тогда основное уравнение
запишется как:
– среднюю кинетическую энергию
хаотического поступательного движения
одной молекулы, тогда основное уравнение
запишется как: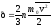 или
или
В данном уравнении давление связано со средней энергией поступательного движения молекул. Давление газа численно равно 2/3 средней кинетической энергии поступательного движения молекул, содержащихся в единице объема.
Давление идеального
газа связано с температурой соотношением:
 .
.
Давление определяется только концентрацией (при постоянной температуре) и не зависит от сорта молекул.
Если имеем смесь
нескольких газов, концентрация молекул
которых n1, n2,
..., niи ,
то
,
то .
.
Давления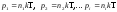 называют парциальными давлениями.
Например, р1– парциальное давление
соответствует давлению, которое оказывал
бы первый газ, входящий в состав смеси,
если бы он занимал весь объем.
называют парциальными давлениями.
Например, р1– парциальное давление
соответствует давлению, которое оказывал
бы первый газ, входящий в состав смеси,
если бы он занимал весь объем.
Согласно закону
Дальтонав случае идеальных газов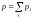 .
.
Таким образом, давление, оказываемое на стенки сосуда смесью газов, равно сумме парциальных давлений отдельных компонентов смеси.
Газовые законы. Уравнение Менделеева-Клапейрона.
Экспериментальное
исследование свойств газов, проведенное
в ХVII-XVIII вв. Бойлем, Мариоттом, Гей-Люссаком,
Шарлем, привело к формулировке газовых
законов: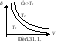
1. Изотермический процесс – Т=const. Закон Бойля-Мариотта: pV=const – уравнение изотермы.
График зависимости p отVприведен на рисунке 31.1. Чем выше изотерма, тем более высокой температуре она соответствует, T2>T1.
2. Изобарный
процесс – p= const.Закон
Гей-Люссака:
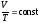 – уравнение изобары. График зависимости
V от T приведен на рисунке 31.2. Чем ниже к
оси температуры наклонена изобара, тем
большему давлению она соответствует,
р2 > p1.
– уравнение изобары. График зависимости
V от T приведен на рисунке 31.2. Чем ниже к
оси температуры наклонена изобара, тем
большему давлению она соответствует,
р2 > p1.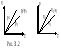
3. Изохорический
процесс– V=const.Закон
Шарля:
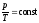 – уравнение изохоры. График зависимостиротТизображен на рисунке 31.3.
Чем ниже к оси температуры наклонена
изохора, тем большему объему она
соответствует,V2 >V1.
– уравнение изохоры. График зависимостиротТизображен на рисунке 31.3.
Чем ниже к оси температуры наклонена
изохора, тем большему объему она
соответствует,V2 >V1.
Комбинируя выражения
газовых законов, получим уравнение,
связывающее р, V, Т : .
.
Постоянная в этом
уравнении определяется экспериментально.
Для 1 мольгаза она оказалась равной
R=8,31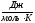 и была названа универсальной газовой
постоянной.
и была названа универсальной газовой
постоянной.
1 моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг. Число молекул (структурных единиц) в 1молеравно числу Авогадро: NA=6,02.1023моль-1. Для R справедливо соотношение: R=kNA
Итак, для одного
моля:
 .
.
Для произвольного
количества газа
= m/(уравнение
Менделеева-Клапейрона):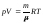 ,
где- молярная
масса газа.
,
где- молярная
масса газа.
Установим связь
между уравнением кинетической теории
газов и уравнением Менделеева-Клапейрона:
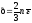 ,
, .
.
Так как n=N/V,
то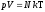 .
.
Для количества
вещества справедливо соотношение
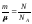 ,
а для постоянной Больцманаk= R
/NA, поэтому последнее уравнение
можно записать в виде:
,
а для постоянной Больцманаk= R
/NA, поэтому последнее уравнение
можно записать в виде: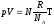 или
или .
.
Распределение скоростей молекул по Максвеллу.
Молекулы идеального газа совершают беспорядочное тепловое движение. Ввиду полной беспорядочности движения молекул и огромного их числа нет возможности судить о скорости каждой молекулы в любой момент времени. Возможно определить лишь число молекул, скорости которых лежат в определенном интервале скоростей.
Теоретически задачу о распределении молекул идеального газа по скоростям поступательного движения решил Максвелл. Он показал, что число молекул, имеющих малые скорости и большие скорости относительно мало. Оказывается, что скорости большинства молекул лежат в окрестности некоторой средней скорости. С помощью теории вероятностей (1859) Максвеллу удалось вывести формулу для относительной частоты, с которой в газе при данной температуре встречаются молекулы со скоростями в определенном интервале значений.
Если N - общее число молекул газа, dN - число молекул, скорости которых заключены в интервале от v до v+dv, то закон распределения Максвелла запишется в виде:
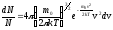 (1)
(1)
По определению
плотности вероятности
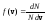 ,
поэтому здесь
,
поэтому здесь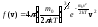 (2)
(2)
– функция распределения. Она указывает долю молекул dN/N, обладающих скоростями, лежащими в интервале dv около значения скорости v. Из этой формулы видно, что конкретный вид функции зависит от рода газа (m0) и от параметров состояния (Т).
График функции
распределения приведен на рис.32.1. Так
как при возрастании v множитель
 уменьшается быстрее, чем растет множитель
v2, то функция
уменьшается быстрее, чем растет множитель
v2, то функция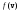 ,
начинаясь от нуля, достигает максимума
при vви затем асимптотически
стремится к нулю. Положение максимума
характеризует наиболее часто встречающуюся
скорость, которую называютнаиболее
вероятной скоростьюvв. Скорости,
превышающие vв, встречаются чаще,
чем меньшие скорости. Кривая асимметрична
относительно vв. Относительное
число молекул, скорости которых находятся
в интервале от v до v+dv, находится как
площадь заштрихованной полоски. Площадь,
ограниченная кривой распределения и
осью абсцисс, равна единице. Это означает,
чтоf(v) удовлетворяет условию
нормировки:
,
начинаясь от нуля, достигает максимума
при vви затем асимптотически
стремится к нулю. Положение максимума
характеризует наиболее часто встречающуюся
скорость, которую называютнаиболее
вероятной скоростьюvв. Скорости,
превышающие vв, встречаются чаще,
чем меньшие скорости. Кривая асимметрична
относительно vв. Относительное
число молекул, скорости которых находятся
в интервале от v до v+dv, находится как
площадь заштрихованной полоски. Площадь,
ограниченная кривой распределения и
осью абсцисс, равна единице. Это означает,
чтоf(v) удовлетворяет условию
нормировки: .
.
Значение наиболее
вероятной скорости vвнаходят,
исследуяf(v) на экстремум: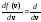
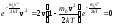 .
.
Значения v=0 и v=соответствуют минимумам распределения
(1), а значение v, при котором выражение
в скобках равно нулю, и есть наиболее
вероятная скорость: vв=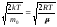 .
Из полученной формулы видно, что с
повышением температуры газа максимум
кривой распределения смещается в сторону
больших скоростей. Однако площадь,
ограниченная кривой остается неизменной,
поэтому при повышении температуры
кривая распределения молекул по скоростям
будет растягиваться и понижаться, то
есть наиболее вероятная скорость
возрастает, а доля молекул, обладающих
этой скоростью, уменьшается (рис. 32.2).
.
Из полученной формулы видно, что с
повышением температуры газа максимум
кривой распределения смещается в сторону
больших скоростей. Однако площадь,
ограниченная кривой остается неизменной,
поэтому при повышении температуры
кривая распределения молекул по скоростям
будет растягиваться и понижаться, то
есть наиболее вероятная скорость
возрастает, а доля молекул, обладающих
этой скоростью, уменьшается (рис. 32.2).
Если выразить
скорости молекул не в обычных единицах,
а в относительных, приняв за единицу
скорости наиболее вероятную скорость
молекул, то распределение Максвелла
принимает вид:
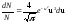 ,
,
где u=v/vи– относительная скорость молекул.
Средняя скорость
молекулы v
(средняя арифметическая скорость)
определяется из условия: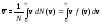 .
.
Подставляя сюда
f(v) и интегрируя, получаем:
Итак, различают следующие характерные скорости молекул газа:
1) наиболее
вероятная скорость vв=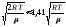 ;
;
средняя арифметическая скорость
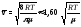 ;
;
3) средняя
квадратичная скорость vкв=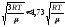 .
.
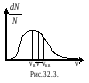
Последовательность расположения указанных выше скоростей представлена на графике рис.32.3.
Барометрическая формула. Закон распределения Больцмана.
При выводе основного
уравнения молекулярно-кинетической
теории газов предполагалось, что на
молекулы газа внешние силы не действуют,
поэтому молекулы равномерно распределены
по объему. 
Молекулы газа, находящиеся в поле тяготения, участвуют в тепловом движении и испытывают действие силы тяжести. Тяготение и тепловое движение приводят к состоянию газа, при котором наблюдается убыль концентрации и давления газа с возрастанием высоты над землей.
Выведем закон изменения давления с высотой, предполагая, что поле тяготения однородно, температура постоянна и масса всех молекул одинакова и равна m0.
Атмосферное
давление на некоторую площадку S
обусловлено весом столба воздуха над
этой площадкой (т.е. действием силы
тяжести). Пусть на высоте h – давление
р, а при h=0 – p=p0 (рис. 33.1). Рассмотрим
изменение давления элемента “столба”
высотойdh, в пределах которого
концентрацию можно считать постоянной.
Убыль давления в пределахdh: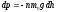 .
.
Но
 ,
или
,
или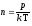 ,
поэтому:
,
поэтому: .
.
Произведя разделение
переменных:
 ,
получим
,
получим
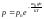 .
.
Если учесть, что
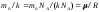 ,
тогда
,
тогда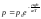 .
.
Зависимость давления атмосферы от высоты над уровнем моря при постоянной температуре называют барометрической формулой.
Пользуясь
барометрической формулой
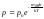 ,
можно получить закон изменения
концентрации с высотой. Приняв во
внимание
,
можно получить закон изменения
концентрации с высотой. Приняв во
внимание и
и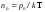 ,
гдеnиn0– концентрация
молекул на высоте h и h0=0 и подставляя
р и р0в барометрическую формулу,
получим закон распределения концентраций
по высоте:
,
гдеnиn0– концентрация
молекул на высоте h и h0=0 и подставляя
р и р0в барометрическую формулу,
получим закон распределения концентраций
по высоте: ,
,
Полученное
распределение Больцмана справедливо
для поля тяготения, для которого
 –
потенциальная энергия на высотеh (на
разной высоте молекула обладает различным
запасом потенциальной энергии). Однако
оно справедливо и для идеального газа,
находящегося в любом другом потенциальном
поле:
–
потенциальная энергия на высотеh (на
разной высоте молекула обладает различным
запасом потенциальной энергии). Однако
оно справедливо и для идеального газа,
находящегося в любом другом потенциальном
поле:
распределение Больцмана в поле с потенциальной энергией U .
При Т, nn0, то есть происходит выравнивание концентрации газа по всему объему, занимаемому газом. При Т0, n0, то есть все молекулы опустятся на поверхность Земли (если речь идет об атмосфере).
Распределение энергии по степеням свободы.
Средняя энергия
(из вывода основного уравнения кинетической
теории газов), приходящаяся на одну
молекулу
 .
Если считать молекулу шариком (как в
одноатомном газе), то средняя энергия
такой частицы определяется средней
кинетической энергией ее поступательного
движения. Энергию эту можно представить
как сумму трех слагаемых – кинетических
энергий движения молекулы по трем
взаимно перпендикулярным направлениям:
.
Если считать молекулу шариком (как в
одноатомном газе), то средняя энергия
такой частицы определяется средней
кинетической энергией ее поступательного
движения. Энергию эту можно представить
как сумму трех слагаемых – кинетических
энергий движения молекулы по трем
взаимно перпендикулярным направлениям: ,
,
где vx, vy, vz– составляющие скорости молекул по трем осям координат. Из-за хаотичности молекулярного движения можно считать, что средние значения кинетических энергий по трем направлениям равны друг другу:
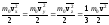 .
(1)
.
(1)
Так как согласно
основному уравнению кинетической теории
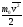
 ,
,
то каждое из трех слагаемых равенства (1) равно kT/2.
Разделение кинетической энергии частицы на три независимые составляющие связано с тем, что частица рассматривается как свободная материальная точка, обладающая тремя степенями свободы.
Число степеней свободы- наименьшее число линейно независимых координат, которые полностью определяют положение тела в пространстве. Значит, на каждую степень свободы одноатомной молекулы приходится энергия, равнаяkT/2. Естественно было предположить, что если бы молекула газа обладала еще какими-нибудь степенями свободы, то и на каждую их них пришлась бы кинетическая энергияkT/2. Действительно, в классической статистической физике такая теорема доказывается (Больцман):в совокупности большого числа молекул, находящемся в тепловом равновесии при температуре Т средняя кинетическая энергия равномерно распределена между всеми степенями свободы и для каждой степени свободы молекулы она равна kT/2.
Эта теорема называется законом равномерного распределения кинетической энергии по степеням свободы, или, законом равнораспределения.
Двух- и многоатомные газы отличаются от одноатомных числом степеней свободы. При низких температурах молекулы участвуют только в поступательном движении. По мере повышения Т молекулы начинают совершать и вращательные движения. И лишь при высоких температурах она совершает все три вида движения (добавляется колебательное). Степень свободы колебательного движения: iкол= 3N-5 (если атомы располагаются на одной прямой) илиiкол= 3N-6, гдеN– число атомов в молекуле.
Полное число
степеней свободы: 
|
Молекула |
iпост |
iвр |
iкол |
i |
|
Одноатомная |
3 |
- |
- |
3 |
|
Двухатомная с жесткой связью |
3 |
2 |
- |
5 |
|
Двухатомная с гибкой связью |
3 |
2 |
1 |
7 |
|
Трехатомная с жесткой связью |
3 |
3 |
- |
6 |
|
Трехатомная с гибкой связью |
3 |
3 |
3 4 |
12 14 |
