
Pod_red_prof_Nikonova_V_V_dots_Feskova_A_E_3
.pdf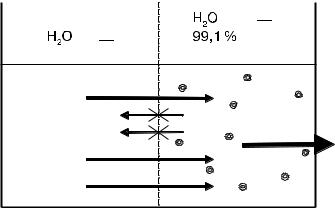
Водно-электролитный обмен |
81 |
|
|
Во всех рассматриваемых нами случаях в качестве растворителя будет выступать вода. Таким образом, вода движется оттуда, где ее больше (менее концентрированный раствор), туда, где ее меньше (более концентрированный раствор). Осмотические процессы происходят при наличии полупроницаемой мембраны, пропускающей только растворитель — воду. Полупроницаемость мембран обусловлена наличием в ней пор с определенными свойствами и размерами, благодаря чему молекулы с одними свойствами и размерами через нее проникают, а с другими — не проникают. При этом важны не только размеры молекул, но их физико-химические свойства, поэтому возможно, что более крупные молекулы пройдут через мембрану, а более мелкие — не пройдут. Поскольку практически все мембраны организма — полупроницаемые, осмотические процессы в нем определяют всю его жизнедеятельность.
Рисунок 2. Осмос (пояснения в тексте)
Для иллюстрации осмоса опишем несложный эксперимент (рис. 2). Возьмем сосуд с дистиллированной водой и разделим его полупроницаемой мембраной на 2 равные части. Естественно, это не вызовет никаких новых явлений в сосуде, так как по обе стороны мембраны имеется только растворитель. Растворим в какой-нибудь части сосуда какое-либо вещество (пусть для определенности это будет NaCl в физиологической концентрации 0,9 %). По обе стороны мембраны возникнет градиент концентраций имеющихся в сосуде веществ — воды и NaCl. Естественно предположить, что должно начаться спон-
82 |
Медицина неотложных состояний. Избранные клинические лекции. Том 4 |
|
|
танное перемешивание веществ, которое приведет к выравниванию концентраций в обеих половинах сосуда. Однако полупроницаемая мембрана не пропускает растворенное вещество, и оно не сможет двигаться из места с большей концентрацией туда, где его концентрация меньше (в нашем случае — нулевая). Поэтому двигаться сможет только вода — из места, где ее больше (100 % концентрация), в место, где ее меньше ( 99,1 %). До каких же пор будет происходить этот процесс? Эксперимент неопровержимо свидетельствует, что в конце концов движение воды прекратится, и нам нужно разобраться, почему. Для этого проведем следующие рассуждения.
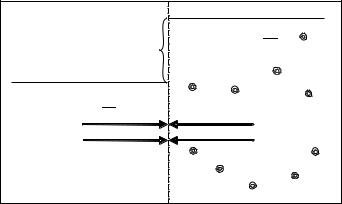
Поскольку вода движется, должна существовать некая сила, заставляющая ее двигаться. Когда же движение прекращается, это означает, что появляется другая, равная по величине и обратная по направлению сила, препятствующая продолжению движения. Что же это за сила? Обратимся к рис. 3.
ρgh |
H2O |
99,1 % |
|
H2O |
|
Рисунок 3. Осмос (пояснения в тексте) |
|
В процессе перемещения растворителя уровень жидкости в левой части рисунка понижается, а в правой — настолько же повышается. Это приводит к появлению разницы гидростатических давлений в обеих половинах сосуда, равной gh, где h — разность высот столбов жидкости в обеих частях сосуда. Когда h достигнет величины, обеспечивающей давление, равное и противоположно направленное давлению силы, движущей растворитель через мембрану, его движение прекратится. Величина этого давления равна осмотическому давлению раствора, находящегося в правой половине сосуда.

Водно-электролитный обмен |
83 |
|
|
Если бы мы захотели сразу воспрепятствовать перемещению растворителя через мембрану, нам было бы необходимо приложить к раствору (правая половина сосуда) давление, равное осмотическому давлению раствора (рис. 4).
H2O |
H2O |
|
99,1 % |
||
|
Рисунок 4. Осмос (пояснения в тексте)
Осмотическое давление раствора равно давлению, которое необходимо приложить к раствору, чтобы воспрепятствовать перемещению в него чистого растворителя.
Осмотическое давление можно определить и так:
это давление, под которым растворитель проникает в раствор через полупроницаемую мембрану.
Естественно, осмотическое давление обнаруживается только при наличии мембраны, проницаемой лишь для растворителя.
Как и любое давление, осмотическое давление можно измерять в
атмосферах, мм рт.ст., паскалях, мм вод.ст. и т.п. Однако не всегда эти единицы удобны. Так, осмотическое давление крови, выраженное в атмосферах, составляет в среднем 6,62 атм. (естественно, по закону изоосмолярности, такое же давление будет и в других секторах организма). Поэтому для выражения осмотического давления была избрана другая единица измерения. Перед тем как с ней познакомиться, опишем еще один эксперимент.

84 |
Медицина неотложных состояний. Избранные клинические лекции. Том 4 |
|
|
Возьмем опять наш сосуд, разделенный пополам полупроницаемой мембраной, в одной части которого остался физиологический раствор NaCl, и растворим в другой его части, например, глюкозу до 5,5 % (точнее — до 5,544 %) концентрации (рис. 5).
|
H2O — 94,5 % |
H2O |
|
|
|
||||
|
|
|
|||||||
|
C6H12O6 — 5,5 % |
99,1 % |
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рисунок 5. Осмос (пояснения в тексте)
Несмотря на различие концентраций веществ по обе стороны мембраны, движения растворителя (воды) не наблюдается, о чем неопровержимо свидетельствует эксперимент1. Отсутствие движения растворителя означает, что осмотические давления растворов по обе стороны мембраны равны, хотя их массовые концентрации и, следовательно, плотности, различны. Значит, такой способ выражения концентрации (как и объемные проценты) не отражает осмотического давления раствора.
1 Необходимо отметить, что примененный в этом случае способ выражения концентрации раствора определяет массовую часть растворенного вещества от массы всего раствора (массовые проценты). Чтобы посчитать массовые проценты, необходимо массу растворенного вещества разделить на массу всего раствора и выразить результат в процентах. Например, если в 1 мл воды растворили 1,5 г глюкозы, то масса раствора составит 2,5 г (1 мл воды имеет массу 1 г + 1,5 г глюкозы). 1,5 г (глюкозы) / 2,5 г (раствора) = 0,6 = 0,60 = 60 %. При растворении одной жидкости в другой можно пользоваться объемными процентами (об%) или градусами (°). Если в 100 мл водного раствора спирта его содержится 40 мл, то его объемная концентрация составит 40 об% (40°), а массовая — 31,6 % (плотность спирта меньше плотности воды и составляет 0,79 г/мл, тогда как плотность воды при нормальных условиях 1 г/мл).

Водно-электролитный обмен |
85 |
|
|
Уже давно различные физико-химические исследования растворов доказали, что осмотическое давление зависит исключительно от количества растворенных частиц (молекул, ионов) и не зависит от их свойств (размеров, массы, электрического заряда и т.п.). Значит, нам нужна единица, отражающая количество частиц. Такой единицей является моль. 1 моль какого-либо вещества имеет массу, выраженную в граммах, численно равную молекулярной массе вещества, которую можно узнать, заглянув в таблицу Менделеева.
Например, 1 моль углерода имеет массу 12 г, железа — 56 г, кислорода — 32 г (16 + 16, так как молекула O2 состоит из двух атомов). Чем тяжелее частица (молекула), тем тяжелее 1 моль вещества, сложенного из этих частиц (молекул). Но самое замечательное в этой единице то, что 1 моль любого вещества содержит одинаковое количество молекул, равное 6,02·1023 (число Авогадро). Отсюда ясно, что поскольку осмотическое давление раствора зависит от количества растворенных частиц, а это количество можно выразить количеством молей вещества, осмотическое давление можно (и это удобно!) выражать молярной концентрацией раствора (осмолярностью).
Единицей осмолярности служит моль/л, то есть количество молей вещества, растворенного в 1 л раствора. В медицине чаще всего удобнее пользоваться единицей ммоль/л (1 моль/л = 1000 ммоль/л). Иногда пользуются моляльной концентрацией (осмоляльность) — количеством молей (миллимолей) растворенного вещества в 1 кг растворителя (моль/кг или ммоль/кг). Однако поскольку в организме все рассматриваемые растворы водные и 1 л воды имеет массу 1 кг, а растворы слабоконцентрированные (среднее содержание воды в крови 92 %), то в водных растворах молярная и моляльная концентрация численно практически не отличаются друг от друга и разницей пренебрегают:
 осмоляльность
осмоляльность  осмоляльность
осмоляльность . 0,92
. 0,92
Осмотическое давление крови, выраженное в единицах молярной концентрации, составляет 300 ммоль/л с колебаниями от 285 до 310 ммоль/л. Эта величина имеет чрезвычайно важное значение, и организм стремится ее поддерживать в этих довольно узких пределах. Состояния, при которых осмолярность снижается, мы будем называть гипоосмолярными, а при которых повышается — гиперосмолярными. Осмолярность, как и огромное количество других показателей, должна быть объектом пристального внимания во время интенсивно-

86 |
Медицина неотложных состояний. Избранные клинические лекции. Том 4 |
|
|
го наблюдения. Ее можно измерять непосредственно осмометром, а можно оценить расчетным методом.
Принцип работы осмометра основан на следующем физическом факте. Количество растворенных частиц однозначно определяет не только осмотическое давление, но и температуру замерзания и кипения раствора. Чем выше осмолярность, тем ниже температура замерзания и выше температура кипения раствора. Осмометр измеряет температуру замерзания биологической жидкости, являющейся водным раствором. Эта температура всегда будет меньше 0 °C. Каждой температуре замерзания однозначно соответствует определенная молярная концентрация раствора, то есть его осмотическое давление (независимо от качественного состава раствора).
О том, как оценивается осмолярность с помощью расчетного метода, познакомимся в следующем разделе.
Осмолярность и состав водных секторов организма
Хотя осмолярность внутриклеточного и внеклеточного секторов практически одинакова, обусловлена она различными веществами. Поскольку для исследования более доступен внеклеточный сектор, его состав сначала и рассмотрим. В дальнейшем, если речь идет о водно-электролитном обмене без указания сектора, то по умолчанию имеется в виду внеклеточный сектор (такое соглашение связано именно с его доступностью для исследования). При рассмотрении внутриклеточного сектора необходимо уточнять, что речь идет именно о нем.
Состав внеклеточного сектора
Основной катион, обеспечивающий осмотическое давление внеклеточной жидкости, — Na+. Его концентрация составляет в среднем 142 ммоль/л (135–145 ммоль/л). Все ионы Na+ уравновешены эквивалентным количеством отрицательно заряженных ионов (анионов). Если анионы одновалентны, то для уравновешивания их потребуются те же 142 ммоль/л (двухвалентных — в 2 раза меньше, так как один анион уравновесит 2 катиона натрия). Основная часть анионов — одновалентные хлориды (Cl–), их концентрация составляет 103 ммоль/л. Из других анионов заметный вклад в осмотическое давление делает гидрокарбонат HCO3 — 24 ммоль/л. Кроме того, осмотическое давление во внеклеточном секторе определяется такими неэлектролитами, как глюкоза ( 5 ммоль/л), мочевина (до 8 ммоль/л). Подробнее состав внеклеточной жидкости представлен в табл. 1.

Водно-электролитный обмен |
87 |
||
|
|
|
|
|
Таблица 1. Состав внеклеточной жидкости |
||
|
|
|
|
|
Компонент |
Концентрация (ммоль/л) |
|
|
|
|
|
|
Na+ |
142 (135–145) |
|
|
K+ |
3–5 |
|
|
Ca2+ |
2,5 |
|
|
Mg2+ |
0,9 |
|
|
Cl– |
103 |
|
|
HCO3 |
24 |
|
|
HPO2– |
1 |
|
|
4 |
|
|
|
SO24– |
0,5 |
|
|
Мочевина |
До 8 |
|
|
|
|
|
|
Глюкоза |
До 5,5 |
|
|
|
|
|
|
Белки |
1,6 |
|
|
|
|
|
|
Органические кислоты |
5 |
|
|
|
|
|
|
Всего |
300 |
|
|
|
|
|
При отсутствии возможности измерить осмолярность непосредственно ее можно рассчитать, определив концентрации в плазме основных веществ, вносящих существенный вклад в осмотическое давление. Результаты расчетного метода могут служить лишь для приблизительной, ориентировочной оценки осмолярности, так как ошибка этого метода может достигать 20 %. Кроме того, состав внеклеточной жидкости в различных областях (плазма, интерстиций, лимфа и т.д.) несколько различен, и в целом плазма имеет несколько большее осмотическое давление, что обеспечивает постоянный ток жидкости из внеклеточного пространства в кровеносное русло и поддерживает объем циркулирующей крови (ОЦК).
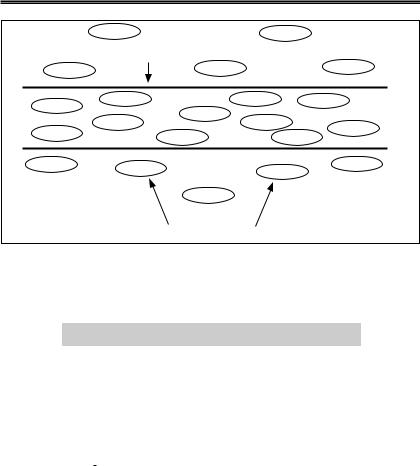
Весьма важной, хотя и малой, величиной является осмотическое давление, обеспечиваемое белками. Его называют онкотическим. Важность этой величины (несмотря на ее малость) обусловлена следующими обстоятельствами (рис. 6). Концентрация белка в плазме составляет 65–80 г/л, но поскольку молекулы белка весьма велики, то требуется небольшое их количество на каждый грамм белка, потому-то их молярная концентрация невелика (около 1,6 ммоль/л из 300 ммоль/л в плазме, или 25 мм рт.ст.
88 |
Медицина неотложных состояний. Избранные клинические лекции. Том 4 |
|
|
из 6,62 атм.). Концентрация же белка в интерстиции примерно в 2 раза меньше — 0,8 ммоль/л. Из-за больших размеров молекулы белка не могут проникать через неповрежденную сосудистую стенку, поэтому эта разница сохраняется. Другие же растворенные в плазме вещества (главным образом электролиты, глюкоза, мочевина) легко проникают через сосудистую стенку, и, следовательно, их концентрации в плазме и интерстиции практически одинаковы и они не создают разницы осмотических давлений. Таким образом, осмотическое давление плазмы крови постоянно несколько выше (на 0,8 ммоль/л), чем интерстициальной жидкости. Это один из важных механизмов поддержания ОЦК. Хорошо известно, что при выраженной гипопротеинемии (например, алиментарной) развиваются отеки, и связано это с тем, что жидкость плохо удерживается в сосудистом русле и уходит в интерстициальное пространство. Введение таким больным большого количества безбелковой изоосмолярной жидкости приводит только к усилению отеков без заметного увеличения ОЦК.
Если мы определим лабораторным путем молярные концентрации основных веществ, определяющих осмотическое давление внеклеточной жидкости, то сложив их, мы сможем грубо (с точностью до 20 %) оценить осмолярность плазмы. Одна из формул для расчета осмолярности плазмы выглядит следующим образом (А.П. Зильбер):
[плазма] = 1,86 · ([Na+] + [K+]) + [глюкоза] + [мочевина] + 4,
где квадратные скобки означают концентрацию вещества, указанного в них.
Состав внутриклеточного сектора
Основной внутриклеточный катион — K+, его концентрация в разных типах клеток весьма вариабельна и может составлять от 80 ммоль/л в эритроцитах до 160 ммоль/л в лейкоцитах и кардиомиоцитах (во внеклеточном секторе — 3–5 ммоль/л). Натрия же в клетке всего 20 ммоль/л (вне клетки — 142 ммоль/л). В отличие от внеклеточного пространства, где основной анион — Cl–, в клетке основными анионами являются фосфаты и сульфаты (соответственно 40 и 10 ммоль/л), хлоридов же всего 6 ммоль/л. Концентрации мочевины и глюкозы в обоих секторах практически одинаковы, так как эти вещества легко проникают через клеточную мембрану.
Водно-электролитный обмен |
89 |
0,8 ммоль/л |
|
1,6 – 0,8 = 0,8 ммоль/л |
|
1,6 ммоль/л |
|
Молекулы белка |
|
Рисунок 6. Онкотическое давление (пояснения в тексте) |
|
Подробнее состав внутриклеточного сектора отображен в табл. 2.
Таблица 2. Состав внутриклеточной жидкости
Компонент |
Концентрация (ммоль/л) |
|
|
K+ |
80–160 |
|
|
Na+ |
20 |
|
|
Ca2+ |
– |
|
|
Mg2+ |
17,5 |
|
|
Cl– |
6 |
|
|
HCO3 |
14 |
|
|
HPO24– |
40 |
|
|
SO24– |
10 |
|
|
Мочевина |
До 8 |
|
|
Глюкоза |
До 5,5 |
|
|
Белки |
3,8 |
|
|
Органические кислоты |
20 |
|
|
Всего |
300 |
|
|
90 |
Медицина неотложных состояний. Избранные клинические лекции. Том 4 |
|
|
Физиологическое значение некоторых электролитов
Натрий. Основной катион внеклеточного пространства. Общее содержание натрия в организме составляет 60 ммоль/кг массы тела, а потребность в нем — 1–2 ммоль/кг·сут. Концентрация в плазме колеблется от 135 до 145 ммоль/л, в эритроцитах — 15,6–34,8, лейкоцитах — 38, миоцитах — 16–24 ммоль/л. Натрий на 46 % определяет осмотическое давление внеклеточной жидкости. Натрий повышает возбудимость симпатических нервных окончаний и вместе с кальцием повышает сосудистый тонус, что может играть определенную роль в патогенезе гипертонической болезни. Натрий участвует в генерации потенциала действия, в поддержании КОС и тесно связан с водным обменом. Основной путь выведения натрия — почечный (1,7 ммоль/кг·сут). С потом выводится 1,5 ммоль/кг·сут, с калом — 0,1 ммоль/кг·сут. Естественно, у здоровых общее количество выводимого натрия равно его потребляемому количеству.
Калий. Основной катион внутриклеточного пространства. Общее содержание калия в организме составляет 54 ммоль/кг массы тела, а потребность в нем — 0,5–1,2 ммоль/кг·сут. Концентрация в плазме колеблется от 3,5 до 5,0 ммоль/л. Во внутриклеточной жидкости содержится 98 % всего калия организма, в то время как во внеклеточной — только 2 %. Основное вместилище калия — печень и мышцы, в клетках которых его концентрация может достигать 150 ммоль/л; в эритроцитах его содержание составляет 80 ммоль/л. Для поддержания КОС очень важно поддержание концентрации калия во внутриклеточном секторе, так как в случае потери клеткой калия, по закону электронейтральности, в нее должны войти другие катионы, в том числе ионы водорода H+ (на каждые 3 вышедших иона K+ приходится 2 Na+ и 1 H+). Поскольку калий является внутриклеточным электролитом, по калиемии практически невозможно судить о его содержании в организме, то есть о калигистии. О методах оценки калигистии речь пойдет ниже (наиболее распространенным методом является метод балансов). До 90 % калия (75–150 ммоль/сут) выводится с мочой, с калом — не более 15 %.
Физиологическое значение калия огромно. Без него невозможен синтез белков, АТФ, гликогена. Он необходим для обеспечения потенциала покоя клеточных мембран, вместе с натрием и хлором формирует потенциал действия. Он также способствует активации ряда ферментов.
Магний. Общее содержание магния в организме составляет 14 ммоль/кг массы тела. Среднесуточная потребность в магнии нахо-
