
- •Перші моделі атома
- •2. Квантова теорія світла
- •Величин кванта енергії обчислюється за формулою (рівняння Планка)
- •3. Теорія будови атома Гідрогену н. Бора
- •6. Будова багатоелектронних атомів
- •7. Відомості про будову ядра
- •8. Ковалентний зв’язок
- •9. Метод валентних зв’язків. Теорія гібридізації
- •10. Полярність молекул і звязків. Диполі
- •Н сі о с о о
- •11. Метод молекулярних орбіталей
- •12. Іонний зв’язок
- •13. Металевий звязок
- •14. Види міжмолекулярної взаємодії
- •15. Водневий зв'язок
9. Метод валентних зв’язків. Теорія гібридізації
Метод був розроблений на основі квантово–механічних розрахунків молекули водню В. Гейтлером і Ф. Лондоном у 1928 році. Потім значний вклад в його розвиток внести Л. Полінг і Д. Слейтер. Основні положення методу такі.
1. Молекула побудована з атомів, які в деякій мірі зберігають свою індивідуальність. В утворенні звязку беруть участь тільки електрони зовнішньої оболонки (валентні електрони).
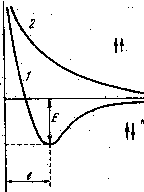
2. З точки зору квантової механіки при утворенні хімічного звязку між атомами їх електронні орбіталі перекриваються. Як показали розрахунки, це можливо, якщо взаємодіють атоми, електрони яких мають антипаралельні спіни – при цьому збільшується максимум електронної густини на 15...20 %, який сконцентрований між двома атомами, що призводить до зменшення загальної енергії системи. Якщо наближуються атоми, електрони яких мають паралельні спіни, максимум густини утворюється за ядрами атомів і зв’язку не виникає. Таким чином, в основі МВЗ лежить утворення двох електронного, двох центрового звязку.
Між
атомами, що утворюють звязок,
діють два типи сил: сили відштовхування
між електронами взаємодіючих атомів і
між ядрами цих атомів, а також сили
притяжіння між ядрами і електронами.
Спочатку, на великих відстанях, при
безкінечно великій відстані r,
енергія взаємодії Е
=
0, тобто частинки не взаємодіють. При
зменшенні r
енергія
монотонно знижу-ється до тих пір, доки
не буде досягнутий мінімум Е0
на відстані r0,
коли сили притягання і відштовхування
врівноважуються і енергія системи буде
мінімальною. При подальшому зближенні
сили відштовхування різко з ростають
і з ними зростає потенційна енергія (
рис.3)
ростають
і з ними зростає потенційна енергія (
рис.3)
Е
 3.
Ковалентний зв’язок напрямлений у бік
найбільшого перекривання електронних
хмар атомів, які взаємодіють.
3.
Ковалентний зв’язок напрямлений у бік
найбільшого перекривання електронних
хмар атомів, які взаємодіють.
В методі ВЗ використовується спінова валентність елемента, яка визначається числом неспарених електронів у атомах в нормальному або збудженому стані, що розташовані на валентній r r оболонці. Це поняття детальніше розглянуто в розділі "Періодичні властивості".
Число ковалентних зв’язків, які утворює атом, називається ковалентністю. В загальному випадку ковалентність визначається кількістю електронних орбіталей, які приймають участь в утворенні ковалентного звязку.
Теорія гибридізації
Дуже часто атом утворює зв’язки за рахунок електронів різних енергетичних підрівнів, що повинно призводити до утворення нерівноцінних звязків. Але дослід показує, що такі зв’язки рівноцінні. Наприклад, атом Ве у збудженому стані утворює два рівноцінні зв’язки за участю своїх s- та р-електронів:
 [Be]
= 1s22s2
[Be*] = 1s22s12p1.
[Be]
= 1s22s2
[Be*] = 1s22s12p1.
Рівноцінність хімічних зв’язків можна пояснити, використовуючи уявлення про гібридізацію, теоретичні основі якої запропонував Полінг. Гібридізацією називається квантово-механічне змішування певної кількості вихідних атомних орбіталей одного атома з різними енергіями, формами і розташуванням у просторі, що призводить до утворення тієї ж кількості орбіталей однакової форми і енергії, симетрично розташованих у просторі. Отже, при гібридізації зовнішних орбіталей відбувається іх змішування і вирівнювання за формою і енергією. Гібридізація енергетично вигідна, тому що енергія, яка витрачається при перерозподілі електронної густини атома компенсується утворенням більш міцних звязків.
Розглянемо деякі типи гібридізації.
Комбінація s- і р-орбіталей призводить до утворення двох гібридних хмар, розташованих під кутом 180. Це зумовлює лінійну конфігурацію молекул. Наприклад, при утворенні молекули ВеН2 відбувається sp-гібридізація атома Ве і молекула має лінійну конфігурацію (ядра усіх атомів знаходяться на одній вісі):
Аналогічно можливо вважати, що у Бора при збудженні відбувається гібридізація одної s- і двох р-орбіталей – sр2-гібридізація. Ці орбіталі розташовані у одній площині під кутом 120. Очевидно, що й зв’язки у молекулах, де центральним атомом є Бор теж будуть так орієнтовані, тобто молекула матиме форму трикутника. Така гібридізація спостерігається, наприклад, при утворенні молекули ВН3.
Коли відбувається гібридизація однієї s-орбіталі і трьох р-орбіталей, виникають sр3-гібридізовані хмари, які утворють тетраедричну конфігурацію (кут складає 10929). Такий стан реалізується в молекулі метану (рис.4).
Починаючи з третього періода в утворенні гібридних орбіталей можуть приймати участь також d-орбіталі. При цьому утворюються різні, більш складні стереохімічні конфігурації. Серед них найбільш поширені sp3d2 (октаедрична конфігурація) та sp3d (пірамідальна конфігурація).
Отже, теорія гідбидізації дозволила пояснити рівноцінність звязків в молекулах, їх розташування у просторі і геометричну конфігурацію молекул.
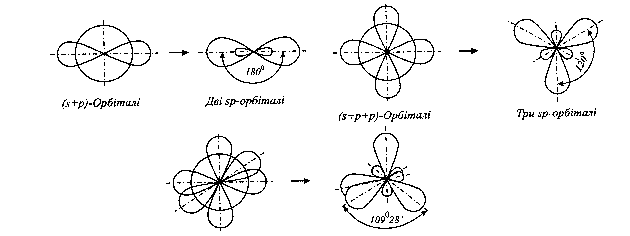 (s+p+p+p)-Орбіталі
Чотири sр-орбіталі
(s+p+p+p)-Орбіталі
Чотири sр-орбіталі
Рис.4 Утворення гібридних sp-, sp2, sp3-орбіталей
Локалізований і нелокалізований звязок
До цього часу ми розглядали молекули, у яких атом зв'язаний з іншими атомами одною чи декількома електронними парами (в останньому випадку зв'язок називається кратним). Таким чином, електронні пари, що забезпечують зв'язок, локалізовані в просторі між двома ядрами атомів. Такий хімічний зв'язок вважають локалізованим. Дослідження властивостей - і -зв'язків показало, що завжди локалізованими є тільки -зв'язки.
У -зв'язках може мати місце делокалізація. Хімічний зв'язок, при якій спільна електронна пара одночасно належить більш ніж двом атомним ядрам називають делокалізованим. Делокалізація електронних пар спостерігається в молекулах багатьох органічних і неорганічних сполук (молекулах бензену, НNO3, іонах NO3−, СО32−, SO42−, Р043− і ін.). Як приклад розглянемо будову іона СО32−.
Центральний атом утворює у даному випадку три однакових -зв'язки з трьома атомами Оксигену за рахунок своїх валентних неспарених електронів на гібридних sp2-орбіталях. За рахунок четвертого неспареного електрона на р-орбіталі атом Карбону утворює з одним з атомів кисню -зв'язок.
Така структура СО32− з локалізованим -зв'язком суперечить експеримен-тальним даним, що показують, що всі зв'язки С–О рівноцінні (характеризуються рівною довжиною й енергією). Для пояснення цього протиріччя в методі валентних зв'язків було введене уявлення про так звані резонансні структури, у яких цей зв'язок делокализован по всіх трьох атомах Оксигену. Делокалізацию зображують пунктирними лініями:
 О
О 2–
О
О 2–
С
О
За допомогою теорії резонансу метод валентних зв'язків добре описує структуру багатьох складних молекул. Однак громіздкість математичного апарату не дозволяє його широко використувати.
