
- •Перші моделі атома
- •2. Квантова теорія світла
- •Величин кванта енергії обчислюється за формулою (рівняння Планка)
- •3. Теорія будови атома Гідрогену н. Бора
- •6. Будова багатоелектронних атомів
- •7. Відомості про будову ядра
- •8. Ковалентний зв’язок
- •9. Метод валентних зв’язків. Теорія гібридізації
- •10. Полярність молекул і звязків. Диполі
- •Н сі о с о о
- •11. Метод молекулярних орбіталей
- •12. Іонний зв’язок
- •13. Металевий звязок
- •14. Види міжмолекулярної взаємодії
- •15. Водневий зв'язок
7. Відомості про будову ядра
Англійський фізик Чедвік (1932) встановив, що є промені, які уявляють собою потік електронейтральних часток. Згодом їх назвали нейтронами. На основі ретельного вивчення ядерних реакцій німецький фізик В. Гейзенберг в 1932 р. і одночасно радянські фізики Д. Д. Іваненко і Е. П. Гапон запропонували протонно-нейтронну теорію будови атомного ядра. Згідно з цією теорією, атомні ядра складаються з протонів та нейтронів. Ці частини обєднують під загальною назвою нуклони, їх маса приблизно однакова і дорівнює 1 а. о. м.
Оскільки практично вся маса атома зосереджена в ядрі, можна вважати, що масове число А дорівнює сумі протонів N(р) і нейтронів N(n): А = N(р) + N(n).
Звідси число нейтронів в ядрі можна розрахувати як різницю між масовим числом і числом протонів: N(n) = А – N(р). Наприклад, атоми Гідрогену (порядковий номер 1) мають масові числа 1, 2, 3 і називаються відповідно Протій, Дейтерій і Тритій. Ядра цих атомів містять однакову кількість протонів, але різну кількість нейтронів. Ядра Протію складаються тільки з 1 протона, ядра Дейтерію – з 1 протона і 1 нейтрона, ядра Тритію – з 1 протона і 2 нейтронів. Атоми, що мають однаковий заряд ядра, але різні масові числа, називаються ізотопами. У Періодичній системі елементів Д. І. Менделеєва атомна маса елемента вказується як середня величина масових чисел всіх його ізотопів, узятих в відсотковому відношенні, що відповідає їх поширеності в природі. Атоми різних ізотопів одного і того ж хімічного елемента з різною кількостю нейтронів мають однакову будову електронної оболонки, тому хімічні та більшість фізичних властивостей ізотопів майже однакові. Ізотопи займають одне і те ж місце в Періодичній системі.
8. Ковалентний зв’язок
При взаємодії атомів між ними може виникати хімічний звя’зок, що приводить до утворення стійкої багатоатомної системи − молекули, молекулярного іона, кристала.
Поняття про хімічний зв’язок є одним з основних у сучасній хімії. Хімічний зв’язок – це взаємодія атомів, яка зумовлена перекриванням їх електронних хмар і яка супроводжується зменшенням загальної енергії системи.
Експериментальні дані свідчать, що існують три основних типи хімічних зв’язків – ковалентний, іонний та металічний, кожний з яких має певні характеристики.
Ковалентний зв’язок є універсальним та найпоширеним типом хімічного зв’язку, характерним для неорганічних та органічних сполук.
Механізми утворення
Сучасні погляди на утворення ковалентного звязку базуються на теорії Льюіса–Ленгмюра, згідно за якою ковалентний зв’язок виникає в результатї утворення однієї або декількох спільних електронних пар (усуспільнення електронів), що призводить до утворення атомами стійких електронних конфігурацій s2 або s2p6. Це усуспільнення може відбуватися за обмінним і донорно–акцепторним механізмами.
При реалізації обмінного механізму кожний з взаємодіючих атомів віддає на утворення звязку певну кількість електронів:
 Н
.
+ .
Н
Н :
Н, або Н – Н (оболонка 1s2)
Н
.
+ .
Н
Н :
Н, або Н – Н (оболонка 1s2)
CІ . + . СІ СІ :СІ, або СІ – СІ (оболонка 2s22p6)
О: + :О О : : О, або О = О (оболонка 2s22p6)
.N: + :N. N : : : N або N N (оболонка 2s22p6)
Аналогічно можуть бути зображені інші взаємодії між атомами.
Ковалентний зв’язок може також виникати, коли один з атомів має вільну електронну орбіталь, яка заповнюється неподільною електронною парою другого атома. Такий механізм утворення називається донорно–акцепторним (дативним, координаційним) і відповідно таку ж назву має і звязок. Частинка, яка віддає електрони у спільне користування називається донором, а атом чи молекула, яка приймає електронну пару називається акцептором. Цей механізм утворення ковалентного зв’язку відбувається, наприклад, у іоні амонію:



 Н
Н +
Н
Н +



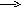 Н
– N: + Н+
Н – N – Н
Н
– N: + Н+
Н – N – Н
Н Н
В молекулі амоніаку Нітроген має неподільну пару електронів, а у іона Гідрогену є вакантна орбіталь. Отже, при наближенні цих частинок електронна пара притягує до себе протон і стає спільною для обох атомів. В утвореному іоні амонію всі чотири зв’язки рівноцінні і не розрізняються один від іншого незважаючи на те, що механізми їх утворення різні. Заряд протона, який приєднався до молекули амоніаку, делокалізований між всіма атомами.
Види перекривання електронних хмар
Існують два види перекривання електронних хмар. При взаємодії s-s –, s-p – і p-p– орбіталей найбільше перекривання може відбуватися поблизу прямої, яка звязує центри атомів. Такий зв’язок називається -звя’зком. При взаємодії p-p–, p-d–орбіталей, оріентованих перпендикулярно до осі зв’язку, утворюється не одна, а дві області перекривання, розмішені з обох боків від цієї осі. Такий зв’язок називається -зв’язком (див. рис.1.).
-зв’язок -зв’язок
Рис. 1. Приклади - та -зв’язків
Характеристики хімічного зв’язку
Х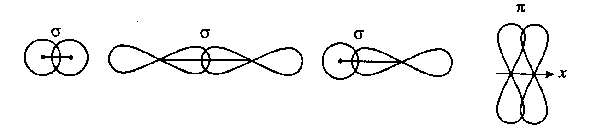 імічний
зв’язок характеризується, насамперед,
енергією і довжиною. Якщо молекула
складається з більше, ніж двох атомів
з ковалентним зв’язком між ними, до цих
параметрів додається ще валентний кут.
імічний
зв’язок характеризується, насамперед,
енергією і довжиною. Якщо молекула
складається з більше, ніж двох атомів
з ковалентним зв’язком між ними, до цих
параметрів додається ще валентний кут.
Енергією зв’язку називається енергія, яка поглинається при розриві або виділяється при утворенні зв’язку між атомами. Ця енергія є мірою його міцності. Вона визначається з термодинамічних характеристик (теплоти утворення з атомів).
Для молекул з різними зв’язками найчастіше використовується так звана "середня енергія зв’язку" – енергія, яка необхідна для розриву зв’язків при умові, що всі вони в молекулі розриваються одночасно. Вона визначається з термохімічних вимірювань та з спектральних даних і наводиться у довідкових таблицях.
Довжиною зв’язку називається відстань між двома центрами ядер атомів в молекулі, коли сили відштовхування зрівноважені силами притяжіння і енергія зв’язку мінімальна. Наприклад, довжина зв’язку С − Н в молекулі метана СН4 дорівнює 0,154 нм, а зв’язку О − Н в молекулі води Н2О − 0,096 нм.
В алентним
кутом
називається кут між двома осями симетрії
електронних орбіталей одного атома
при утворенні ними з орбіталями іншого
атома ковалентного зв’язку. Наприклад
у молекулі води валентний кут
дорівнює 104,5о
(рис.2):
алентним
кутом
називається кут між двома осями симетрії
електронних орбіталей одного атома
при утворенні ними з орбіталями іншого
атома ковалентного зв’язку. Наприклад
у молекулі води валентний кут
дорівнює 104,5о
(рис.2):
Рис.2. Схема молекули води
Властивості ковалентного звязку
Ковалентний звязок має ряд важливих властивостей, до яких відносяться насиченість і напрямленість.
Напрямленістю називається закономірний напрямок взаємодії електронних орбіталей у просторі у бік найбільшого перекривання електронної густини при утворенні зв’язку. Напрямленість і валентний кут взаємно пов’язані величини і залежать від природи реагуючих атомів, типу електронних орбіталей, які утворюють зв’язок, розмірів атомів і величин зарядів на них.
Ця властивість визначає геометричну конфігурацію молекул.
Насиченість проявляється у здатності атомів утворювати певну кількість ковалентних звязків. Це повязано з тим, що одна орбіталь може приймати участь в утворенні тільки одного ковалентного звязку. Така властивість визначає склад молекулярних хімічних сполук. Наприклад, при взаємодії атомів водню утворюється молекула Н2, а не Н3, тому що спін електрона третього атома обовязково буде паралельним спіну одного з спарених електронів. Здатність до утворення певної кількості звязків обмежується можливостями отримання максимального числа неспарених електронів на валентному енергетичному рівні.
Для пояснення природи і причин ковалентного зв’язку використовують наближені методи. Найбільше значення мають два з них – метод валентних зв’язків (МВЗ) і метод молекулярних орбіталей (ММО), які базуються на квантово-механічних розрахунках.
