
- •Перші моделі атома
- •2. Квантова теорія світла
- •Величин кванта енергії обчислюється за формулою (рівняння Планка)
- •3. Теорія будови атома Гідрогену н. Бора
- •6. Будова багатоелектронних атомів
- •7. Відомості про будову ядра
- •8. Ковалентний зв’язок
- •9. Метод валентних зв’язків. Теорія гібридізації
- •10. Полярність молекул і звязків. Диполі
- •Н сі о с о о
- •11. Метод молекулярних орбіталей
- •12. Іонний зв’язок
- •13. Металевий звязок
- •14. Види міжмолекулярної взаємодії
- •15. Водневий зв'язок
Зміст
Перші моделі атома.
Квантова теорія світла.
Теорія будови атома Н. Бора
Хвильова природа електрона. Електронні хмари.
Рівняння Шредінгера. Квантові числа.
Будова багатоелектронних атомів
Відомості про будову ядра
Ковалентний зв’язок
Метод валентних зв’язків. Теорія гібридізації
Полярність молекул і звязків. Диполі
Метод молекулярних орбіталей
Іонний звязок
Металевий звязок
Види міжмолекулярної взаємодії
Водневий зв’язок
Перші моделі атома
До кінця ХІХ сторіччя в хімії панувало метафізичне уявлення про атом. Вважали, що атом це найменша неподільна частина простої речовини.
У 1874 році ірландський фізик Джордж Джонсон
Стоней висловив думку про дискретність
електричного заряду, теоретично
обґрунтував і обчислив значення
елементарного заряду, для якого у 1891
році запропонував назву –електрон.
Остаточно існування електрона було
доведено англійським фізиком Дж. Дж.
Томсоном при відкритті та дослідженні
катодних променів, які являють собою
потік електронів. Було визначено
відношення заряду електрона до його
маси. Катодне випромінювання утворюється
внаслідок проходження електричного
струму крізь розріджені гази. Його
відхилення у електромагнітному полі
показало, що це потік найдрібніших
частинок, які несуть найменший електричний
заряд. Було визначено заряд і масу
електронів ( 1,6 .10–19
Кл; 9,1·10–28
г) й доказано, що вони є складовими атомів
і можуть відриватись від них за певними
умовами. Експериментально заряд електрона
визначив американський фізик Роберт
Міллікен (1910). Маса
електрона приблизно в 2000 разів менше
маси атома водню (протону).
1874 році ірландський фізик Джордж Джонсон
Стоней висловив думку про дискретність
електричного заряду, теоретично
обґрунтував і обчислив значення
елементарного заряду, для якого у 1891
році запропонував назву –електрон.
Остаточно існування електрона було
доведено англійським фізиком Дж. Дж.
Томсоном при відкритті та дослідженні
катодних променів, які являють собою
потік електронів. Було визначено
відношення заряду електрона до його
маси. Катодне випромінювання утворюється
внаслідок проходження електричного
струму крізь розріджені гази. Його
відхилення у електромагнітному полі
показало, що це потік найдрібніших
частинок, які несуть найменший електричний
заряд. Було визначено заряд і масу
електронів ( 1,6 .10–19
Кл; 9,1·10–28
г) й доказано, що вони є складовими атомів
і можуть відриватись від них за певними
умовами. Експериментально заряд електрона
визначив американський фізик Роберт
Міллікен (1910). Маса
електрона приблизно в 2000 разів менше
маси атома водню (протону).
В елику
роль у встановленні складної природи
атомів відіграло відкриття і вивчення
радіоактивності. Дослідженнями у цій
галузі науки займалися французькі
вчені А.Беккерель і М. Склодовська-Кюрі.
Вивчаючи природу радіоактивного
випромінювання Е Резерфорд встановив,
що воно неоднорідне. Під дією
електромагнітного поля це випромінювання
розщеплюється на три пучки, один з яких
не змінює свого початкового напрямку
(-випромінювання,
потік коротких електромагнітних хвиль),
другий відхиляється до позитивного
полюсу магніту (-випромінювання,
потік електронів), а третій відхиляється
у бік негативного полюсу магніту
(-випромінювання,
потік ядер атомів гелію, 42Не).
елику
роль у встановленні складної природи
атомів відіграло відкриття і вивчення
радіоактивності. Дослідженнями у цій
галузі науки займалися французькі
вчені А.Беккерель і М. Склодовська-Кюрі.
Вивчаючи природу радіоактивного
випромінювання Е Резерфорд встановив,
що воно неоднорідне. Під дією
електромагнітного поля це випромінювання
розщеплюється на три пучки, один з яких
не змінює свого початкового напрямку
(-випромінювання,
потік коротких електромагнітних хвиль),
другий відхиляється до позитивного
полюсу магніту (-випромінювання,
потік електронів), а третій відхиляється
у бік негативного полюсу магніту
(-випромінювання,
потік ядер атомів гелію, 42Не).
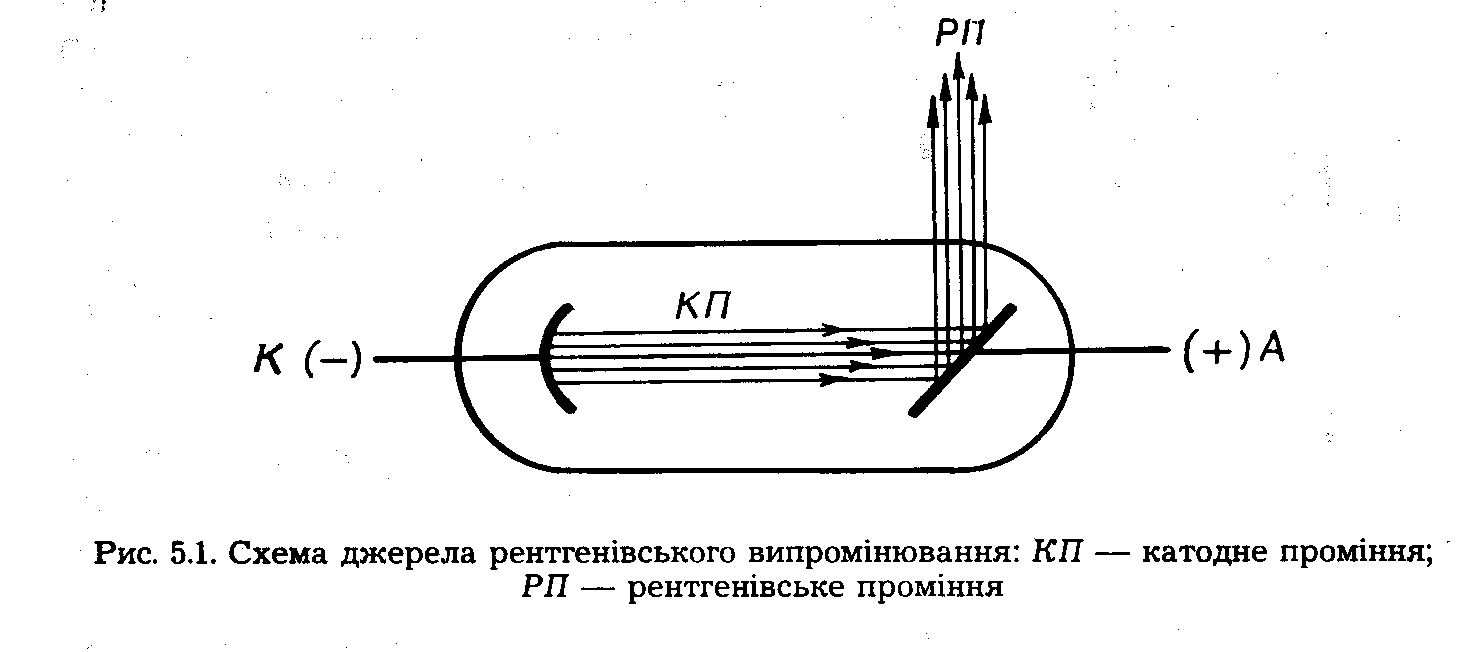
У 1895 році В. К. Рентген відкрив новий вид випромінювання, які назвав Х–променями (рентгенівське випромінювання). На відміну від катодного, воно не відхиляється в електромагнітному полі і є короткохвильовим випромінюванням з довжиною хвилі 0,06 – 2,0 нм, що виникає внаслідок раптового гальмування швидких електронів при зіткненні їх з атомами елементів. Воно виникає в рентгенівський трубці проти катода К, який є джерелом електронів. Анод А виготовлений з платини або вольфраму, на ньому нанесено шар речовини, що досліджується.
Передбачив природу та механізм виникнення Х-променів український вчений Іван Пулюй, який також один з перших наблизився до розуміння природи катодних променів як пучка електронів, а не своєрідних магнітних хвиль, як на той час вважали. Х-промені мають велику проникну здатність.
Першу модель будови атомів запропонував у 1903 році Д. Томсон. Згідно з його теорією, атом мав вигляд суцільної позитивно зарядженої сфери, у якій розміщені електрони. Ця модель була примітивною, але підкреслювала наявність позитивних і негативних частинок у ядрі.
Вперше експериментально обгрунтував модель атома Е. Резерфорд (1911). Його досліди полягали у вивченні розсіювання -частинок тоненькими металевими пластинками. Було встановлено, що більшість -частинок проникала крізь пластинки, не змінюючи напрямку руху; деякі з них відхилялися від прямолінійного шляху на невеликі кути і тільки окремі (1 частина з 106) були відки-нуті назад. Для пояснення цього явища вчений використав планетарну модель будови атома і припустив, що його маса майже повністю зосереджена у позитивно зарядженому ядрі. Завдяки цим роботам було встановлено, що заряди ядер збігаються з порядковим номером елемента у Періодичній системі.
До ідеї планетарної будови атома прийшов і російський вчений Морозов на початку 900-х років, але ці припущення не були підтверджені експериментами.
Згодом виявилося, що розмір ядра порядку 10-5 нм, тобто в 104 разів менший, ніж розмір атома (10-1 нм).
Основний недолік планетарної моделі полягав у тому, що вона суперечила класичній електродинаміці, згідно з якою електрони, обертаючись біля ядра, повинні були безперервно випромінювати енергію, що в кінці кінців привело б до припинення існування атома. Крім того, вона не пояснювала лінійчасті спектри атомів.
Виходячи з дослідів Резерфорда, його учень Чедвік в 1920 році довів, що заряд ядра чисельно дорівнює порядковому номеру елемента у Періодичній системі.
Поняття про атомні спектри. Якщо сонячний промінь пропустити крізь скляну або кварцеву призму, то він розкладається і на екрані, встановленому за призмою з’являється кольорова смуга, яка містить усі кольори райдуги у безперервній послідовності. Це пояснюється тим, що білий промінь складається з електромагнітних хвиль різної довжини, які при проходженні крізь призму неоднаково нею заломлюються і потрапляють на різні місця екрану. Такий спектр називається суцільним і його дають нагріти до високої температури тверді тіла або рідини.
Світло, яке випромінюється розжареним газом або паром складається з електромагнітних хвиль певної довжини, тому замість суцільної кольорової смуги з’являється ряд окремих кольорових ліній, розділених темними проміжками. Наприклад, у видимій частині спектра Гідрогену містяться п’ять ліній – червона, зелена, синя і дві фіолетові. Таки спектри називають лінійчатими, або атомними. Експериментально встановлено, що кожний елемент має свій певний атомний спектр.
