
- •Перші моделі атома
- •2. Квантова теорія світла
- •Величин кванта енергії обчислюється за формулою (рівняння Планка)
- •3. Теорія будови атома Гідрогену н. Бора
- •6. Будова багатоелектронних атомів
- •7. Відомості про будову ядра
- •8. Ковалентний зв’язок
- •9. Метод валентних зв’язків. Теорія гібридізації
- •10. Полярність молекул і звязків. Диполі
- •Н сі о с о о
- •11. Метод молекулярних орбіталей
- •12. Іонний зв’язок
- •13. Металевий звязок
- •14. Види міжмолекулярної взаємодії
- •15. Водневий зв'язок
6. Будова багатоелектронних атомів
В атомі Гідрогену електрон перебуває в силовому полі одного ядра. В багатоелектронних атомі на кожний електрон діє не тільки ядро, але і всі інші електрони. При цьому електронні хмари окремих електронів немов би зливаються в єдину загальну багатоелектронну хмару. Точне розв’язання рівняння Шредінгера для такої системи неможливе. Тому стан електронів в складних атомах визначається наближеним рішенням рівняння Шредінгера. В цьому припущенні рівняння Шредінгера вирішується окремо для кожного електрона в атомі, стан якого, як і в атомі, Гідрогену визначається значеннями чотирьох квантових чисел, з наступним обєднанням отриманих значень в загальну електронну формулу атому.
Заповнення електронної оболонки атомів здійснюється згідно наступних принципів і правил.
Принцип мінімуму енергії
Послідовність заповнення електронами рівней і подрівней здійснюється від підрівня з меншою енергією до підрівнів з більшою енергією так, щоб сумарна енергія атома залишалась мінімальною. У багатоелектронних атомах енергія електрона залежить не тільки від головного, але й від орбітального квантового числа. Головне квантове число визначає лише зону, в межах якої точне значення енергії електрона визначається величиною l. В результаті енергія зростає за енергетичними підрівнями в такому порядку:
ls<2s<2p<3s<3p<4s 3d<4p<5s 4d<5p<6s 5d 4f <6p і т. д.
Згідно з цим принципом використовується правило Клечковського: заповнення енергетичних рівней відбувається в порядку зростання суми чисел n + l, а при рівних значеннях n + l в порядку зростання n. Наприклад, у атомі Аргону завершується заповнення 3р-підрівня. При переході до наступного елемента Калію (Z = 19) виникає питання про першочерговість заповнення 4s- або 3d-підрівня. Оскільки для першого з них сума n + l дорівнює чотирьом (4 + 0), а для другого пяти (3 + 2), заповнюється 4s-підрівень.
Виключення з правила Клечковського спостерігаються для елементів, у яких для заповнення повністю або наполовину d- або f-підрівня необхіден лише один електрон. В такому випадку відбувається “проскок” одного з двох електронів зовнішнього s-підрівня на відповідну орбіталь d- або f-підрівня. Так, у атомі Сu електронній конфігурації [Ar]3d104s1 відповідає менша енергія, ніж конфігурації [Ar]3d94s2. (Порядок складання електронних формул буде розглянуто далі).
Принцип Паулі
На основі аналізу атомних спектрів і врахування положення елементів у періодичній системі в 1925 р. фізик Паулі сформулював принцип, який дав змогу визначити такі комбінації квантових чисел, які відповідають реальному розподілу електронів в атомах.
В атомах не може бути двох електронів з однаковим значенням всіх чотирьох квантових чисел. Суть принципу полягає у тому, що на кожній орбіталі, яка характеризується числами n, l i ml можна розташувати не більше ніж два електрони з антипаралельними спинами.
На основі цього принципу можна визначити максимальну кількість електронів на рівні (Nn) і підрівні (Nl).
Nn = 2n2; Nl = 2(2l + 1).
Так, два можливих електрони першого рівня характеризуються такими квантовими числами:
№ електрона n l ml s
1, 2
1 0 1 +![]() ,
–
,
–![]() .
.
Електрони третього рівня (всього їх може бути 19, Nn = 18) характеризуються такими квантовими числами:
№ електрона n l ml ms
1,2
1 0 (s)
1 +![]() ,
–
,
–![]()
3,4,5,6,7,8
2 1 (p)
–1, 0, +1 3·(+![]() ,
–
,
–![]() )
)
9 …18
3 2(d)
–2,–1, 0,+1,+2 5·(+![]() ,
–
,
–![]() ).
Наприклад,
електрони атома Берілію характерізуються
наступними значеннями квантових чисел:
).
Наприклад,
електрони атома Берілію характерізуються
наступними значеннями квантових чисел:
|
Ве(1s22s2) № електрона |
Квантове число | |||
|
n |
l |
ml |
ms | |
|
1 2 3 4 |
1 1 2 2 |
0 0 0 0 |
0 0 0 0 |
+1/2 1/2 +1/2 −1/2 |
Правило Хунда
Правило визначає порядок заповнення підрівней: сумарний спін електронів на підрівні повинен бути максимальним. Наприклад, в атомі Карбону будова електронної оболонки виражається формулою: [126С] 1s22s22р2; р-електро-ни другого підрівня можуть мати паралельні спіни (= 1/2 + 1/2 = 1) та антипаралельні спини (= 1/2 + (–1/2) = 0). Отже реалізується перша конфігурація, причому ці електрони знаходяться на різних орбіталях (див. розташування електронів по комірках далі).
Будову електронних оболонок атомів і іонів зображають електронними або електронно-графічними формулами. Електронна формула показує розподіл електронів в атомах по орбіталях (енергетичних рівнях) і підрівнях, де рівні позначають цифрами 1, 2, 3, 4,..., підрівні літерами s, р, d, f. Верхній правий індекс показує кількість електронів на підрівні.
Електронно-графічна формула зображує будову електронних оболонок (або їх окремих фрагментів) атому елемента у вигляді сукупності орбіталей або квантових комірок.
Наведемо декілька прикладів запису електронних і електронно-графічних формул:
[1Н ] 1s1; [2Не ] 1s2 ;

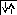
[4Ве ] 1s22s2; [ 6С] 1s22s2 2р2; [8O] 1s22s22р4;
2s 2p 2s 2p 2s 2p


[13 Al] 1s22s22р63s23p3; [18 Ar] 1s22s22р63s23p6;
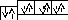
 3s
3p 3s 3p
3s
3p 3s 3p
[24Cr] – 1s22s22p63s23p63d54s1; [25Mn] – 1s22s22p63s23p63d54s2;
[80Нg]1s22s22р63s23p63d104s24p64d104f145s25p65d106s2.
Приклад 1. Написати схему розподілу електронів в атомі Хлору, його електронну і електронно-графічну формули.
Розвязання:
Хлор розташований в третьому періоді, отже, його атом має три енергетичних рівні. Він знаходиться в VII групі, головнїй підгрупі, тому число електронів на останньому рівні дорівнює семи. Число електронів на інших рівнях визначається по формулі N = 2n2, тобто 2 і 8. Отже, схема будови атома Хлора:
17Cl 2(n=1) 8(n=2) 7(n=3)
електронна формула Хлора: електронно-графічна формула:
[17Cl] – ls22s22p63s23p5, 3s 3p
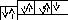
Приклад 2. Написати електронні формули атомів Хрому та Купруму. Поясніть розташування одного s-електрона на четвертому рівні.
Розвязання:
У елементів четвертого періоду Хрому (Z = 24) і Купруму (Z = 29), атоми яких мають по чотири електронні шари, відбувається починаючи з Sc заповнення 3d –подрівня. Згідно з тим, що більш енергетично вигідним для атома є умова мати повністю або напівзаповнений d-підрівень, відбувається "проскок" одного з 4s-електронів на незавершений 3d-підрівень. (згідно з виключенням з правилу Клечковського). Електронні формули будуть мати вигляд
[Cr] – 1s22s22p63s23p63d54s1 [Сu] – ls22s22p63s23p63d104s1.
