
- •Третичная структура белка
- •Структура глобулярных белков
- •Стабилизация пространственной структуры белка
- •Bovine Pancreatic Trypsin Inhibitor (BPTI) - 58 ак
- •Bovine Pancreatic Trypsin Inhibitor (BPTI) - 58 ак
- •Классификация пространственных структур - α/β белки
- •Соотношение между первичной и пространственной структурами белка
- •Доменная структура белков
- •Протяженная структура, формируемая серией линейно расположенных белковых модулей
- •Четвертичная структура белка
- •Стехиометрия и геометрия четвертичной структуры
- •Четвертичная структура лактатдегидрогеназы (ЛДГ)
- •Стабилизация четвертичной структуры белка
- •Способы изучения четвертичной структуры
- •Функциональное значение четвертичной структуры белка
- •Иерархия структурной организации белков
- •Морфины (Morpheeins)
- •Примеры октамерной и гексамерной форм порфобилиногенсинтазы
- •Регуляция активности ПБС с помощью формирования различных морфиновых ансамблей
- •Функции белков (1)
- •Функции белков (2)
- •Функции белков (3)
Способы изучения четвертичной структуры
•Метод рентгеноструктурного анализа;
•Метод ядерно-магнитного резонанса.
•Мягкая диссоциация четвертичной структуры
(слабые кислоты, мочевина, гуанидинхлорид; например, гемоглобин диссоциирует в слабых кислотах α2β2Æ 2αβ),
изучение структуры мономеров
• Жесткая денатурация молекулы с помощью
додецилсульфата натрия, определение молекулярной массы мономеров (седиментационный анализ, гельфильтрация, SDS-электрофорез)
Функциональное значение четвертичной структуры белка
1. Объединение нескольких взаимосвязанных функций в одной структуре (РНК-полимераза,
многие полиферментные комплексы);
2. Архитектурная функция (24 субъединицы ферритина
формируют полость для хранения оксида железа);
3. Обеспечение множественных взаимодействий белка с протяженными структурами (Ig,
некоторые ДНК-связывающие белки);
4. Регуляторная функция (В основе лежит способность
передавать структурные перестройки одной субъединицы на другие - глобины, G-белки).

Иерархия структурной организации белков
Первичная структура
(аминокислотная последовательность)
Вторичная структура
Супервторичная структура
Домены
Третичная структура
(основа функционирования любого белка)
Четвертичная структура
(ансамбль субъединиц)
Cупервторичная, доменная и четвертичная структуры могут не 27
присутствовать в некоторых белках (не подчеркнуты).
Морфины (Morpheeins)
•Термин морфин (от английского «to morph» – изменять форму, трансформироваться, превращаться) был предложен для описания альтернативных ансамблей четвертичной структуры одного и того же белка, которые обладают различными функциональными характеристиками (Eileen Jaffe, Fox Chase Cancer Center, Philadelphia).
•Морфины заданного белка имеют одинаковую аминокислотную последовательность и при этом отличаются по вторичной и третичной структуре, что в свою очередь определяет различную четверичную структуру.
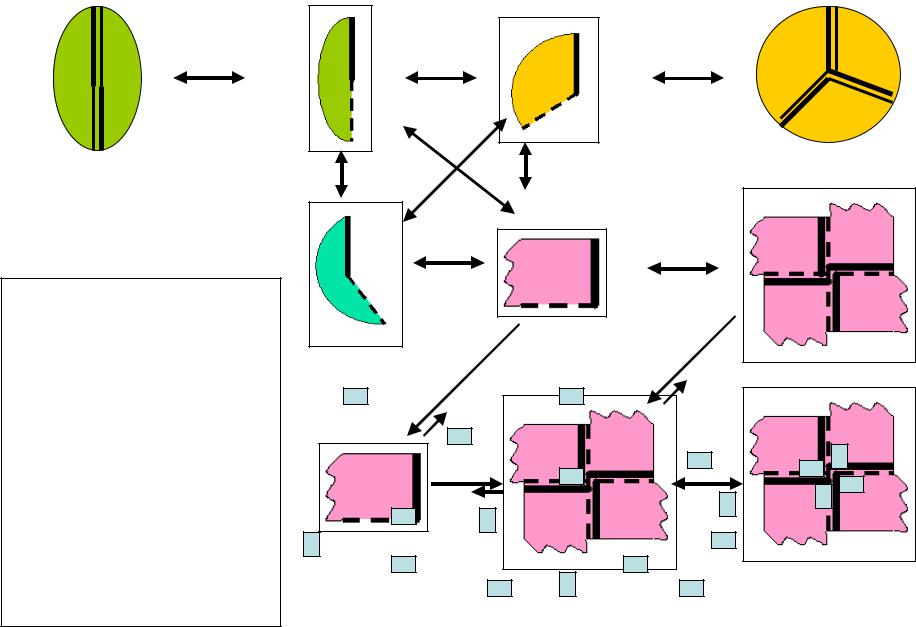
Схема формирования морфиновых ансамблей
Субъединица, образующая димер
B
Субъединица не образует олигомеров
A
Если разные морфиновые формы одного белка обладают разной
функциональной активностью, изменение олигомерного
состояния ансамбля может являться основой  аллостерической регуляции.
аллостерической регуляции.
Субъединица, образующая тример
C
Субъединица, образующая тетрамер
D
29
Jaffe E.K.,2005
Единственно доказанным на данный момент белком с морфиновой природой является фермент порфобилиногенсинтаза (ПБС)
(8-Аминолевулинатдегидратаза, КФ 4.2.1.24)
•ПБС катализирует уникальную реакцию ассиметричной конденсации двух молекул δ–аминолевулиновой кислоты с образованием порфобилиногена.
•Эта реакция является первой общей реакцией в биосинтезе тетрапирролов – молекул, необходимых для клеточного дыхания и фотосинтеза (гем, хлорофилл, витамин В12).
•Охарактеризованы морфиновые формы ПБС из следующих организмов: человека, Escherihia coli, Pseudomonas aeruginosa, Vibrio cholerae, Pisum savitum.
