
МОЛБИОЛ 2014-лекции / ОГК / Л6-Шапероны-2
.pdfУчастие молекулярных шаперонов в сборке белков II
Лекция 6
2014 г.
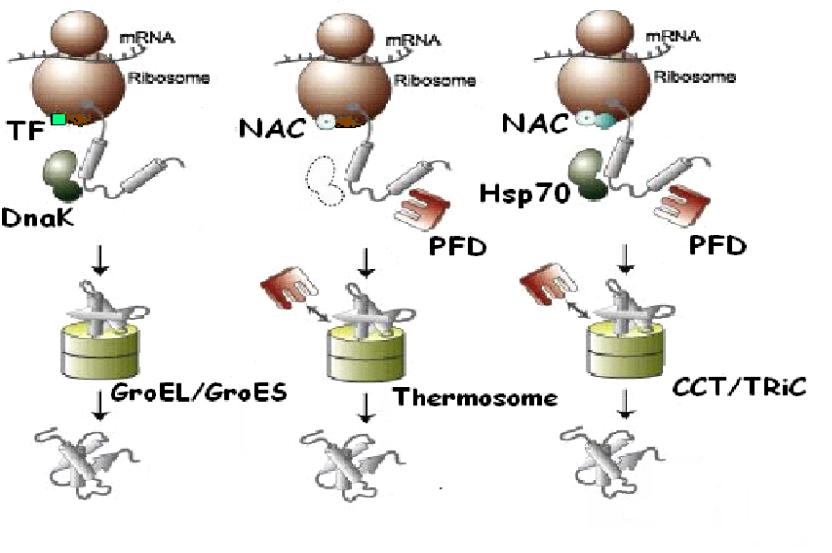
Сборка белков в цитозоле
Бактерии |
Архебактерии |
Эукариоты |
|
|
|
|
|
|

Семейство Hsp60 (Шаперонины) |
|
|
||
|
|
|
||
Подсемейство GroE (Группа I) |
|
|
||
|
|
|
|
|
Локализация |
Шапероны |
Роль |
|
|
|
|
|
|
|
Цитозоль |
GroEL/GroES |
Фолдинг белков; необходим для |
|
|
эубактерий |
|
сборки фагов. |
|
|
|
|
|
|
|
Митохондрии/ |
Hsp60/10 |
Фолдинг белков (в хлоропластах - |
|
|
Хлоропласты |
Cpn60/10 |
необходим для сборки |
|
|
рибулозобисфосфат- |
|
|||
|
|
|
||
|
|
карбоксилазы/оксигеназы, |
|
|
|
|
Rubisco). |
|
|
|
|
|
|
|
Подсемейство TCP-1 (Группа II) |
|
|||
|
|
|
|
|
Цитозоль |
TF55 |
Фолдинг белков, связывание с |
|
|
архебактерий |
Thermosome |
денатурированными белками и |
|
|
предотвращение агрегации. |
|
|||
|
|
|
||
|
|
|
|
|
Цитозоль эукариот |
CCT или TriС |
Фолдинг белков в цитозоле |
|
|
эукариот (актин, тубулин). |
|
|||
|
|
|
|
|
Среди всех шаперонинов лучше всего изучено строение и функционирование системы GroEL/GroES
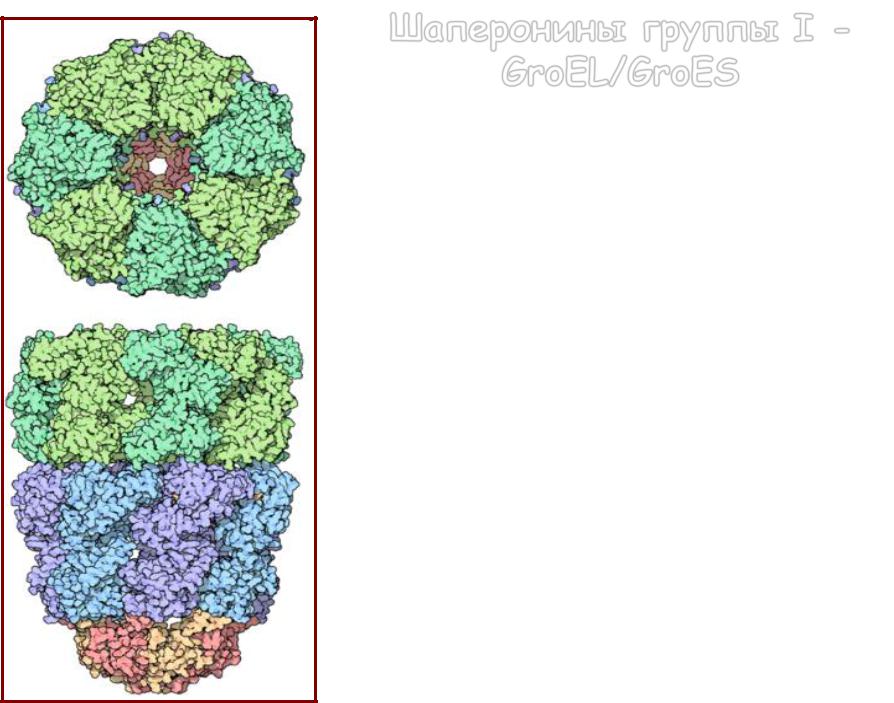
Шаперонины группы I -
GroEL/GroES
•Шаперонин GroEL является необходимым для выживания клеток;
•GroEL формирует гомоолигомерный тороидальный комплекс;
•Для функционирования GroEL необходим кофактор GroES;
•Система GroEL/GroES в бактериях принимает участие в фолдинге
10-15% белков;
•Большинство белков, взаимодействующих с GroEL, имеют М.м. 20-60 кДа;
•Многие субстраты GroEL имеют сходную доменную структуру, с α+β и α/β доменами, обладающими большими гидрофобными поверхностями;
•Для функционирования GroEL/GroES необходим гидролиз АТФ.
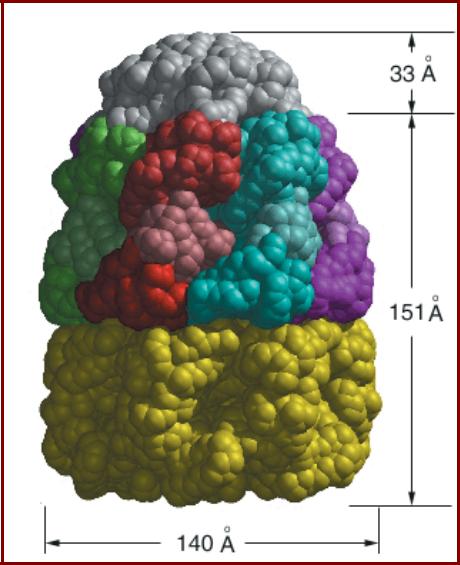
Структура комплекса GroEL/GroES (E=E.coli)
GroEL (L=Large)
Состоит из двух семичленных колец, лежащих одно под другим,
содержит 14 идентичных субъединиц (57kD).
GroES (S=Small)
Состоит из одного куполообразного семичленного кольца;
7 идентичных субъединиц (10kD), формируют
«шапочку».
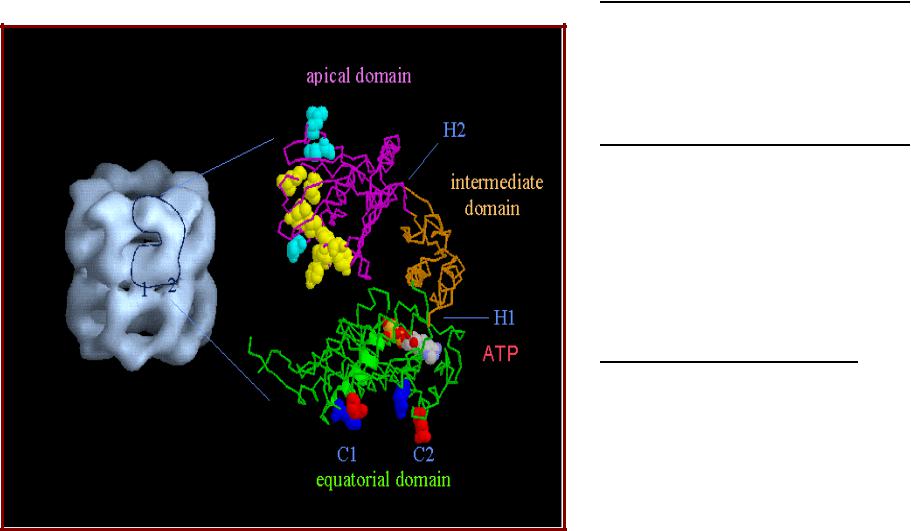
Структура субъединицы
GroEL
Субъединица GroEL состоит из трех доменов:
•Экваториальный домен
-образует два контакта (C1, C2) с аналогичным доменом на втором кольце;
-связывает АТФ;
•Промежуточный домен
-является гибким шарниром,
-два шарнирных участка (H1, H2) определяют изменение положения апикального домена при функционировании;
•Апикальный домен
-связывает полипептид; сайт связывания содержит в основном крупные гидрофобные ак (показаны желтым),
-связывает GroES (ак остатки показаны голубым).
Ranson et al., 1998
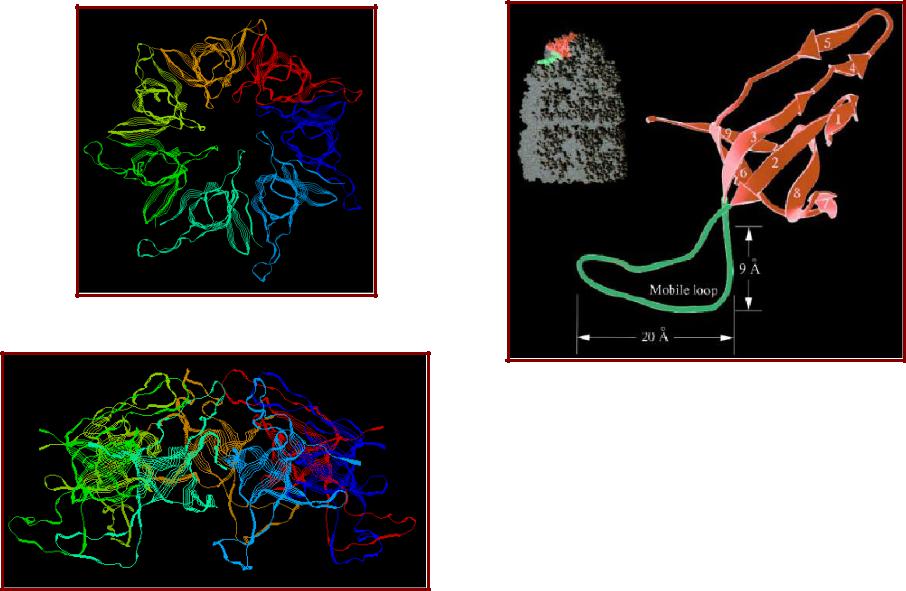
Структура GroES
GroES – вид сверху
Структура субъединицы GroES:
•β-структурный домен и подвижная петля.
C апикальным доменом GroEL в основном взаимодействуют ак остатки мобильной петли GroES.
GroES – вид сбоку
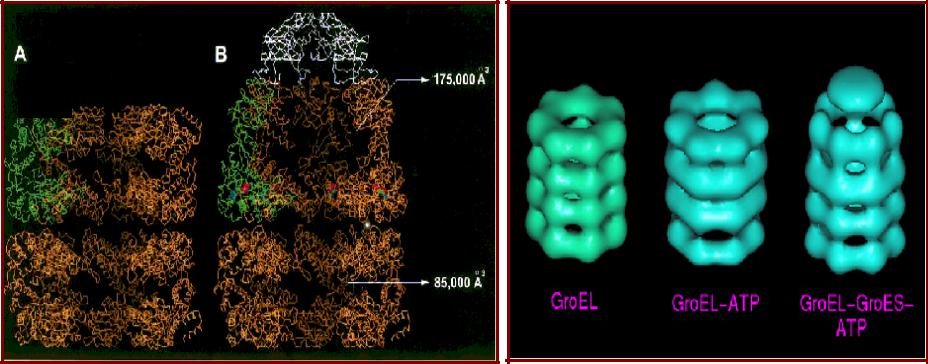
Конформационные изменения в GroEL при связывании АТФ и GroES
Связывание GroEL с АТФ и GroES приводит
кбольшим конформационным изменениям:
•увеличивается объем внутренней полости примерно в 2 раза;
•меняется расположение гидрофобных остатков апикального домена,
•внутренняя поверхность полости становится гидрофильной.
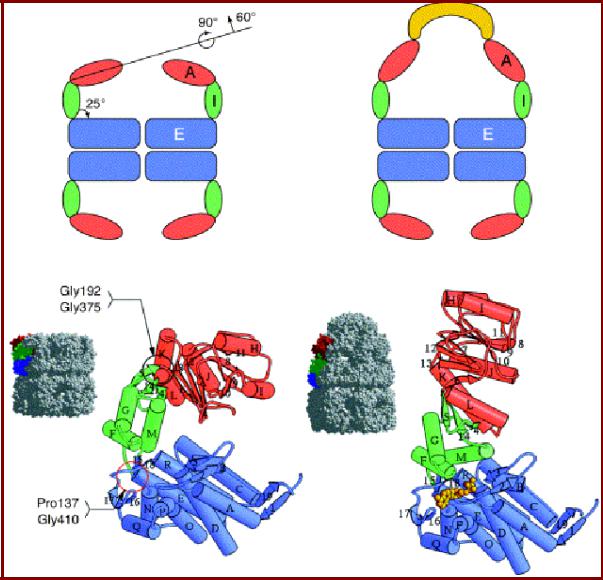
Конформационные изменения в субъединицах GroEL при функционировании
• При связывании
GroEL c АТФ и
GroES происходят конформационные изменения в промежуточном и апикальном доменах
– апикальный домен приподнимается и разворачивается в сторону примерно на 900.
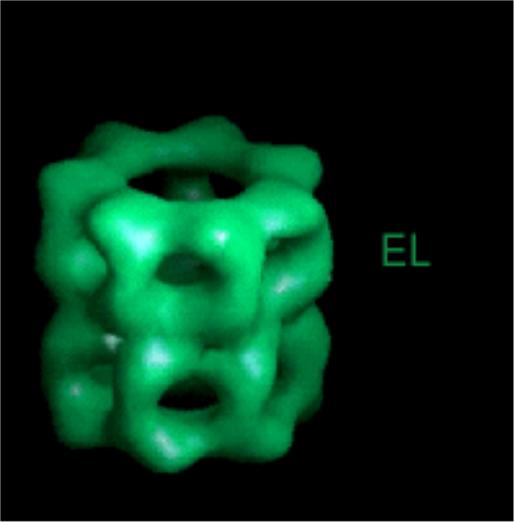
Конформационные изменения в
шаперонине GroEL
