
МОЛБИОЛ 2014-лекции / ОГК / Л6-Шапероны-2
.pdf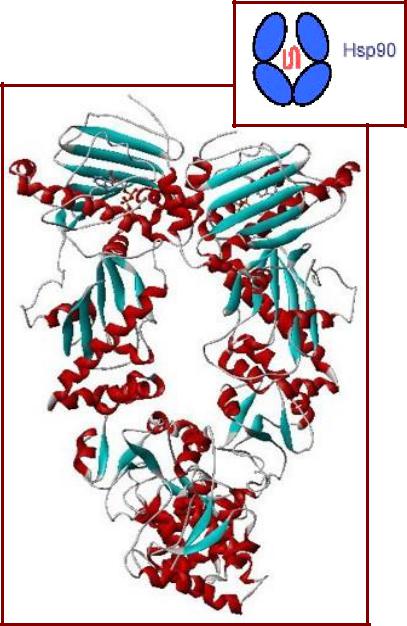
Шапероны семейства Hsp90
• Обнаружены в эубактериях (HtpG)
и в эукариотах (Hsp90, GRP94);
• Продуцируются в клетках при
нормальных условиях; составляют 1-2% от общего количества белков;
•При стрессовых ситуациях количество Hsp90 в клетках повышается до 4-6%;
•Необходимы для выживания эукариот (делеция Hsp90 летальна);
•Гомология между бактериальным
HtpG (High temperature protein G) и
эукариотическим Hsp90 около 40%;
•В клетках человека существует четыре изоформы Hsp90 –
в цитозоле Hsp90α (индуцибельная) и Hsp90β (конститутивная), гомология между ними составляет
85-90%; в ЭР - GRP94/gp96, в
митохондриях - TRAP1/hsp75.
Ленточная модель димера Hsp90 в комплексе с АТФ
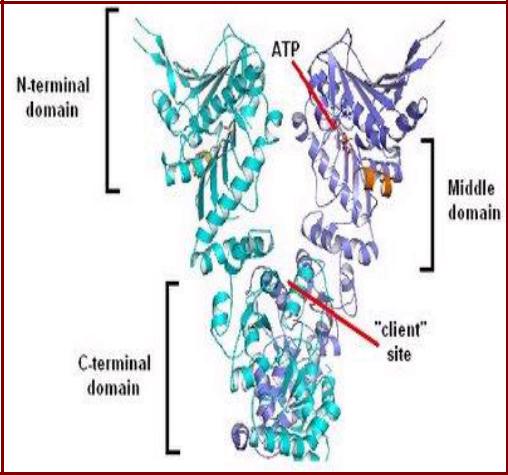
Доменная структура Hsp90
Hsp90
функционирует как димер;
работает с многими кофакторами;
мономер Hsp90 состоит из трех доменов:
•N-концевой домен формирует АТФазный центр и участвует во взаимодействии с другими кофакторами;
•промежуточный домен осуществляет связь с белкомклиентом;
•С-концевой домен участвует в димеризации и
взаимодействии с другими |
Структура шаперона Hsp90 |
|
кофакторами. |
||
|
Функции Hsp90
•Предотвращают агрегацию нестабильных белковых конформеров;
•Вместе с другими шаперонами участвуют в рефолдинге денатурированных белков;
•Помогают в сборке и созревании некоторых важных для клетки белков;
•Участвуют в передаче сигнала в клетке, регулируют активность некоторых транскрипционных факторов;
•Жизненно необходимы для правильной сборки и функционирования рецепторов стероидных гормонов в клетке;
•Необходимы для корректной сборки многих протеинкиназ (серин/треониновых и тирозиновых);
•Участвуют в фолдинге и рефолдинге некоторых белков цитоскелета;
•Участвуют в деградации белков.
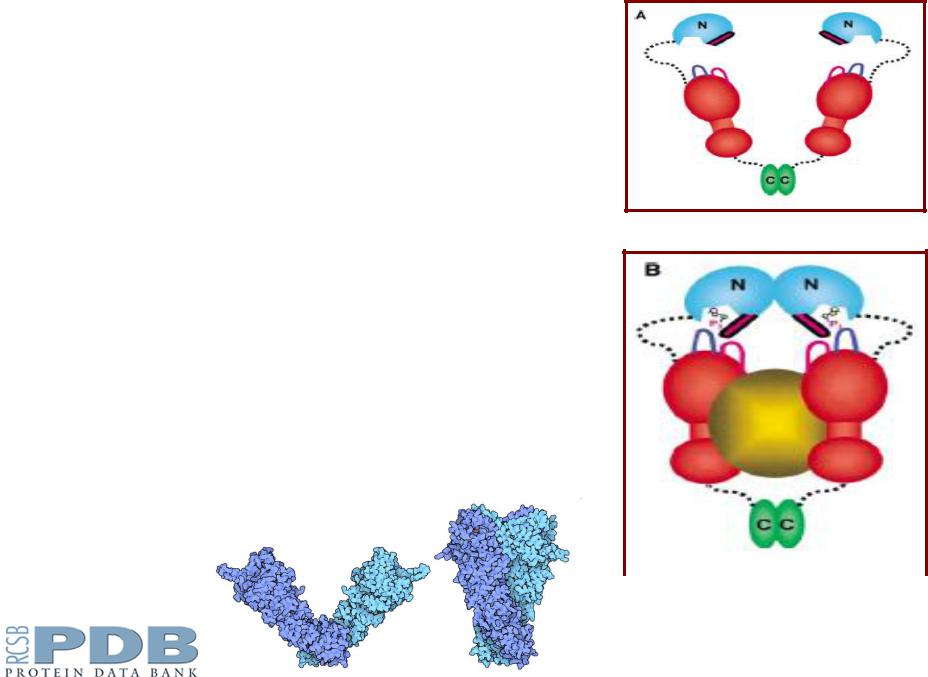
Модель Hsp90 |
|
|
|
|
|
Схематическое строение |
|
|
|
|
Hsp90 |
|
|
|
А – без АТФ; |
|
|
|
В - с АТФ и белком. |
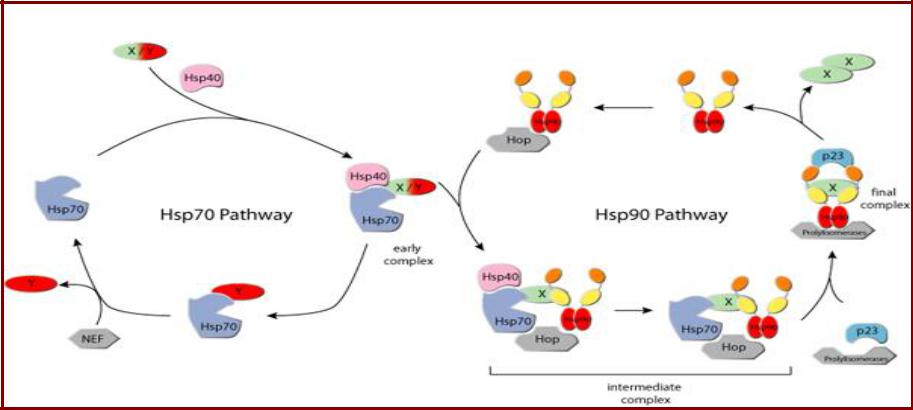
Связь путей Hsp70 и Hsp90
•Hsp70 и Hsp90 формируют мультишаперонный комплекс, в
котором они связаны белком Hop (Hsp70/Hsp90 organising protein);
•Компоненты Hsp70 системы диссоциируют; в комплекс входят дополнительные факторы (при фолдинге стероидных рецепторов
– кошаперон р23, иммунофилины, обладающие пролилизомеразной активностью) – формируется «окончательный комплекс»;
•Только в этом комплексе стероидные рецепторы активируются, связываясь со своими лигандами.
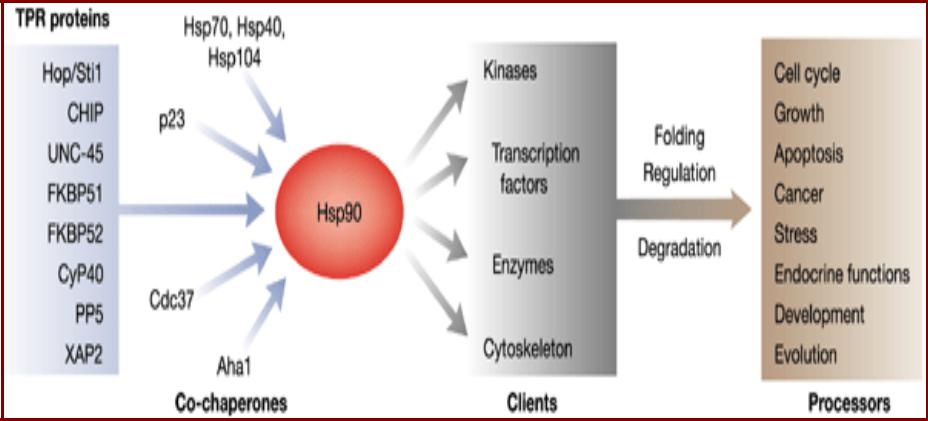
Участие шаперона Hsp90 и его кошаперонов
в различных клеточных процессах
•Hsp90 рассматривают как одну из важных мишеней при противоопухолевой терапии.
•Антибиотик гелданамицин ингибирует связывание АТФ с Hsp90, что нарушает функционирование Hsp90 и гибель клетки: опухолевые клетки более чувствительны к этой терапии.
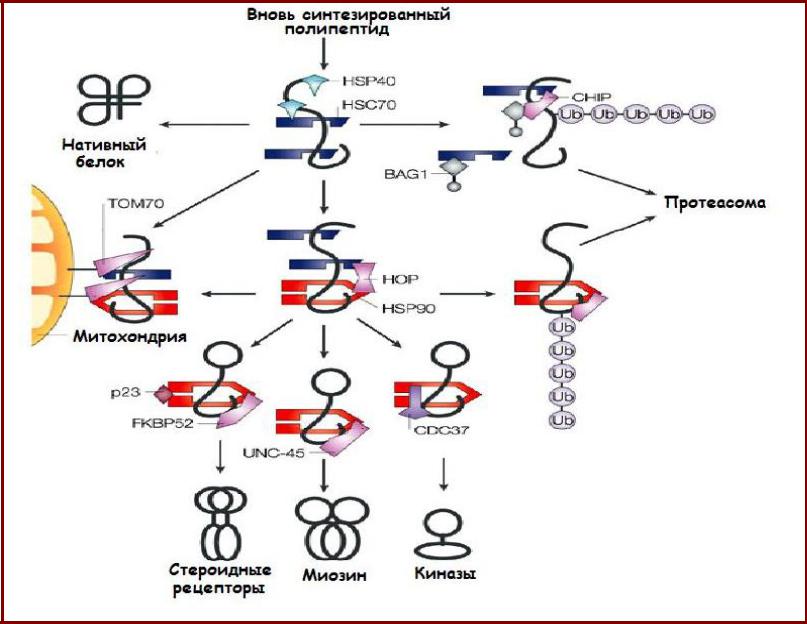
Поздняя стадия фолдинга белков у эукариот
