
МОЛБИОЛ 2014-лекции / ОГК / Л3-Модификация белков-1
.pdfПосттрансляционная модификация белков I
Лекция 3
2014г.

Биогенез белков
•Биогенез белков означает «рождение» белков и переход между ненативным и нативным состоянием белка
•Биогенез белков включает в себя:
–синтез полипептидной цепи;
–химическую и структурную модификацию белков;
–Пространственное сворачивание (фолдинг) белка
(folding);
–сборку белковых комплексов (assembly);
–транспорт белков к мембранам и транслокацию их через мембраны;
–вторичный фолдинг или «пересворачивание» белков (рефолдинг).

Посттрансляционной модификацией белков
называют изменение первичной структуры полипептидной цепи после завершения ее синтеза рибосомами; т.е. это химические превращения, изменяющие ковалентную структуру
полипептидной цепи. Таких реакций насчитывается 300-400. Особенности реакций посттрансляционной модификации:
•Катализируются специфическими ферментами (хотя есть и внутримолекулярные превращения);
•Модификации затрагивают определенные ак остатки; модифицирующие ферменты распознают специфическую последовательность ак остатков (мотив);
•Могут происходить как во время синтеза п/п цепи (котрансляционная модификация), так и после окончания синтеза:
•Нематричные процессы, отсюда – образование множественных форм белка;
•Некоторые реакции характерны для очень многих белков, а некоторые – для ограниченной группы (или отдельных) белков;
•Функциональная направленность реакций посттрансляционной модификации (отличать от повреждающих реакций);
•Более 200 различных модификаций ак было обнаружено в белках после модификаций;
•Более 5% генов в геноме человека кодируют ферменты, участвующие в посттрансляционной модификации белков.
Функциональное значение посттрансляционной модификации:
1.Увеличение разнообразия белковых молекул (структурное и функциональное)
-Протеом человека состоит из ~ 300000 различных белков, что почти в 10 раз превышает число генов(!);
2.Правильная сборка белков;
3.Повышение стабильности белков;
4.Регуляция активности белков (активация или инактивация белков, изменение функции белков);
5.Регуляция белок-белковых взаимодействий (модификация сайтов связывания);
6.Передача сигнала;
7.Локализация белков (якоря мембранных белков, формирование транспортных сигналов);
8.Контроль времени жизни (сигнал к выживанию или сигнал к деградации белка) и др.
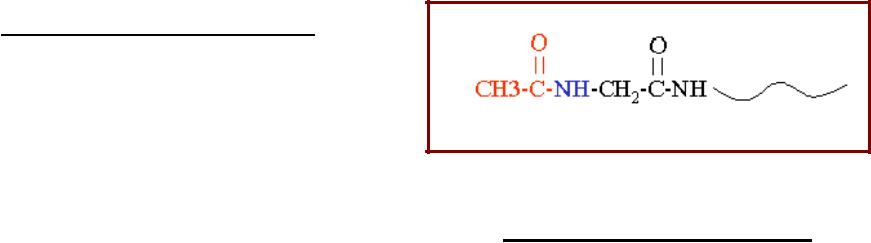
Модификации N- и С-концов белков
Модификации N-конца очень распространены:
•Удаление N-формильной группы Met (прокариоты, митохондрии и хлоропласты эукариот);
•Отщепление инициирующего Met (аминопептидаза):
-примерно у 50% цитозольных белков сохраняется Met,
-часто встречаются Ala, Ser, Thr,
реже Gly, Asp;
•Ацетилирование N-конца
-часто ацетилированы Ala, Ser,
-реже – Gly, Met, Asp;
(около 50 % цитозольных белков ацетилировано); донор ацетильной группы – Acetyl-CoA;
•Метилирование N-конца – чаще всегоLis, Arg, His,
(редкая модификация; например, рибосомные белки);
•Добавление ак (часто Arg) к N - концу.
Ацетилированный N-конец белка
Модификации С-конца встречаются реже:
•Амидирование С-конца
-удаление нескольких ак или протеолитическое расщепление,
-амидирование С-конца Gly,
-витамин-С-зависимая реакция
-характерно для нейропептидов (активация окситоцина и вазопрессина)
•Удаление некоторых ак, сопровождающееся формированием липопротеинов;
•Удаление ак с С-конца (Tyr в тубулине).
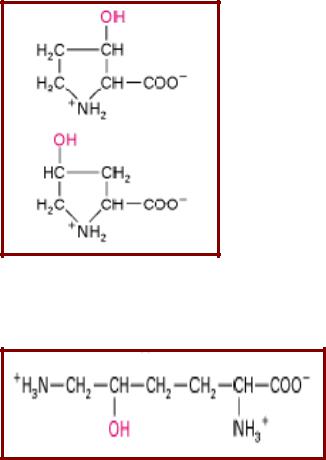
Модификация внутренних аминокислотных остатков белков (I)
Образование оксипролина (котрансляционно)
•Мотив Pro-Gly-X-Y, где X, Y – часто Pro, то появляется структурный мотив Gly-Pro-Hyp;
•Реакция идет в эндоплазматическом ретикулуме (ЭР);
•Встречается часто в коллагене, эластине;
•Повышает стабильность тройной суперспирали коллагена;
•Витамин С – кофактор пролилгидроксилаз; отсутствие витамина С приводит к быстрой деградации коллагена вне клеток;
•Нарушение ведет к поражениям кожи, сосудов и т.д.
Образование оксилизина (котрансляционно)
•Мотив Lys*-Gly; реакция идет в ЭР;
•Встречается часто в коллагене;
•Витамин С – кофактор лизилгидроксилазы;
•Точки гликозилирования и поперечных сшивок;
•Нарушение ведет к поражениям кожи, утрате эластичности связок и сосудов.

Модификация внутренних аминокислотных остатков белков (II)
Карбоксилирование Glu
(Образование γ-карбоксиглутаминовой кислоты - Gla):
•Реакция идет в ЭР;
•Gla образует комплексы с ионами Cа2+, связанными с фосфолипидами мембран;
•Свойственна белкам, образующим комплексы с ионами Cа2+: остеокальцину, протромбину (карбоксилированию подвергаются ~10 Glu остатков на N-конце);
•Кофакторвитамин К; дефицит витамина К приводит к нарушению свертывания крови;
•Непрямые антикоагулянты варфарин и дикумарол ингибируют реакцию.
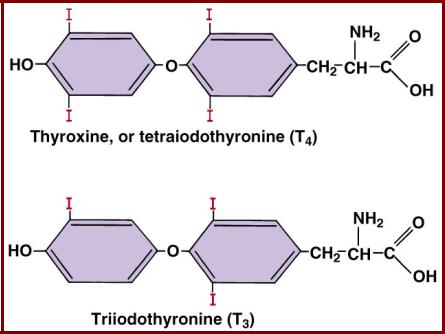
Модификация внутренних аминокислотных остатков белков (III)
Радиоактивный I125
используют для мечения белков и пептидов в радиоиммунологическом анализе (РИА).
Йодирование остатков тирозина при образовании Т3 и Т4:
•Характерно для тиреоглобулина;
•Йодирование немногих остатков Tyr (из 115 Tyr тиреоглобулина) в фолликулах щитовидной железы;
•Образуются монойодотирозин (MIT) или дийодотирозин (DIT);
•MIT+DIT=T3 (трийодотиронин); DIT+DIT=T4 (тироксин);
•Высвобождение Т3 и Т4 происходит под действием специфической протеиназы.
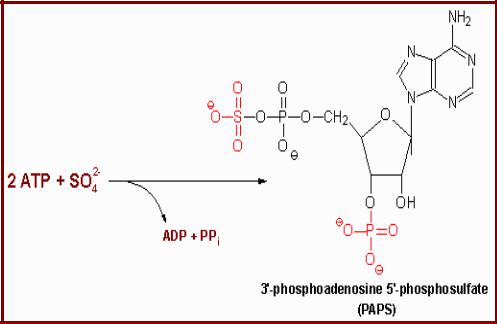
Модификация внутренних аминокислотных остатков белков (IV)
•Реакция идет в аппарате Гольджи;
•Осуществляет фермент тирозилпротеинсульфотрансфераза (TPST)
•Универсальный донор сульфатных групп – 3’-фосфоаденозил-5’- фосфосульфат (PAPS);
•Характерно для некоторых секреторных (гастрин, фибриноген) и мембранных белков (CCR5);
•Сульфатирование необходимо для оптимальной биологической активности белков и пептидов, для правильной секреции и контроля за временем жизни.
Сульфатирование
тирозина
Синтез PAPS
Модификация внутренних
аминокислотных остатков белков (V)
Эпимеризация L-аминокислот в D-аминокислоты:
•D-аминокислотные остатки (Ala, Met, Leu, Ile, Phe, Asp, Trp, Ser) обнаружены в различных пептидах многих видов, наличие D-аминокислот влияет на биологическую активность пептидов;
•Пауки Agelenopsis aperta продуцируют пептидные токсины, блокирующие Са2+каналы;
-Два токсина – IVB и IVC (48 ак) имеют идентичную ак последовательность, но разделяются с помощью HPLC;
-IVB более токсичен, чем IVC; -Выяснено, что IVB имеет D-Ser46;
-Изомераза имеет большую гомологию с сериновыми протеазами;
-Эта инверсия обеспечивает защиту от протеолитической деградации и позволяет токсину лучше блокировать Са2+каналы (другая пространственная структура).
•Характерно для опиоидных пептидов, секретируемых кожей некоторых амфибий (дерморфин, дермэнкефалин). Активность как анальгетиков в 1000 раз больше, чем у морфина;
•Новые возможности для фармацевтических фирм.
