
МОЛБИОЛ 2014-лекции / ОГК / Л3-Модификация белков-1
.pdf
Модификация внутренних аминокислотных остатков белков (VI)
Формирование дисульфидных связей
Протеиндисульфидизомераза (PDI):
•катализирует образование и изомеризацию дисульфидных связей;
•локализуется в ЭР;
•способствует сворачиванию секретируемых клетками белков, содержащих дисульфидные мостики (например, инсулин, рибонуклеаза, иммуноглобулины);
•субстраты имеют частично развернутую структуру.
Гликозилирование белков
(образование гликопротеинов)
Гликопротеинами называют белки, содержащие ковалентно связанный углеводный компонент.
В зависимости от структурной роли углеводного компонента можно
выделить два класса – гликопротеины и протеогликаны.
У гликопротеинов углеводный компонент представлен многочисленными, сравнительно короткими разветвленными олигосахаридами, и его масса обычно существенно меньше массы белковой части молекулы.
У протеогликанов пептидная цепь ковалентно связана с полисахаридными цепочками гликозамогликанов; здесь основную часть молекулы составляет углеводный компонент.
Гликозилирование:
•Одна из основных форм модификации белков (более 80% белков гликозилировано);
•Происходит в основном в ЭР и аппарате Гольджи (большинство секреторных и мембранных белков гликозилированно);
•Реже происходит в цитоплазме и ядре;
•Имеет много разных форм и разнообразных функций;
•В гликозилировании участвует большое число разных ферментов. 12

N-гликопротеины
• Сборка (фолдинг)
белков препятствует N-гликозилированию.
•Углеводный компонент присоединяется N-гликозидной связью к амидному азоту Asn;
•Происходит в ЭР;
•Мотив N-гликозилирования
Asn*-X-Ser (Thr), где Х-любая ак, кроме Pro;
•N-гликозилированию подвергаются немногие Asn (в панкреатической рибонуклеазе гликозилируется только 1 остаток
Asn из 34);
•Первый моносахарид - N-ацетилглюкозамин (GlcNAc);
•Первый этап - присоединение сложного олигосахарида, в дальнейшем – сложный процессинг углеводной цепи;

Начальные этапы N-гликозилирования в ЭР
• Формирование сложного |
• Распознавание сайта |
олигосахарида связанного с |
гликозилирования и |
мембраной через |
перенос углеводной цепи |
долихолпирофосфат |
(en block) с липида на |
(Glc3Man9GlcNAc2-P-P-dolichol); |
растущий полипептид. |

Процессинг углеводной цепи в ЭР и в аппарате Гольджи
•Отщепление концевых моносахаридов (в ЭПР, в аппарате Гольджи);
•Формирование ядра – Man3GlcNAc2;
•Последовательное включение отдельных моносахаридных звеньев;
•У разных белков разная конечная структура олигосахарида:
три типа углеводных остатков – высокоманнозный (только Man вне ядра), гибридный (содержит разные сахара и аминосахара) и смешанный (похож на гибридный, но содержит еще сиаловую кислоту).

O-гликопротеины
При гликозилированиии в
цитоплазме и ядре N-ацетилглюкозамин (GlcNAc) присоединяется О-гликозидной связью
к Ser или Thr
•Углеводный компонент присоединяется О-гликозидной связью к оксигруппе Ser или Thr;
•Происходит в аппарате Гольджи;
•Первый моносахарид N-ацетилгалактозамин (GalNAc);
•Предполагаемый мотив:
Pro-Ser(Thr) в составе бета-
изгиба;
•Биосинтез О-гликопротеинов происходит ступенчато;
•О-гликозилирование может происходить после формирования глобулы;
•О-гликозилирование встречается реже в глобулярных белках, чем N-гликозилирование.
Функциональное значение гликозилирования
•Стабилизация структуры белков, стерическая защита от протеаз (особенно для секреторных белков);
•Участие в развитии и дифференцировке организма
–удаление N-ацетилглюкозаминтрансферазы I у мышей вызывает гибель эмбрионов;
•Межклеточное распознавание;
•Передача сигнала
–клеточные рецепторы в основном – гликопротеины и протеогликаны;
•Модуляция иммунного ответа
–участие в неспецифическом иммунитете, фагоцитозе,
–привлечение мононуклеарных клеток в очаги воспаления (селектины);
•Адресация клеток и молекул
–манноза-6-фосфат – сигнал для лизосомных гидролаз;
–сиаловая кислота на гликопротеинах крови – сигнал к
удержанию в кровотоке и т.д.;
•Участие в локализации белков на мембране
(Glycosylphosphatidylinositol – (GPI)-якорь).
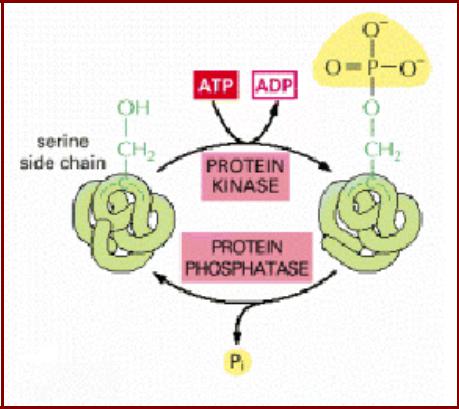
Фосфорилирование белков
•Одна из наиболее общих модификаций белков эукариот;
•В большинстве случаев фосфорилирование существует как механизм регуляции биологической активности белков (обратимо);
•Перенос концевого фосфата АТФ на гидроксильные группы Ser, Thr, Tyr;
•Киназы (или протеинкиназы) - ферменты, фосфорилирующие белки;
•Фосфатазы - ферменты, дефосфорилирующие белки;
•В клетках животных фосфорилируются Ser/Thr (серин/треониновые киназы) или Tyr (тирозинкиназы);
•Уровень фосфорилирования
Ser/Thr/Tyr ~ 1000/100/1.

Регуляция биологической активности белков путем фосфорилирования
Активация или инактивация различных белков в клетке
-в результате активации глюкагоном в гепатоцитах происходит фосфорилирование гликогенсинтазы (ингибирование ее активности) и фосфорилирование гликогенфосфорилазы (активация фермента). Эти события приводят к увеличению выброса глюкозы в кровь.
-фосфорилирование одного из факторов инициации трансляции eIF-2 приводит к его инактивации, что резко снижает уровень синтеза белка;
Передача сигнала внутрь клетки
- цитоплазматические домены рецепторов для многих факторов роста являются тирозинкиназами.

Фосфорилирование фактора eIF-2 регулирует синтез белка на стадии инициации трансляции
|
|
• Фосфорилирование фактора |
|
|
eIF-2 предотвращает обмен |
|
|
GDP на GTP, опосредованный |
|
|
фактором eIF-2B; |
|
|
• Фактора eIF-2B в клетках |
|
|
меньше, чем eIF-2; |
|
|
• Фосфорилированная форма |
|
|
eIF-2 обладает повышенным |
|
|
сродством к eIF-2B и |
|
|
связывает весь eIF-2B в |
|
|
неактивный комплекс; |
|
|
• Избыточный фактор eIF-2 |
|
|
остается в GDP-связанной |
|
|
форме и не может |
|
|
инициировать трансляцию |
|
|
белка; |
• Это один из путей регуляции |
• Уровень синтеза белка резко |
|
трансляции в фазе G0 |
клеточного |
падает. |
цикла. |
|
|
