
Bilety2
.pdf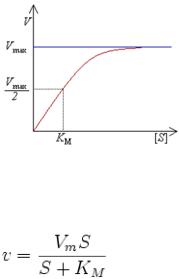
БИЛЕТ 25
Зависифмость скорости ферментативной реакции от концентрации субстрата. График Михаэлиса-Ментен. Медико-биологическое значение константы Михаэлиса.
Скорость фермента реакции опр. изменением кол-ва субстрата или прод. р-ции за ед. времени. Зав. от конц. субст, ферм., кофактора, прод. р-ции, от рН обусл. влиянием на ионизацию функ. гр. в акт. центре ферм., функ. гр. субст. При значит откл рН от опт. знач. фермент. акт. утрач. из-за денатур. от температуры - с ростом t увелич. ск-ть р-ции, т.к. увелич. ск-ть достижения перех. сост. субстр., с повыш t увелич вероятн. денатур. ферм. и разруш. струк. акт. центра. При увелич. конц. ферм. ск-ть р-ции увелич. линейно. При пост. конц. ферм. скорость р-ции при увелич. кол-ва субст. увелич. гиперболически.
Уравне́ние Михаэлиса́ — Ме́нтен — основное уравнение ферментативной кинетики,
описывает зависимость скорости реакции, катализируемой ферментом, от концентрации субстрата.
Конст. Михаэлиса численно равна той конц. субстрата. прикоторой скорость р-ции сост. половине максимальной. Кm - хар-ка каталит. акт-ти фермента.
Уравнение Михаэлиса-Ментен : E+SES->E+P
Уравнение имеет вид:
,
Где
Vm — максимальная скорость реакции,
равная KcatE0;
Km — константа Михаэлиса, равная концентрации субстрата, при которой скорость реакции составляет половину от максимальной;
S — концентрация субстрата.
V= Vmax [S]/ Km+[S]. Чем меньше Km. тем выше акт-ть Ф. При низкой конц. субст. ск-ть ферм. р- ции опр. частотой столкновения молек. субст. и Ф. при полном насыщ. субстратом молек. Ф., дальнейшее увелич. конц. субст. не выз. повыш. ск-ти р-ции. Предст гиперб. зав-ти в обрат. коорд. преобр ее в прямую и дает возм.точного опред. макс. ск-ти р-ции и Km. - координаты Лайнуивера-Бэрка.
Km может служить мерой сродства субст. к Ф.
Гликогенолиз, его биологическое значение.
Распад гликогена (гликонеолиз) происходит в ответ на повышение постребности организма в глюкозе.В первых реакциях учавствует (ф гликогенфосфорилаза) обеспечивающая последовательное отщепление глюкозы от полисахариlа,до того момента пока не останется 4 молекулы,далее глюгоза-1 фосфат в глюкозо- 6-фосфат (под действием ф фосфоглюкомутаза) далее (под действием ф глюкозо-6-фосфатаза) превращение в глюкозу и далее в кровь.
Биологоческое значение:поддержание постоянной концентрации глюкозы в крови,и обеспечение поступления ее в другие ткани;мышечный гликоген освобождает грюкозо-6-фосфат,потребляемый самой мышцей для окисления и использования энергии;распад гликогена до г-6-ф не требует энергии;необратимость процессов синтеза и распада гликогена обеспечивается их регуляцией.
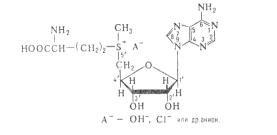
S-аденозилметионин, его химическое строение и роль в метаболизме клетки. Липотропные факторы.
Активный метионин; донор метильных групп при трансметилировании. Аденозилметионин участвует в синтезе фосфатидилхолина, холина, адреналина, витамина В12. Обезвреживание биогенных аминов с участием О- метилтрансфераз, синтез адреналина из норадреналина, Обр-ся в рез-те АТФ-зависимой р-ции, катализ. метионинаденозилтрансферазой. после отщепления метильной группы обр. Sаденозилгомоцистеин.
Гормоны передней доли гипофиза, их химическая природа и физиологические функции.
В передней доле выраб. в основном белковые и полипептидные Г., называемые тропными
Адренокортикотропный гормон (АКТГ),
Увелич. образование глюкокортикоидов. Стимул. липолиза (мобилизует жиры из жировых депо и спос. ок-ию жиров), увелич. секр. инсулина и соматотропина, накоплении гликогена в кл. мыш. тк., гипогликемии, усилении пигм. за счет действия на пигментные клетки меланофоры. Молекула АКТГ сод. 39 аминокислотных ост. Сод. 2 акт. уч-ка цепи, 1 отв. за связ. с соотв. рецептором, другой - за гормон. эфф. АКТГ взаимод. с рецеп. кл. мембр., сигнал перед. на ферм. аденилатциклазу, кат. распад АТФ и обр-е цАМФ, к-й акт-т протеинкиназу. Пр-за фосфолирует
холинэстеразу, превращ-ю эфиры холестерина в своб холестерин, который поступ. в митох надпоч., где сод-ся все ферм., катализ -е превращ. холестерина в кортикостероиды.
Соматотропный гормон (СТГ)
сост. из 191 аминок-ты и содержит 2 дисульфидные связи, N и С концевые аминокислоты предст. фенилаланином. Влияет на все клетки организма. определяя интенс обм углеводов, белков. липидов и мин. в-в. Усил. биосинтез белка, ДНК, РНК, гликогена, спос. мобилиз. жиров из депо, распаду высших жир. к-т, глюкозы в тк. Стимул. рост скелета, Биол. эфф. осущ. через соматомедин - сульфирующий, или тимидиловый фактор, стимулир. вкл. сульфата в хрящи, тимидина - в ДНК. уридина - в РНК. пролина в коллаген.
Лактотропный гормон
Стимулир. лакт-ю и рост. мол. ж-з, стим. рост. внут. орг.. секр. желтого тела, ок. ренотропное, эритропоэт., гиперглик. дейст. 199 аминок-т, 3 дисульфид. св.
Тиреотропный гормон (ТТГ)
слож. гликопротеид, сост. из a (96 ам-ты)и b- субъед.(сод 112 ам-ты), контр. ф-цию и разв. щит. ж-зы.
В крови новорожденного уровень билирубина составляет 300мкмоль/л. Каковы возможные причины, предварительный диагноз?
Появление физиологической желтухи происходит из-за повышения уровня непрямого билирубина у новорожденных (гипербилирубинемия). Гипирбилирубинемия в первые дни после рождения отмечается у всех новорожденных. Но вот окрашивание кожи в желтый цвет отмечается только у половины детей рожденных в срок. Билирубин откладываясь в верхних слоях кожи, окрашивает
её в желтый цвет. Окрашивание кожи происходит при определенном уровне непрямого билирубина. У доношенных детей при уровене билирубина - 85-120 мкмоль\л, у недоношенных - 61-85 мкмоль\л.
Так как значение билирубина в данном случае превышают норму, то можно предположить резус конфликт Разрушение эритроцитов может быть вызвано и различными генетически обусловленными нарушениями, как, например, микросфероцитоз ( анемия МинковскогоШоффара ), нарушениями структуры гемоглобина ( например, при серповидноклеточной анемии ), изменением формы и структуры самого эритроцита и пр. Следует провести фототерапию и переливание крови
БИЛЕТ 26
Строение нуклеиновых кислот. Нуклеозиды и нуклеотиды. НАД+, НАДФ+, ФАД. Связи, формирующие первичную структуру ДНК и РНК, 5’фосфатный и 3’гидроксильный концы полинуклеотидных цепей. Вторичная структура ДНК и РНК. Денатурация и ренатурация ДНК.
Строение нуклеиновых кислот,азотистые основания-–сложные высокомолекулярн соединения,обеспечивающие хранение,передачу наследств инфы и реализацию этой инфы.
Азотистые основания : пиримидиновые (цитозин,урацил,тимин) и пуриновые (аденин, гуанин)
Структурными единицами нукл кислот явл нуклеотиды,сост из азотист основания,углевода(заним центр место) и фосфорной к-ты. Нуклеозиды- соединения, сост из остатка азотистого основания и углевода — рибозы (рибонуклеозиды) или дезоксирибозы (дезоксирибонуклеозиды):
ДНК — Дезоксирибонуклеиновая к-та (состоит из двух полинуклеотидных цепей, направленных антипараллельно) Сахар — дезоксирибоза, азотистые основания: пуриновые — гуанин (G), аденин (A), пиримидиновые — тимин (T) и цитозин (C).
Вторичная структура ДНК и РНК образ-ся за счет взаимод нуклеотидов (в большей степени
азотистых оснований) между собой, водородных связей. Классич пример вторичн структуры ДНК - двойная спираль ДНК – это сам распростр в природе форма ДНК, сост из двух полинуклеотидных цепей ДНК. Построение каждой новой цепи ДНК осуществл по принципу комплементарности, т.е. каждому азотистому основанию одной цепи ДНК соотв строго опред основание др цепи: в комплемнтарной паре напротив A стоит T, а напротив G располагается C и т.д. Молекула ДНК имеет форму спирали,образованную двумя полинуклеотидными цепями,закрученными вокруг друг другва и вокруг общей оси.Двойная спирать правозакрученная,полунуклеотидные цепи в ней антипараллельны(одна3-5,другая 5- 3)На кождом из концов молекулы ДНК расположены 5 и 3 конец.Полинуклеиновые цепи удерживаются относительно друг друга за счет водородных связец между комплементарнымми пуриновыми и пиримидиновыми основаниями.Так последовательеость нуклеотидов одной цепи комплементара последовательности другой.
Вторичная структура матричных и рибосомных РНК. Относительно вторичной структуры тРНК наиб вероятной представл-ся модель, предложенная Р. Холли, плоское изображение в форме клеверного листа. Последовательность почти всех природных тРНК укладывается в эту схему «клеверного листа». При сравнении этих структур выявл ряд закономерностей, имеющих опред биол смысл.Она построена из одной нуклеотидной цени.Отдельные участки цепи РНК образуют спирализованные петли- «шпильки»,за счет водородных связей между комплементарными азотистыми основаниями.
Первичная структура ДНК.Порядок чередования дезоксирибонуклеозидмонофосфатов в полинуклеотидной цепи.Каждая фосфатная
группа в полинуклеотидной цепи,за исключением фосфорного остатка на 5 конце молекулы,учавствует в образовании двух эфирнух связей с участием 3,5-углеродных атомов двух соседних дезоксиребоз,поэтому связь между мономерами обозначают как 3,5- фосфодиэфирная.Концевые отделы ДНК различаются по структуре:на 5-конце находится фосфатная группа,на 3-еоне-свободная ОН группа. β-рибоза (C5H10O5) β- дезоксирибоза (C5H10O4)
Денатурация-расхождение ДНК,в результате разрыва водородных и гидрофобных связей цепи ДНК,под дейстпием различных окружающих факторов(температура)
Ренатурация-обратная реакция денатурации,в процессе которой происзходит образование двуцепочечной структуры из денатурированной ДНк,идентичной исходной.
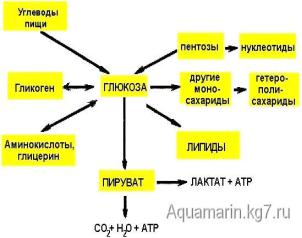
Анаэробный гликолиз.
Глико́лиз— ферментативный процесс последовательного расщепления глюкозы в клетках, сопровождающийся синтезом АТФ. Гликолиз при аэробных условиях ведёт к образованию пировиноградной кислоты (пирувата), гликолиз в анаэробных условиях ведёт к образованию молочной
кислоты (лактата). Гликолиз является основным путём катаболизма глюкозы в организме животных.

Биосинтез кефалина и его биологическое значение. (Фосфатидилколамин)
(общая формула кефалинов)
Кефалины в тканях (главным образом в составе нервной ткани). Кефалины принимают участие в переносе жирных кислот от печени к другим органам и обратно. При недостаточном образовании кефалинов в печени возникает ее ожирение. Кефалины играют определенную роль в процессах свертывания крови, способствуя превращению протромбина в активный тромбин. Кроме того, кефалины, входя в состав цитоплазматических мембран, определяют их проницаемость для других соединений.
Токоферолы, строение и биологическая роль. Представление об антиоксидантах.
Необх. для восст. убихинона и витамина А, защ. от окисления боковую ненасыщ цепь. Токоферол спос. стабилиз. митохондриальную мембр., позволяет экономить О2, контролирует
синт. нукл. к-т, гема, ингибирует в лизосомах фосфолипазу А2, снижает функ. акт-ть Т- лимфоцитов. витамины группы Е, , содержащиеся в больших количествах в растительных маслах. Встраиваясь в фосфолипидный слой мембран выполняет антиоксидантную ф-цию – препятствует развитию перекисного окисления липидов. Антиоксидантами называют вещества, которые препятствуют окислению или реакциям, которые активируются кислородом, перекисями, радикалами.
О чем свидетельствует отсутствие уробилиногена в моче?
Уробилиногеновые тела — производные билирубина. Билирубин в основном выводится из организма с экскрементами, но сначала перерабатывается кишечной флорой. Билирубин переходит в уробилиноген отчасти уже в желчном пузыре, но окончательно процесс происходит в толстой кишке при помощи кишечной флоры. Бактериальные ферменты перерабатывают пигмент билирубин в уробилиногеновые тела.Из желчных пигментов в моче могут появляться билирубин и уробилиноген. В норме билирубин в общем анализе мочи отсутствует; содержание уробилиногена составляет 5-10 мг/л. Уробилиноген образуется из прямого билирубина, выделившегося с желчью, в тонком кишечнике. Поэтому полное отсутствие уробилиногена служит достоверным признаком
прекращения поступления желчи в кишечник,
что подтверждает диагноз подпечёночной желтухи при желчно-каменной болезни.
БИЛЕТ 27
Глобуллярные и фибриллярные, простые и сложные белки. Представления о структуре фибриллярных белков. Коллаген как основной белок соединительной ткани.
Глобулляр. белки — сферич. ф., несут в кл. динамич. ф-ции, внутрь глобулы собраны гидрофобные радикалы, обр. гидрофоб. ядро, а на пов-ти — гидрофил. ост., что обесп. хорошую раств-ть глобуляр. белков. К ним относ. ферм., АТ, некот. гормоны (инсулин), трансп. белки.
Фибрилл. белки им. нитевид струк.. нераств. в воде и разбавл. солевых растворах, устойчивы. Осн. струк. эл. соединит. тк. Коллагены, a- кератин. эластин. В формир. простр. струк. уч-т ковалентные непептидные связи.
Простые белки сод. в своем сост. только полипет. цепи. При гидролизе дают только аминок-ты. Протамины и гистоны (основные), проламины и глютены, альбумины и глобулины (белки сыв. крови, молока, яич. белок, мышцы)
— обл. кислым хар-ром.
Сложные белки сост. из белковой ч. и простетической гр. (ионы металлов, орг. молек.)
Глюкоза как важнейший метаболит углеводного обмена: общая схема источников и путей расходования глюкозы в организме.
Взаимопревращения моносахаридов.
Представление о биологическом значении и метаболизме холестерина. Регуляция синтеза.
Био.значение: Клетка использует холестерин для построения мембран. Молекулы холестерина плазматических мембран, оказавшись в сыворотке крови, начинают афферентный путь к печени в составе ЛПВП. Поступивший в печень в составе ЛПВП холестерин подвергается микросомальному гидроксилированию, превращаясь в желчные кислоты, а также экскретируется с желчью в форме свободного холестерина или его эфиров.
Он участвует в синтезе многих гормонов, выработке витамина D, в обеспечении нервной деятельности и в работе головного мозга.
Метаболизм холестерина. Этот процесс в организме любого человека может идти двумя абсолютно разными путями. ЛПНП встречают апо-В/Е-рецепторы печени и клетки надпочечников и периферических клеток и связываются с ними в единую цепь специфическими рецепторами. Затем они перевариваются в лизосомах. Так из организма человека удаляется большое количество холестерина.
Второй путь прохождения метаболизма – это окисление ЛПНП. Если ЛПНП не были распознаны апо-В/Е-рецепторами, то они встречаются с скэвенджерами. Это крошечные рецепторы макрофагов, работающие в ретикулоэндотелиальной системе. Они связывают между собой ЛПВП и ЛПНП и доставляют их в клетки.
Существует три механизма регуляции:
1.Аллостерическая регуляция по механизму отрицательной обратной связи: холестерин, а в печени — и желчные кислоты ингибируют ГМГ- КоА-редуктазу.

2.Репрессия синтеза ГМГ-КоА-редуктазы холестерином — тоже механизм отрицательной обратной связи. При содержании 2-3 г холестерина в суточной пище человека синтез собственного холестерина почти полностью прекращается.
3.Регуляция путем фосфорилированиядефосфорилирования ГМГ-КоА-редуктазы
Гормоны щитовидной железы, их химическое строение и физиологические функции.
Тироксин и трийодтиронин
Регулируют скорость основного обмена, рост и диффер. тканей, обмен белков, липидов, углеводов, липидов, водно-электролит. обм., деят-ть цнс, пищ. тракта. гемопоэз, ф-цию ссс, потреб. в витаминах, сопрот. орг-ма инфекциям. Специф. рецеп. обесп. транспорт тиреоидных горм. в ядро и взаимод. со струк. генами, в резте чего увелич. синтез ферментов. регулир. ск-ть ок-восст. процессов.
Кальцитонин - гормон пептидной природы. 32 ам-т. Сод. дисульфид. мостик между 1 и 7 аминокислот. ост. Подавляет резорбтивных процессов в костной ткани, выз. гипокальциемию и гипофосфатемию.
Гипотиреоз разв. вслед. недост. йодтиронинов, вслед. недост. ф-ции щит. ж-зы, заб гипофиза и гипоталамуса. Мекседема обусл. избыточным накоплением глюкозаминогликанов и воды. В подкож кл накапл. глюкуроновая к-та. Гипертиреоз возн влед повыш. продукции трийодтиронинов. Увелич. осн. обмен, усил. прсы катаболизма. Б-нь Грейва возн. в рез-те обр-я АТ к тиреоидным АГ. IgG имитирует действие тиреотропина, взаимод. с рецеп. на мембране кл. щит. ж-зы, что прив. к разрастанию тк. щит.
ж-зы и неконтролир. продук. Т3 и Т4. ТТГ снижен.
Содержание лактата в крови больного 55 лет достигает 8 ммоль/л (норма до 2,1 ммоль/л). Каковы возможные причины? Какие метаболические нарушения связаны с лактоацидозами?
Повышение уровня молочной кислоты в крови, обусловленное гипоксией, наблюдается при тяжелой физической нагрузке, шоке, кровотечении, сепсисе, инфаркте миокарда, тромбоэмболии легочной артерии, остановке сердца. При отсутствии явных причин нарушения тканевой перфузии причиной повышенного содержания молочной кислоты в крови могут быть такие заболевания, как сахарный диабет, лейкоз и лимфомы, поражение печени, почечная недостаточность, а также недостаточность некоторых ферментов (болезнь Гирке - дефицит глюкозо-6фосфатазы, недостаточность фруктозо-1,6-бисфосфатазы). Лактатацидоз может развиться после приема больших доз ацетаминофена и этанола, а также после внутривенного введения адреналина, глюкагона, фруктозы или сорбитола.
Лактатный ацидоз — один из вариантов метаболического ацидоза, который можно заподозрить при высоком анионном дефиците (разность между концентрацией натрия и суммарной концентрацией хлорида и бикарбонатов > 18 ммоль/л)
