
Bilety2
.pdfБИЛЕТ 37
Представления о распаде и биосинтезе пиримидиновых нуклеотидов.
Биосинтез пиримидиновых нуклеотидов

Распад пиримидиновых нуклеотидов
Анаболические функции ЦТК. Реакции, |
Анаболические ф-ции ЦТК (цикл Креббса) - обр. |
выполняющие цитратный цикл. |
ряд промежуточ. соед., исп. для синт. других |
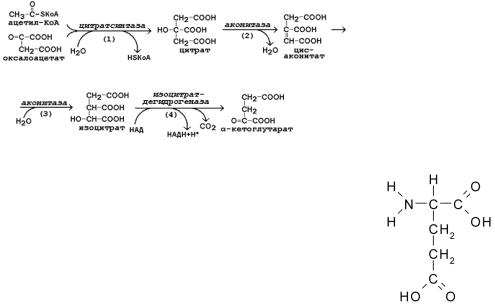
соед-й, а-кетоглуторат - для глутамата, сукцинил КоА - для гема, малат - для пвк.
Челночные механизмы переноса активного водорода с цитоплазмы в матрикс митохондрий.
Различают глицерофосфатный и малатный челночный механизмы. Чаще наблюдается первый.
При глицерофосфатном челночном механизме цитозольные 2НАДН2 окисляются ДОАФ, который восстановливается в глицерофосфат, последний способен проходить через мембраны митохондрий. В митохондриях с участием ФП происходит окисление глицерофосфата и образуется вновь ДОАФ, который возвращается в цитоплазму и вновь участвует в окислении цитозольных НАДН2, а ФПН2 окисляются в цепи БО и дают по 2 АТФ. Т.к., при окислении 1 молекулы глюкозы образуется 2 цитозольных НАДН2, то при данном челночном механизме образуется 4 АТФ.
При малатном челночном механизме цитозольные НАДН2 окисляются с участием ЩУК, которые восстанавливается в малат (яблочную кислоту)
Малат проходит через митохондриальную мембрану и в митохондриях подвергается окислению под действием МДГ и образуется вновь ЩУК. При этом НАД восстанавливается. В цепи БО и ОФ 1 НАДН2 дает 3 АТФ. Поскольку при окислении 1 молекулы глюкозы образуется
2 цитозольных НАДН2, всего при малатном механизме выделяется 6 АТФ. Т.о, энергетический баланс аэробного окисления 1 молекулы глюкозы составляет 36 АТФ (при использовании глицерофосфатного челночного механизма) или 38 АТФ (при использовании малатного челночного механизма).
Роль глутаминовой кислоты в клеточном метаболизме.
Глутаминовая к-та
подверг прямому окислит. зезаминированию с образованием а-кетоглутората. Вступают в р-ции трансаминирования. Явл. субстратом для синтеза глютамина.к-й явл. транспортной формой аммиака, уч. в синтезе мочевины в печени, пуриновых оснований нуклеотидов, АК, аминосахаров, участвует в синтезе трипептида глутатиона, явл. субстратом для синтеза ГАМК.
Обе АК участ. в формир. третич. и четвертич. струк. белков, т.к. являются полярными заряженными АК, и в обр-ии гидратной об-ки белков, формировании актив. центров ферментов.
Глутатион - трипептид, состоящий из глутаминовой к-ты, цистеина, глицина. Связывает токсины с желчью, участвует в тканевых дыхательных процессах. Уч. в образовании "правильных" дисульфидных связей в белках и гормонах. Функционирут в кач-ве кофермента в различ. окислит-восст. р- циях.
При энзиматическом анализе крови было выявлено что активность кислой фосфатазы увеличена в 3 раза. Причина?
Кислая фосфатаза — фермент, участвующий в реакциях обмена ионов фосфорной кислоты. Наибольшее содержание обнаруживается в предстательной железе, что используется как очень чувствительный и специфичный показатель ее патологии.
Определение активности кислой фосфатазы в клинической практике обычно проводят для диагностики рака предстательной железы. Степень увеличения активности кислой фосфатазы особенно высока у больных при наличии костных метастазов. Повышение активности кислой фосфатазы может иметь место при повышенном разрушении тромбоцитов (тробоцитопения, тромбоэмболии и др.), гемолитической болезни, прогрессирующей болезни Педжета, метастатических поражениях костей, болезни Гоше и Нимана-Пика.
Билет 38
1.Различия ферментного состава тканей. Изменения активности ферментов в процессе развития. Изоферменты и энзимодиагностика
Многие ферменты содержатся в различных тканях или орг. Напр. Лактатдегидрогеназа
(ЛДГ) – состоит из 4-х субъединиц 2-х типов: М и Н, разное сочетание которых порождает 5
изоформ: ЛДГ1 (4Н) и ЛДГ2 (3Н1М) – в сердце,
э/ц, л/ц, почках; ЛДГ3 (2Н2М) – в поджелудочной железе, т/ц, л/ц; ЛДГ4 (1Н3М) и ЛДГ5 (4М) – в печени, скелетной мускулатуре. ЛДГ – катализирует обратимую реакцию НАДНН+/НАД+-завимого превращения пирувата в лактат. Активность ЛДГ1,2 повышается в крови при инфаркте миокарда, ЛДГ4,5 – при патологиях печени и скелетной мускулатуры.
1.Внутриутробный период. Характеризуется высокой активностью
ферментов синтеза белка, липидов, происходит увеличение массы организма. Плод находится в анаэробных условиях и для метаболизма характерно анаэробная направленность.
2.Пренатальный период.
Характеризуется изменением активности ферментов, происходит подготовка организма к пребыванию в аэробной среде.
3. Грудной Потребность в глюкозе резко возрастает, она
начинает утилизироваться аэробно, но
примерно до двух лет основным источником энергии является все же липиды, причиной чего является соматотропин. (Гормон роста).
4. Ранний дошкольный период.
С 3-х до 5-и лет. В этот период клетки начинают питаться углеводами. Происходит стабилизация обмена и интенсивная миелизация нервных волокон.
5.Школьный и пубертантный период. Обмен веществ модулируется под действием половых гормонов.
6.Зрелый.
Происходит стабилизация массы тела, репродуктивного гомеостаза.
Изоферменты. Часть ферментов состоят не из одной белковой цепочки, а из нескольких субъединиц. Изоферменты – это семейство ферментов, которые катализируют одну и ту же реакцию, но отличаются по строению и физикохимическим свойствам. Например: лактатде гидрогеназа (ЛДГ) состоит их 4 субъединиц 2хтипов: субъединица Н, выделенная из сер дечной мышцы (heart – сердце), субъединица М, выделенная из скелетных мышц (musculus – мышца). Эти субъединицы кодируются разными генами. В разных органах имеются различ ные формы ЛДГ с различным набором субъединиц.
Энзимодиагностика-методы диагностики болезней, патологических состояний и процессов, основанные на определении активности энзимов (ферментов) в биологических жидкостях
2. Метаболические превращения пвк
ПВК под действием фермента ЛДГ в последней стадии анаэробного гликолиза превращается в лактат. При спиртовом брожении. которое набл. у плесневых грибков, дрожжеподобных организмов ПВК подвергается декарбоксилированию под действием
пируватдекарбоксилазы. образуется ацетальдегид и выд. СО2. При аэробном распаде глюкозы ПВК не восст. до лактата, а подвергается окислительному декарбоксилированию с обр-м ацетил-КоА.
3. Ненасыщенные жирные кислоты, их биологическая роль
Ненасыщенные жирные кислоты (ЖК) – это одноосновные жирные кислоты, в структуре которых присутствуют одна (мононенасыщенная) или две и более (полиненасыщенные жирные кислоты) двойных связей между соседними атомами углерода.
Синоним –непредельные жирные кислоты.
Триглицериды, состоящие из таких жирных кислот, называют, соответственно, ненасыщенными жирами.
Био. роль: Большая часть кислот этой группы не могут синтезироваться в организме человека, однако играют важнейшую роль в росте и развитии плода и ребенка, в процессах воспаления, иммунитета, в процессах свертывания и агрегации форменных элементов крови. Так они препятствуют развитию атеросклероза, улучшают кровообращение, обладают
кардиопротекторным и антиаритмическим действием. В связи с высокой биологической ролью и невозможностью самостоятельного синтеза ненасыщенных жирных кислот их принято называть незаменимыми аминокислотами.
4. Распад пуриновых оснований. Химизм процесса и его медико-биологическое значение. Подагра.
Дефосфорелирование АМФ и ГМФ – фермент 5`- нуклеотидаза
Окисление С6 в аденозине с одновременным его дезаминированием – фермент дезаминаза. Образуется инозин
Удаление рибозы от инозины (с образованием гипоксантина) и гуанозина (с образованием гуанина) с ее одновременным фосфорелированием – фермент нуклеозидфосфорилаза.
Окисление С2 пуринового кольца: гипоксантин при этом окисляется до ксантина (фермент ксантиноксидаза), гуанин дезаминируется до ксантина – фермент дезаминаза.
Окисление С8 в ксантине с образованием
мочевой кислоты – фермент ксантиноксидаза. Около 20% мочевой кислоты удаляется с желчью через кишечник, где она разрушается микрофлорой до CO2 и воды. Остальная часть удаляется через почки.
Пода́гра — гетерогенное по происхождению заболевание, которое характеризуется отложением в различных тканях организма кристаллов уратов в форме моноурата натрия или мочевой кислоты. В основе возникновения лежит накопление мочевой
кислоты и уменьшение её выделения почками, что приводит к повышению концентрации последней в крови (гиперурикемия). Клинически подагра проявляется рецидивирующим острым артрито
м и образованием подагрических узлов — тофусов.
Что такое протеинурия, и ее возможные причины?
Протеинурия – это повышенное содержание
белка в моче. Появление повышенного содержания белка в моче, может свидетельствовать о нарушении работы фильтров почек. Существует несколько видов протеинурии: Протеинурия застойная
(сердечная) – вызывается застоем крови в почках при сердечной недостаточности; Протеинурия истинная (почечная, сывороточная) – вызывается нарушением фильтрационной способности почек; Протеинурия ложная - вызывается попаданием белка в мочу при ее прохождении по мочевым путям, пораженным воспалительным или деструктивным процессом;
Билет 39
История открытия и изучения ферментов. Особенности ферментативного катализа.
Первое научное представление о ферментах было дано К.С. Кирхгофом. к-й показал что экстракты из солода способны осахаривать крахмал с превращением его в мальтозу. Вещество извлекаемое и проросшего ячменя назвали амилазой. Э.Бухнер показал, что метаболические процессы могут функ. незав. от кл. Дж. Самнер док., что ферм. имеют белковую природу.
Особенности ферментативного катализа.
Ферм. ускоряют хим. р-ции во многие миллионы раз. В ходе р-ции не расход., после р- ции ост. в неизм. виде. сниж. энергию активации катализ. ими р-ции. Энергия акт-ции - эн-я, необх. для перевода всех молекул моля вещ-ва в активированное состояние при данной температуре. т.е. для запуска данной р-ции.
При ферментно-субстр. взаимод происходит 1. сближ. и переориентация субст.
2. удаление гидрат. об-ки субстр.
3.ослабляется связь между атомами субст. Изм конформация ферм., обр-ся фермент-субст. комплекс.
4.Стабилиз. перех сост. в рез-те взаимод между субст. и аминокисл. ост актив. ферм.
В конце р-ции компл. распадается с освоб. ферм. и прд. р-ции.
Эндергонические и экзергонические реакции в живой клетке. Макроэргические соединения, дегидрирование субстратов и окисление водорода как источник энергии для синтеза АТФ.
Направление химической реакции определяется значением ΔG (свободной энергии системы). Если эта величина отр., то р-ция протекает самопроизвольно и сопровождается уменьшением свободной энергии -
экзергонические р-ции. Если при этом абсолютное значение ΔG велико, то реакция идёт практически до конца, и её можно рассматривать как необратимую. Если ΔG положительно, то реакция будет протекать только при поступлении свободной энергии извне- эндергоническими р-ции. Если абсолютное значение ΔG велико, то система устойчива, и р-ция в таком случае практич. не осущ-ся. При ΔG, равном нулю, система находится в равновесии. Макроэргические соед- я - группа прир. в-в, молекулы к-х содержат богатые энергией, или макроэргич., связи; присутствуют во всех живых клетках и участвуют в накоплении и превращении энергии. Разрыв макроэргических связей сопровождается выделением энергии, используемой для биосинтеза и транспорта в-в, мыш. сокращ., пищеварения и др. пр-в жизнедеят-ти организма. Сод. фосфорильную или ацильную гр. Биологическое окисление - это дегидрирование субстрата с помощью промежуточных переносчиков водорода и его
конечного акцептора. О2 в этом процессе используется как акцептор Н от окисляемых (дегидрируемых) веществ (субстратов), в результате чего синтезируется вода. Явл. экзоэргический пр-с. Орг-м превращ. около 40% энергии, выдел. при ок-нии, в энергию м. с. АТФ
. При потр. 1 молек. О2 обр. 3 АТФ.
Особенности окисления жирных кислот с нечетным числом углеродных атомов.
Жирные к-ты с нечетным числом углеродных атомов окисляются таким образом, что на последнем этапе расщепления (β-окисления) образуется одна молекула пропионил-КоА и одна молекула ацетил-КоА, а не 2 молекулы ацетил-КоА.
Роль тирозина в метаболизме человека и животных. Химизм метаболических превращений.
Тирозин - условно заменимая аминокислота, поскольку образуется из фенилаланина. Содержание этих аминокислот в пищевых белках (в том числе и растительных) достаточно велико. Кроме использования в синтезе белков, тирозин в разных тканях выступает предшественником таких соединений, как катехоламины, тироксин, меланины, и катаболизируется до СО2 и Н2О. В пигментных клетках (меланоцитах) тирозин выступает предшественником тёмных пигментов - меланинов (присутствуют в сетчатке глаз). В щитовидной железе синтезируются и выделяются гормоны йодтиронины: тироксин (тетрайодтиронин) и трийодтиронин. В мозговом веществе надпочечников и нервной ткани тирозин является предшественником катехоламинов (дофамина, норадреналина и адреналина).
При энзимологическом анализе крови взрослого пациента было обнаружено 4-х
кратное увеличение активности щелочной фосфатазы. Возможные причины этого явления?
Щёлочная фосфатаза участвует в обмене фосфорной кислоты, расщепляя ее от органических соединений и способствуя транспорту фосфора в организме. Самый высокий уровень содержания щелочной фосфатазы — в костной ткани, слизистой оболочки кишечника, в плаценте и молочной железе во время лактации. Щелочная фосфатаза влияет на рост костей, поэтому у детей ее содержание выше, чем у взрослых.
Повышенная щелочная фосфатаза в крови может стать поводом для врача поставить следующий диагноз:
заболевание костной ткани, в том числе опухоли костной ткани, саркома, метастазы рака в кости, миеломная болезнь, рахит, заболевания печени (цирроз, рак, инфекционный гепатит, туберкулез), опухоли желчевыводящих путей, инфаркт легкого, инфаркт почки.
БИЛЕТ 40
1. Хромопротеины, важнейшие представители, строение и роль в организме. Типы гемоглобинов и их изменение в процессе онтогенеза. Гемоглобинопатии.
Хромопротеиды – цветные сложные белки, которые в зависимости от простетической группы делятся на: 1. Гемсодержащие – Нb (НbР,
НbF, НbА), Мb, цитохромы (Р450, а, а3, в, с1, с),
каталаза, пероксидаза; 2.ретиналь содержащие (родопсин, йодопсин – фоторецепторы палочек и колбочек, участвующие в световосприятии), 3. флавопротеиды – ФАД и ФМНсодержащие дегидрогеназы . Нb – хромопротеид, апопротеин которого имеет четвертичную структуру и состоит из 2х αсубъединиц (по 141 а/к) и 2х β (по 146 а/к) , простетическая группа – 4 молекулы гема (степень окисления железа 2+; Виды Hb : НбР эмбриональный 2 альфа 2 эпсилон субъед, НбFплодный 2 альфа 2 гамма , НбА взрослый 2 альфа 2 бета
Гемоглобинопатии- наслед заболевания характериз –ся замменой одной а/к на другую. Например,серповидно-клеточная анемия – замена глутамата на валин, при этом Нб осаждается деформируя мембрану э/ц
2с метаболит углеводного обмена: общая схема источников и путей расходования глюкозы в организме. Взаимопревращения моносахаридов
ГЛИКОЛИЗ – дихотомический распад глюкозы до 2х молекул ПВК (пируват),
ГЛЮКОНЕОГЕНЕЗ – новообразование ГЛЮКОЗЫ из неуглеводных субстратов – аминокислот,
глицерина, лактата, которые превращаются в ПВК или ЩУК, и реакциями, обратными гликолизу, используются для синтеза глюкозы. Но, т.к. в гликолизе 3 реакции – необратимые ( гексокиназная, фруктокиназная, пируваткиназная), то в глюконеогенезе участвуют ферменты 3х обходных путей: 1 - 6фосфоглюкофосфатаза; 2 - 1,6дифосфофруктофосфатаза, 3 - пируваткарбоксилаза (биотинзависимая, катализирует образование ЩУК) и ФЕПкарбоксикиназа.
ГЛИКОГЕНОГЕНЕЗ – синтез гликогена из остатков глюкозы через образование УДФглюкозы.
Гликоген – гомополисахарид с разветвленной структурой: в линейных участках остаткиг люкозы соединяются через α( 1,4)гликозидную связь, в точках ветвления – через α(1,6).
ГЛИКОГЕНОЛИЗ – полный распад гликогена). Взаимопревращения моносахаридов происходят в результате действия соответствующих ферментов, катализирующих реакции фосфорилирования и образования фосфорных эфиров сахаров. Разнообразные гексозофосфорные эфиры найдены в целом ряде растений. Так, например, под действием фермента гексокиназы глюкоза превращается в глюкозо-6 фосфат. Под действием фермента глюкозофосфатизомеразы происходит обратимое превращение глюкозо- 6-фосфата во фруктозо-6-фосфат и маннозо-6-фосфат. В результате действия фосфоглюкомутазы глюкозо-6-фосфат может обратимо превращаться в глюкозо-1-фосфат. Фосфофруктокиназа катализирует превращение фруктозо-6-фосфата во фруктозо-1,6-дифосфат.
3. Ресинтез триацилглицеринов в стенке кишечника. Образование хиломикронов и
транспорт жиров. Роль аполипопротеинов в составе хиломикронов. Липопротеинлипаза.
Ресинтез
1.Образование глицерол-3-фосфата из глюкозы.
2.Превращение глицерол-3-фосфата в фосфатидную кислоту
3.Превращение фосфатидной кислоты в 1,2-ДАГ.
4.Синтез ТАГ.
Хиломикроны образуются в лимфатической системе ворсинок кишечника. Они переносят до половины всех триацилглицеролов и холестерина лимфы. Апопротеин В встраивается в липопротеины в гЭПР, где синтезируются триацилглицеролы. В аппарате Гольджи к белкам добавляются углеводы. Они высвобождаются из клеток кишечника обратным пиноцитозом. После этого хиломикроны поступают в лимфатические сосуды ворсинок и уносятся лимфой. На стенках капилляров находится липопротеинлипаза (ЛПЛ). Апопротеин С2 активирует липопротеинлипазу, которая расщепляет триглицериды хиломикрона до ди- и моноглицеридов, а затем — до свободной жирной кислоты и глицерола. Жирные кислоты транспортируются в мышечные и жировые ткани или связываются с альбумином в крови. По мере липолиза хиломикроны теряют большинство своих триацилглицеролов, относительное содержание холестерина и его эфиров увеличивается. Диаметр остатка хиломикрона уменьшается. Апопротеин С2 возвращается на ЛВП, апопротеин Е
сохраняется. Остатки хиломикронов
поглощаются печенью. Поглощение осуществляется через рецепторный эндоцитоз, с помощью рецепторов апопротеина Е. В печени эфиры холестерина и триацилглицеролы окончательно гидролизуются.
Липопротеинлипаза— фермент, относящийся к классу липаз. ЛПЛ расщепляет триглицериды самых крупных по размеру и богатых липидами липопротеинов плазмы крови — хиломикронов и липопротеинов очень низкой плотности (ЛПОНП или ЛОНП)). ЛПЛ регулирует уровень липидов в крови, что определяет её важное значение в атеросклерозе. ЛПЛ синтезируется в большинстве тканей организма кроме печени, где синтезируется специфическая печёночная липаза. Наиболее богаты липопротеинлипазой сердце, скелетные мышцы и жировая ткань.
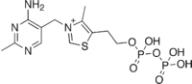
4.Тиаминпирофосфат, его строение и биологическая роль.
Роль:
1.ТДФ – кофактор прямого декарбоксилирования пирувата. При спиртовом брожении происходит декарбоксилирование пирувата под действием пируватдекарбоксилазы и образуется ацетальдегид (СН3-СО-Н), который затем превращается в этанол (СН3-СН2-ОН) с помощью алкогольдегидрогеназы.
2.ТДФ – кофактор окислительного декарбоксилирования пирувата и а-
кетокислот. Окислительное декарбоксилирование пирувата в цитозоле осуществляет пируватдегидрогеназный комплекс. Окислительное декарбоксилирование а-кетоглутарата катализирует а- кетоглутаратдегидрогеназа, локализованная в митохондриях.
3.ТДФ принимает участие в окислительном декарбоксилировании кетокислот с разветвленным углеродным скелетом
(продукты дезаминирования валина, изолейцина и лейцина).
4.ТДФ – кофермент транскетолазы, которая переносит 2-хуглеродные фрагменты на втором
этапе пентозного цикла, что необходимо для предотвращения выведения пентоз из организма (если они не используются для синтеза ДНК или РНК)
5.Тиамин принимает участие в синтезе ацетилхолина, катализируя в пируватдегидрогеназной реакции образование ацетил-КоА – субстрата ацетилирования холина.
6.участвует в кроветворении и стероидогенезе.
Это подтверждается тем, что лечение анимий высокими дозами тиамина оказывается эффективным.
Строение:
5. Что такое оротоацидурия и возможные причины ее появления.
Оротоацидурия - Оротовая кислота представляет собой промежуточный метаболит в синтезе пиримидинов. В основе заболевания лежит блок метаболизма оротовой кислоты. Это вызвано снидением активности УМФсинтазы, катализирующей декарбоксилирования и образование ОМФ. Может также возникать при гипераммониемии (при нарушении орнитинового цикла) и в процессе лечения подагры аллопуринолом. У больных детей выявляется мегалобластная анемия, не поддающаяся лечению витамином С, фолиевой кислотой или витамином B12.
Уних экскретируется до 1,5 г/сут, оротовой кислоты с образованием в моче ее кристаллов.
Уэтих детей отмечалась также задержка роста и развития, но в клинической картине преобладали гематологические изменения, возможно, вследствие нарушения синтеза РНК и
