
Bilety2
.pdfБИЛЕТ 1
1. Холестерин как предшественник других стероидов. Биохимические основы развития атеросклероза.
Холестерин — предшественник других стероидов, а именно: кортикостероидов — гормонов, вырабатываемых корой надпочечников, регулирующих водно-солевой, белковый и углеводный обмены; половых гормонов, биосинтез которых представляет собой ряд последовательных ферментативных превращений холестерина; желчных кислот — органических кислот, входящих в состав желчи и представляющих собой конечные продукты обмена холестерина и играющие важную роль в процессах переваривания и всасывания жиров; витамина D — кальциферола, синтезирующегося также из холестерина, участвующего в поддержании гомеостаза кальция в организме и влияющего на дифференцировку клеток эпителиальной и костной тканей, кроветворной и иммунной систем.
Главная роль в развитии атеросклероза принадлежит липопротеинам низкой плотности (ЛПНП), которые осуществляют транспорт холестерина из печени в клетки, его должно быть строго необходимое количество, по превышению его уровня определяют риск возникновения атеросклероза.
2. Гликолиз, биологическое значание. послед. р- ций в анаэробных условиях. КПД кликолиза. Хинизм
Послед-ть фермент. р-ций, приводящих к превращ. глюкозы в ПВК с образованием АТФ.Анаэр. гликолиз – фермент. процесс распада глюкозы в тканях человека и животных без потребления кислорода. Конечным продуктом гликолиза является молочная
кислота. Биологическое значение процесса гликолиза заключается в образовании богатых энергией фосфорных соединений. В гексокиназной и фосфофруктокиназной реакциях гликолиза затрачиваются 2 молекулы АТФ. На последующих образуются 4 АТФ (фосфоглицераткиназная и пируваткиназная реакции). Т. о., энергетическая эффективность гликолиза в анаэробных условиях составляет 2 АТФ на 1 молек. глюкозы. В пр-е 1ой минуты работы благодаря анаэр. пр-су достигается гораздо большая мощность, чем при дальнейшей работе. Эритроциты вообще не имеют митохондрий, и их потребность в АТФ целиком удовлетворяется за счет анаэр. гл-за. Интенс. гл-из хар-н также для клеток злокач. опухолей. Протекает в гиалоплазме кл. 1ой фермент. р-цией гликолиза явл. фосфорилирование, катализируется гексокиназой. 2ой р-цией явл. превращ. глюкозо-6-фос-фата под действием глюкозо-6- фосфат-изомеразы во фруктозо-6-фосфат. 3я р- ция катализ. фосфофруктокиназой; фруктозо-6- фосфат фосфорилируется за счет 2ой молек. АТФ. В 4ой р-ции альдолаза расщеп. фруктозо- 1,6-бисфосфат на диоксиацетонфосфат и глицеральдегид-3 фосфат, далее происходит р- ция изомерации под дейст. триозофосфатизомеразы. Обр-м глицеральдегид-3-фосфата завершается 1ая стадия гл-за. 2ая – вкл. ок.-восст. р-цию (реакция гликолитической оксидоредукции), сопряж. с субстр. фосф-м, в пр-се к-го обр-ся АТФ. В 6ой р-ции в присут. глицеральдегидфосфатд/г, кофермента НАД и неорг. фосфата глицеральдегид-3-фосфат подвергается окислению с образованием 1,3- бисфосфоглицерата и НАДН. 7ая р-ция катализ. фосфоглицераткиназой, происходит передача фосфатной группы в положении 1 на АДФ с образованием АТФ и 3-фосфоглицерата. В 8ой р-ции 3-фосфоглицерат превращ. в 2-
фосфоглицерат.9ая катализ. енолазой, при этом 2-фосфоглицерат в результате отщепления молекулы воды переходит в фосфоенолпируват, а фосфатная связь в положении 2 становится высокоэргической. 10ая разрыв высокоэргической связи и переносом фосфатного остатка от фосфоенолпирувата на АДФ - субстратное фосфорилирование. Катализируется пируваткиназой. В 11ой р-ции восст. ПВК и образуется лактат при участии ЛДГ и НАДН, образовавшегося в 6 р-ции.
3, Биотин (витамин Н) и В12.
Источники. Биотин содержится почти во всех продуктах животного и растительного происхождения.
Биологическая роль: уч-ют в АТФ-зависимом карбокислировании ПВК в ЩУК в составе ферментов-лигазы
Уч-ет в капбокилировании пропионил КоА в метилмалонил КоА
Уч-ет в синтезе жирных кислот
Гиповитаминоз: себорея – гиперпродукция сальных желез. Воспаление волосяных луковиц. Поражение ногтей
Витамин В12 (кобаламин) Витамин В12 -
единственный витамин, содержащий в своём составе металл кобальт
Источники. Это единственный витамин, синтезируемый почти исключительно микроорганизмами.
Био роль: антианемический превращается в коферменты
1. метил-кобаламин и 5-ДАК.
Уч-ет в ресинтезе SAM из SAH. Уч-ет в синтезе Сукцинил КоА из метилмалонил КоА(сукцинилКоА+глицин ->синтез гема и
хромопротеидов). Для всасывания необходим фактор Кастла-гликопротеид желудка. Основной признак гиповитаминоза В12 - макроцитарная (мегалобластная) анемия. Характерно увеличение размеров эритроцитов, снижение количества эритроцитов в кровотоке, снижение концентрации гемоглобина в крови.
4.Специфичность действия ферментов. Классификация и номенклатура ферментов. Изоферменты.
Ферменты (энзимы)- это био катализаторы белковой природы. Катализатор - это вещество, которое ускоряет химическую реакцию, но само в ходе этой реакции не расходуется.
Специфичность - очень высокая избирательность ферментов по отношению к субстрату. За специфичность фермента ответственен как активный центр фермента, так и вся его белковая молекула. Активный центр фермента определяет тип реакции, который может осуществить данный фермент. Различают три вида специфичности: абсолютную, относительную, стереохимическую.
Абсолютная специфичность. Такой специфичностью обладают ферменты, которые действуют только на один субстрат
Относительная специфичность - это способность фермента действовать на группу субстратов с общим типом связи, т.е. относительная специфичность проявляется только по отношению к определенному типу связи в группе субстратов.
Стереохимическая специфичность - это способность фермента действовать только на один стереоизомер.
Все ферменты разделены на шесть главных классов:
Оксидоредуктазы — катализируют окислительно-восстановительные реакции.
Трансферазы — катализируют реакции межмолекулярного переноса химических групп и остатков.
Гидролазы — катализируют реакции гидролитического расщепления внутримолекулярных связей.
Лиазы — катализируют реакции присоединения групп по двойным связям и обратные реакции отрыва таких групп.
Изомеразы — катализируют реакции изомеризации.
Лигазы (синтетазы) — катализируют реакции соединения двух Молекул, сопряженные с расщеплением пирофосфатной связи в молекуле аденозинтрифосфата (АТФ) или аналогичного нуклеотидтрифосфата.
Каждый фермент, как правило, имеет две номенклатуры; одна из них рабочая (тривиальная), а другая -систематическая.
Рабочее наименоваие фермента составляют путем прибавления к корню слова латинского , греческого или химического названия субстрата, на который действует фермент, или к названию процесса, катализируемого данным ферментоа окончания “-аза”. Вещество, имеющее это окончание, принимают за фермент. Ферменты, действующие на крахмал (amylum), сахарозу, мочевину (urea), пептиды получили соответственно названия : амилаза, сахараза, уреаза,пептидаза; ферменты, катализирующие процессы гидролиза называют гидролазами, процессы окисления - оксидазами, перенос групп - трнсферазами и т.д. Для некоторых ферментов сохранены названия, неподчиняющиеся этому правилу: пепсин, трипсин, химотрипсин папин и др.
Систематическая. В принятой классификации все ферменты на основании катализируемых реакций разделены на шесть классов, расположенных в следующем порядке: 1) оксидоредуктазы, 2) трансферазы, 3) гидролазы,
4) лиазы, 5) изомеразы, 6) лигазы (синтетазы). Каждый класс подразделяется на подклассы, а каждый подкласс - на подподклассы.
Индивидуальный фермент имеет кодовое число (шифр) со стоящими перед ним буквами КФ (англ. ЕС). Шифр каждого фермента содержит четыре числа, разделенных точками. Первое число указывает к какому из шести классов принадлежит данный фермент. Второе число обозначает подкласс. Третье число обозначает подподкласс, а четвертое - порядковый номер фермента в данном подподклассе.
Изоферменты. генетически детерминированные молекулярные формы ферментов, которые катализируют одну и туже реакцию, но различаются по каталитической активности, что связано с различиями в структуре. Выполняют регуляторнуб роль в метаболизме.
БИЛЕТ 2
Протеиногенные аминокислоты, классификация, структура, физико-химическик свойства. Первичная структура белков. Незаменимые аминокислоты. Представление об азотистом балансе и его состоянии и зависимости от возраста и вида патологии. Квашиоркор.
Классификация
1)По радикалу(неполярные (АЛАНИН, ВАЛ, ИЗОЛЕЙ, ЛЕЙ, ПРОЛИН, МЕТИОНИН, Ф/А, ТПФ) Полярные незаряженные при(ГЛИЦ, СЕР, ТРЕО, ЦИС, АСПАРАГИН, ГЛУТАМ
ИН, ТИР) Полярные заряженные отрицательно (АСПАРАТ, ГЛУТАМАТ) Полярные заряженные положительно: (ЛИЗ, АРГИНИН, ГИСТИДИН)
2)По способности организма синтезировать из предшественников
-Незаменимые валин, изолейцин, лейцин, треонин, метионин,
лизин, фенилаланин, триптофан, аргинин,гистид ин-Заменимые глицин, аланин, пролин, серин, цистеин, аспарта
т, аспарагин, глутамат, глутамин, тирозин.
Физические свойства
Все они кристаллические вещества, лучше растворяются в воде, чем в органических растворителях, имеют достаточно высокие температуры плавления. Особенности физических и химических свойств аминокислот обусловлены их строением — присутствием одновременно двух противоположных по свойствам функциональных групп: кислотной и
основной. α-Аминокислоты являются амфотерными электролитами.
Общие химические свойства
Все аминокислоты амфотерные соединения, они могут проявлять как кислотные свойства, обусловленные наличием в их молекулах карбоксильной группы —COOH, так
и основныесвойства, обусловленные аминогруппой —NH2. Аминокислоты взаимодействуют с кислотами и щелочами
Первичная структура белка:
Первичной, самой простой является полипептидная цепь, т.е. нить аминокислот, связанных между собой пептидными связями. В первичной структуре связи являются ковалентными, а следовательно прочными.
Азотистый баланс — это соотношение количества азота, поступившего в организм с пищей и выделенного.
Положительный азотистый баланс —между количеством азота, введенного с белками пищи, и количеством азота, выводимым из организма, существует определенная связь. Увеличение поступления белка в организм приводит к увеличению выделения азота из организма. У взрослого человека при адекватном питании, как правило, количество введенного в организм азота равно количеству азота, выведенного из организма. Это состояние получило название азотистого равновесия.
Отрицательный азотистый баланс отмечается при белковом голодании, а также в случаях, когда в организм не поступают отдельные необходимые для синтеза белков аминокислоты.
Квашиокор:
«болезнь ребенка, отнятого от груди сразу после рождения». Перевод ребенка с молочной диеты на пищу, содержащую крахмал, приводит к белковой недостаточности.
2.Особенности пентозфосфатного пути превращения глюкозы в жировой ткани и эритроцитах млекопитающих.
Вжировой ткани – для синтеза жирных кислот
Вэритроците - для восстановления глутатиона – SH (инактивация активного кислорода, вызывающее преджевременный лизис)
3.Синтез жирных кислот. Сопоставление путей синтеза и распада жирных кислот.
Синтез Жирных Кислот - ЖК синтезируются из АцетилКоА, который карбоксилируетсяпри участии вит. Н в МалонилКоА, за счет которого за 1н цикл цепь ЖК удлиняется на 2 углеродных атома , а также происходит дважды восстановление по β у /а при участии НАДФНН +
– зависимых редуктаз ( НАДФНН+ из апотомического распада г люкозы). Синтез ЖК происходит при участии мультиферментной системы - Пальмит оил синтазы , состоящей из
2х
антипараллельных протомеров, каждый из которых включает АПБ Ацилпереносящий
белок, кофермент 4 фосфопантотеин, и
содержит 6 доменов: 3 из которых обеспечивают удлинение растущей цепи ЖК на 2 у/а, а 3 – НАДФНН+ зависимое β– восстановление.Для удлинения ЖК свыше С16 используются АцетилКоА и ПропионилКоА в МХ. Ненасыщенные ЖК ( олеиновая, пальмитолеиновая) образуются из насыщенных ЖК при участии цитохрома в5 и АцилКоАдесатуразы.
Особенности строения НАДФ+ и его роль в метаболизме.
 НАДФ+ никотианмид обр. в печени из триптофана. Витамин РР - предш коферментов НАД и НАДФ, входящих в состав дегидрогеназ и редуктаз. НАДФ имеет третий остаток фосфорной к-ты в полож. 2' рибозы аденилового нуклеотида. Спос-ть НАДФ переносить электроны и протоны от окисляемого субстрата к другому акцептору обесп-т выполнение этими коферм. важной биол. ф-ции в процессе клеточ. дыхания.Перен. эл. в процессах, связ. с извлечением энергии из поступ. в орг-м молек.
НАДФ+ никотианмид обр. в печени из триптофана. Витамин РР - предш коферментов НАД и НАДФ, входящих в состав дегидрогеназ и редуктаз. НАДФ имеет третий остаток фосфорной к-ты в полож. 2' рибозы аденилового нуклеотида. Спос-ть НАДФ переносить электроны и протоны от окисляемого субстрата к другому акцептору обесп-т выполнение этими коферм. важной биол. ф-ции в процессе клеточ. дыхания.Перен. эл. в процессах, связ. с извлечением энергии из поступ. в орг-м молек.
НАДФ - аллостреич регул ферм. энерг. обм., ферм. ц. Кребса. р-ций глюконеогенеза
В сыворотке крови женщины 75 лет уровень триглицеридов 2.5 ммоль/л, глюкозы 8.5 ммоль/л, ХС-ЛПВП 1,5 ммоль/л. Ваш комментарий
Анализ триглицеридов используют в диагностике атеросклероза и других заболеваний. Норма – до 2 ммоль\л
Нормы уровня холестерина ЛПВП для мужчин — 0,7—1,73 ммоль/л, для женщин уровень холестерина крови в норме- 0,86—2,28
ммоль/л. Определение глюкозы — обязательный этап в диагностике сахарного диабета.
Концентрация глюкозы в крови регулируется гормонами: инсулин является основным гормоном поджелудочной железы. При его недостатке уровень глюкозы в крови повышается, клетки голодают. Норма глюкозы у детей до 14 лет — 3,33 — 5,55 ммоль/л, у взрослых норма глюкозы в крови — 3,89 — 5,83 ммоль/л, с 60 лет уровень глюкозы в норме возрастает
до 6,38 ммоль/л. Повышенное содержание глюкозы указывает на гипергликемию (диабет), а повышенное содержание тагов и холестерина указывает на развитие атеросклероза
БИЛЕТ 3
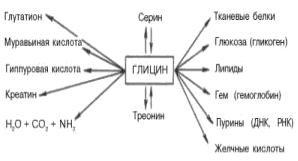
Основные пути метаболизма глицина. Глицин как донор углеродных фрагментов для биосинтезов.
Глюкоза – важнейший метаболит углеводного обмена. Общая схема источников и путей расходования глюкозы в организме. Взаимопревращение углеводов и его роль в клеточном метаболизме.

Классификация фосфолипидов и пути их биосинтеза. Значение фосфолипидов в жизнедеятельности клетки, участие их в передаче гормонального сигнала.
В зависимости от входящего в их состав многоатомного спирта принято делить фосфолипиды на три группы:
1.глицерофосфолипиды (глицерофосфатиды) - содержат остаток глицерина:
фосфатидилхолин (лецитин),фосфатидилэтанола мин (кефалин),фосфатидилсерин, кардиолипин
2.фосфосфинголипиды - содержат остаток сфингозина: сфингомиелины
3.фосфоинозитиды - содержат остаток инозитола, фосфатидилинозитол
Функция ФАД связана с окислительными путями клетки, в частности с процессом дыхания, в
Наиболее важными среди поверхностноактивных фосфолипидов можно считать лецитин или фосфатидилхолин (ФХ).Его основным предшественником называют фосфатидную кислоту (ФК), которая превращается в ФХ либо через диацилглицерин, либо через цитидинфосфат-диацилглицерин, фосфатидилсерин (ФС), фосфатидилэтаноламин
(ФЭА).
Фосфолипиды являются важной частью клеточных мембран. Они обеспечивают
текучие и пластические свойства мембран клеток и клеточных органоидов. Входя в состав клеточных оболочек, они имеют существенное значение для их проницаемости и обмена веществ между клетками и внутриклеточным пространством.
Через наружную клеточную мембрану внутрь клетки поступают все питательные вещества, некоторые гормоны, витамины, биологически активные вещества, и в то же самое время выделяются продукты жизнедеятельности, токсины.
Строение ФАД и его роль в клеточном метаболизме.
котором ФАД играет роль одного из переносчиков водорода в дыхательной цепи.
При исследовании крови пациента было обнаружено повышенное содержание креатинфосфокиназы (КФК-МВ). Ваш комментарий.
Креатинфосфокиназа (КФК) — фермент, участвующий в реакциях энергообразования и содержащийся в наибольшем количестве в сердечной и скелетной мускулатуре.
Повышение активности отмечается при различных повреждениях сердечной и
скелетной мускулатуры — инфаркте миокарда, миокардите, аритмии сердца, прогрессирующей мышечной дистрофии, а также при нарушении мозгового кровообращения, интенсивной нагрузке, приеме алкоголя и некоторых лекарств. Практически все ферменты имеют молекулярные разновидности — изоферменты. У КФК имеется 3 изоформы. В норме они имеют соотношение: I(BB) — мозг=0, II(MB) - 4-6%, III(MM) — 94-96%.-мышцы
Увеличение II (MB) изоформы происходит в течение первых суток после инфаркта миокарда и 100% подтверждает этот диагноз, однако уже через 2-3 суток происходит нормализация активности фермента, и спустя 2-3 дня после развития инфаркта такой анализ уже не назначается
БИЛЕТ 4
Трансляция – как процесс реализации генетической информации в структуру синтезируемых рибосомах полипептидный цепей.
Трансляция — процесс синтеза белка из аминокислот на
матрице информационной (матричной)
РНК (иРНК, мРНК), осуществляемый рибосомой.
Двигаясь вдоль молекулы мРНК, рибосома синтезирует белок в соответствии с информацией, заложенной в молекуле мРНК.
Для узнавания аминокислот в клетке имеются специальные «адаптеры», молекулы транспортной РНК (тРНК). Эти молекулы, имеют участок (антикодон), комплементарный кодону мРНК, а также другой участок, к которому присоединяется аминокислота, соответствующая этому кодону. Присоединение аминокислот к тРНК осуществляется в энергозависимой реакции ферментами аминоацил-тРНК-синтетазами, а
получившаяся молекула называется аминоацилтРНК. Таким образом, специфичность трансляции определяется взаимодействием между кодоном мРНК и антикодоном тРНК, а также специфичностью аминоацил-тРНК- синтетаз, присоединяющих аминокислоты строго к соответствующим им тРНК
Процесс трансляции разделяют на
инициацию — узнавание рибосомой стартового кодона и начало синтеза.
элонгацию — собственно синтез белка.
терминацию — узнавание терминирующего кодона (стоп-кодона) и отделение продукта.
Синтез гликогена и гликогенолиз
.биологическое значение,роль процессов и роль печени в их реализации.
Гликолиз та огромная формула начинается с “глюкоза под действием гексокиназы превращается в глюкозоо-фостфат” ее нереально не помнить
Распад гликогена (гликонеолиз) или его мобилизация происходит в ответ на повышение постребности организма в глюкозе.В первых реакциях учавствует (ф гликогенфосфорилаза) обеспечивающая последовательное
отщепление глюкозы от полисахарида,до того момента пока не останется 4 молекулы,далее продукт действия (ф гф) глюгоза-1 фосфат в глюкозо-6-фосфат (ф фосфоглюкомутаза) далее (ф глюкозо-6-фосфатаза) превращение в глюкозу и далее в кровь.
Биологоческое значение:печень запасает глюкозу ввиде глюкогена ,не столько для собственных нужд,сколько для поддержания постоянной концентрации глюкозы в крови,и обеспечение поступления ее в другие ткани;мышечный гликоген освобождает грюкозо-6-фосфат,потребляемый самой мышцей для окисления и использования энергии;распад гликогена до г-6-ф не требует энергии;необратимость процессов синтеза и распада гликогена обеспечивается их регуляцией.
3. Бета-окисление жирных кислот с четным и нечетным числом углеродных атомов. Энергетический распад окисления жирных кислот.
β-окисление жирных кислот (ЖК) (в МХ) – распад ЖК (с четным числом углеродных атомов) до n/2 АцетилКоА, при этом за 1н βцикл синтезируется 14 АТФ (10 – за счет ц. Кребса + 1,5 и 2,5 – за счет восстановленных ФАДН2 и НАДНН+). При βокислении ЖК с нечетным числом у/а последней образуется молекула – ПропионилКоА, которая при участиивитаминов Н и В12 превращается в Сукцинил КоА и, взаимодействуя сглицином, включается в синтез гема (гемсодержащие хромопротеиды: Нв, Mв, цитохромы, каталаза, пероксидаза). При β- окислении ненасыщенных ЖК дополнительно участвуют 2 фермента: (3,4цис)→(2,3транс)- еноилКоАизомеразаи βгидроксиацилКоАэпимераза.
4. Фосфопиридоксаль и его роль в клеточном метаболизме. Представление о реакциях трасаминирования
формула отдельная
Пиридоксалевые ферменты играют ключевую роль в обмене аминокислот
Коферментные формы витамина В6 включены в реакции, катализируемые почти всеми классами ферментов. Наиболее значительная группа пиридоксалевых ферментов – аминотрансферазы
Пиридоксальзависимые ферменты (пиридоксалевые ферменты) катализируют взаимопревращения и распад аминокислот (регулируют аминокислотный состав крови при разном аминокислотном составе пищи), участвуют в специфических реакциях метаболизма отдельных аминокислот (серина, треонина, триптофана)
Участвуют в обмене липидов, синтезе сфинголипидов. В качестве кофактора ферментов участвуют в начальных стадиях синтеза гемма.
Влияют на обмен жирных кислот.
Синтез и распад гормонов щитовидной железы происходит с участием аминотрансфераз иодтирозинов и иодтиронинов.
Биосинтез гема поисходит при помощи синтазы дельта-аминолевуленовой кислоты, содержащей пиридоксальфосфат как кофермент
Эндогенный синтез витамина РР из триптафана (кинурениназа и кинуренинаминотрансфераза).
Биосинтез сфинголипидов (из серина и пальмитоил-КоА) – синтаза 3- кетодигидросфингозида.
