
Bilety2
.pdfразлич. органах рядом изоферм. . сост. из 4 типов субъед 2 типов М и Н. Катал. р-цию обр. лактата из пвк.
ЛДГ1 - 4Н - эритр, лейкоциты. миок, почки
ЛДГ2 - 3Н1М - эритр, лейкоциты. миок, почки
ЛДГ3 - 2Н2М - лимф. тк., тромбоц, опухоли
ЛДГ4 - 1Н3М - печень. скел. м-цы. неопластич. тк.
ЛДГ5 - 4М - печень. скел. м-цы. неопластич. тк.
Креатинкиназа катал. перенос. фосф. ост. между креатином и АТФ. Сост. из 2 субъед. М-мышечный тип, В-мозговой тип. Изоферменты ММ-мышеч., МВ - гибридный. хар-й для миок., ВВ-локализ. в мозг. тк.
Некот. Ф. органоспецифичны - липаза, катал. деградацию жиров в адипоцитах, регул. ур. жир. к-т в плазме, органоспец. для подж. ж-зы. при панкреатите ее ур. повыш. Амилаза гидролизир 1.4 а- гликозидные связи крахмала. гликогена. Различ. панкреат. и слюнную.
Изменение активности ф. в пр-се развития.
АлАТ катализ. трансаминир между аспартатом и а-кетоглуторатом, и АсАТ, катал. трансам. между аланином и а-кетоглуторатом, в кач-ве кофермента сод. пиридоксальфосфат, сод-е к-го с возр. сниж.
Щелочная фосфатазамембранный металлоферм., в сост.акт. ц. входит цинк. присут. в кажд. органе, осн. ист. гепатобилиарное дерево и остеобласты, в выс. конц. в костях. мышцах. печени, почках, плаценте. Наиб высокая акт в период н/р и дет., ее роль важна в пр-х кальцификации.
Изоферменты – это семейство ферментов, которые катализируют одну и ту же реакцию, но отличаются по строению и физикохимическим свойствам. Например: лактатде гидрогеназа (ЛДГ) состоит их 4 субъединиц 2хтипов: субъединица Н, выделенная из сер дечной мышцы (heart – сердце), субъединица М, выделенная из скелетных мышц (musculus – мышца). Эти субъединицы кодируются разными генами. В разных органах имеются различ ные формы ЛДГ с различным набором субъединиц.
Энзимодиагностика - определение актив. ф. в биологич. жид-тях. для постановки диагноза забол. Исслед. наличие Ф.. вып. в норме ф-цию внутри клеток или явл. секретор. в-вами и не вып. метаб. ф-ций в плазме. В N акт. этих ферм. в плазме незнач., но при повр. кл. или ихх избыт. пролиферации. увелич. Для повыш. специф. исслед.. исслед изоф.
Представление о пентозфосфатном пути превращения глюкозы. Окислительные реакции (до стадии
рибулозо-5-фосфата). 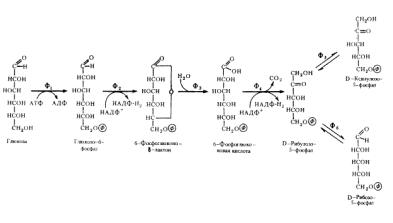
Механизм биосинтеза жирных кислот в животных клетках.
Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-кар- боксилаза. Фермент содержит в качестве простетической группы биотин. Реакция протекает в два этапа: I – карбоксилирование биотина с участием АТФ и II – перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА. Малонил-КоА представляет собой первый специфический продукт биосинтеза жирных кислот. В присутствии соответствующей ферментной системы малонил-КоА быстро превращается в жирные кислоты.
Далее цикл реакций повторяется. По сравнению с β-окислением биосинтез жирных кислот имеет ряд характерных особенностей: синтез жирных кислот в основном осуществляется в цитозоле клетки, а окисление – в митохондриях; участие в процессе биосинтеза жирных кислот малонил-КоА, который образуется путем связывания СО2 (в присутствии биотин-фермента и АТФ) с ацетил-КоА; на всех этапах синтеза жирных кислот принимает участие ацилпереносящий белок (HS-АПБ); при биосинтезе образуется D(–)-изомер 3-гидроксикис-лоты, а не L(+)-изомер, как это имеет место при β-окислении жирных кислот; необходимость для синтеза жирных кислот кофермента НАДФН.
Аспарагиновая и глутаминовая кислоты, основные пути метаболизма, биологическое значение глутатиона.
Аспарагиновая к-та участвует в р-циях трансаминирования, в синтезе мочевины явл. донором NH2, в синтезе пуриновых и пиримидиновых оснований. синтезе аспарагина.
Глутаминовая к-та подверг прямому окислит. зезаминированию с образованием а-кетоглутората. Вступают в р-ции трансаминирования. Явл. субстратом для синтеза глютамина.к-й явл. транспортной формой аммиака, уч. в синтезе мочевины в печени, пуриновых оснований нуклеотидов, АК, аминосахаров, участвует в синтезе трипептида глутатиона, явл. субстратом для синтеза ГАМК.
Обе АК участ. в формир. третич. и четвертич. струк. белков, т.к. являются полярными заряженными АК, и в обр-ии гидратной об-ки белков, формировании актив. центров ферментов.
Глутатион - трипептид, состоящий из глутаминовой к-ты, цистеина, глицина. Связывает токсины с желчью, участвует в тканевых дыхательных процессах. Уч. в образовании "правильных" дисульфидных связей в белках и гормонах. Функционирут в кач-ве кофермента в различ. окислит-восст. р-циях.
В крови пациента обнаружен высокий уровень молочной и пировиноградной кислот. При каких нарушениях это происходит?
Повышение уровня молочной кислоты в крови, обусловленное гипоксией, наблюдается при тяжелой физической нагрузке, шоке, кровотечении, сепсисе, инфаркте миокарда, тромбоэмболии легочной артерии, остановке сердца. При отсутствии явных причин нарушения тканевой перфузии причиной повышенного содержания молочной кислоты в крови могут быть такие заболевания, как сахарный диабет, лейкоз и лимфомы, поражение печени, почечная недостаточность, а также недостаточность некоторых ферментов (болезнь Гирке - дефицит глюкозо-6фосфатазы, недостаточность фруктозо-1,6- бисфосфатазы). Лактатацидоз может развиться после приема больших доз ацетаминофена и этанола, а также после внутривенного введения адреналина, глюкагона, фруктозы или сорбитола.
БИЛЕТ 35
1. Специфичность ферментов. Уровни регуляции активности ферментов.
Под специфичностью ферментов понимают способность каждого из них катализировать одну или несколько близких по природе химических реакций.
1. А б с о л ю т н а я с п е ц и ф и ч н о с т ь. При этом типе специфичности фермент катализирует превращение только одного субстрата.
2.Г р у п п о в а я с п е ц и ф и ч н о с т ь. Основным признаком для ферментов этого типа специфичности служит характер разрушаемой или создаваемой связи в близких по строению группах веществ.
3.С т е р е о х и м и ч е с к а я с п е ц и ф и ч н о с т ь. Ферменты этого типа специфичности действуют на определенный изомер одного и того же вещества: D- или L-, a- или b- , трансили цис- . Пептидгидролазы действуют только на пептиды, образованные аминокислотами L-ряда.
Основные способы регуляции активности ферментов:
аллостерическая регуляция;
регуляция с помощью белок-белковых взаимодействий;
регуляция путём фосфорилирования/дефосфорилирования молекулы фермента;
регуляция частичным (ограниченным) протеолизом
Аллостерическими ферментами называют ферменты, активность которых регулируется не только количеством молекул субстрата, но и другими веществами, называемыми эффекторами.
Регуляция каталитической активности ферментов белок-белковыми взаимодействиями. Некоторые ферменты изменяют свою каталитическую активность в результате белок-белковых взаимодействий.
Регуляция каталитической активности ферментов ассоциацией/диссоциацией протомеров
Протеинкиназы - группа ферментов, катализирующих перенос остатка фосфорной кислоты с АТФ на специфические ОН-группы аминокислотных остатков белков (вызывают фосфорилирование белков).
Регуляция каталитической активности ферментов путём фосфорилирования/дефосфорилирования
фосфорилирование/дефосфорилирование. Модификации подвергаются ОН-группы фермента. Фосфорилирование осуществляется ферментами протеинкиназами, а дефосфорилирование - фосфопротеинфосфатазами. Присоединение остатка фосфорной кислоты приводит к изменению конформации активного центра и его каталитической активности. При этом результат может быть двояким: одни ферменты при фосфорилировании активируются, другие, напротив, становятся менее активными.
2. Аэробное окисление глюкозы и его преимущество перед анаэробным. (гликолиз на листочках!)

Аэробный гликолиз - процесс окисления глюкозы с образованием двух молекул пирувата; общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле. Главный путь утилизации глюкозы. При расщ. 1 молекулы глюкозы в тканях синтезируется 38 молекул АТФ. Часть углеводов, поступ. с пищей, превращ. в орг. в жиры, особенно если количество углеводов превышает необх. для возобновления запасов гликогена в печени и мышцах. Глюкоза служит источником ацетил-КоА, из которого синтезируются жирные к-ты. Необходимый для восстановительных реакций НАДФН поставляется за счет окисления глюкозы в пентозофосфатном пути, а также за счет дегидрирования яблочной кислоты НАДФ-зависимой малатдегидрогеназой. Глицерол-3-фосфат получается путем восстановления диоксиацетонфосфата — промежуточного продукта гликолиза. Синтез жиров из углеводов наиболее активно происходит в печени, жировой ткани и лактирующих молочных железах .
3. Витамин А и аскорбиновая кислота. Их строение и физиологические функции.
Витамин а |
Аскорбиновая кислота |
А – антиксерофтальмический (структурные аналоги: ретинол, ретиналь, ретиноевая кислота.
Провитамин - β–каротин). Биологическая роль: 1. участвует в фотохимическом процессе световосприятия в форме 11-цис-ретиналь, входящего в состав хромопротеидов – родопсин и йодопсин, выполняющих функцию светочувсвительных пигментов палочек и колбочек сетчатки глаза.2. регулирует нормальный рост и дифференцировку клеток развивающегося организма и быстро пролифирирующих клеток. 3. ретиноевая кислота стимулирует рост мягких тканей и костей, контролирует синтез белков цитоскелкта. 4. является структурным компонентом биомембран. 5. влияет на барьерную функцию кожи и слизистых, на проницаемость биомембран. 6. β–каротин и в меньшей степени в.А тормозят ПОЛ (перекисное окисление липидов), что способствует предупреждению развития катаракты. 7. стимулирует клеточный иммунитет. Гиповитаминоз: Наиболее ранним симптомом является нарушение темновой адаптации («куриная слепота»), поражение кожи (шелушение и сухость, активация гнойных процессов
Гипервитаминоз: выпадение волос, ↓ аппетита, тошнота, рвота, воспаление глаз, головные боли, бессонница, боли в мышцах и суставах, себорея, кейлозис, ломкость костей.
С – аскорбиновая кислота (антицинготный, антискорбутный).
Биологическая роль: 1. витамин С в составе моноксигеназ (I класс ферментов) участвует в гидроксилировании субстратов, например, а). в гидроксилировании дофамина в норадреналин, б). в гидроксилировании триптофана в серотонин, в). гидроксилировании пролина и лизина при посттрансляционном созревании коллагена, 2. участвует в распаде Нb (в реакции окисления гема по α– метеновой связи между А и В пиррольными кольцами), 3. в синтезе кортикостероидов из холестерина, 4. в синтезе желчных кислот из ХС, 5. восстанавливает Fе3+ в F2+, что необходимо для всасывания

железа в кишечнике, для освобождения железа из связи с трансферрином и его поступления в ткани, и необходимо для освобождения железа из белков, его депонирующих – ферритин, гемосидерин); 6. поддерживает в восстановленной форме железо (F2+) в составе цитохрома Р450, участвующего в детоксикации ксенобиотиков, 7. защищает Нb и Мb от окисления, 8. участвует в антиоксидантной защите, обезвреживая свободные радикалы кислорода и защищая другие антиоксиданты от АФК – витамин Е, β-каротин; 9. участвует в антиоксидантной защите ферментов (НАДФНН+-зависимых фолатредуктазы и дигидрофолатредуктазы), обеспечивающих образование активной формы фолиевой кислоты – ТГФК, 10. имеет иммуностимулирующую активность (стимулирует клеточный и гуморальный иммунитет,↑миграцию лимфоцитов и синтез γ-интерферона). Гиповитаминоз (симптомы цинги)
4. Химическое строение триптофана и пути его метаболизма.
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии[2] и депрессии, но клинические испытания не дали окончательных результатов[3]. 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин или 5-HT). В связи с преобразованием 5-HTP в серотонин в печени, есть значительный риск появления пороков сердца от влияния серотонина на сердце
5.К чему приводит недостаточность витамина B12 у человека?
Витамин В12 (или цианокобаламин, кобаламин) — Большое количество витамина B12 необходимо селезенке и почкам, несколько меньше поглощается мышцами. Кроме того, витамин В12 содержится в молоке матери. Характеристика витамина В12: витамин B 12 необходим для образования и созревания эритроцитов витамин B12 влияет на нервную систему, поддерживая ее в здоровом состоянии, снижает раздражительность витамин Б 12 предотвращает появление анемии цианокобаламин участвует в
белковом, жировом и углеводном обмене кобаламин участвует в процессе усвоения, транспорта и распада фолиевой кислоты витамин B12 помогает увеличивать энергию витамин Б12 способствует росту и улучшению аппетита витамин B12 помогает улучшить концентрацию, память и равновесие. Содержат кобаламин продукты животного происхождения: печень, говядина, рыба, свинина, яйца, молоко, сыр, почки. При дефиците В12 в течение около 5—6 лет развивается В12 дефицитная анемия. Особенно подвержены В12 анемии вегетарианцы и любители диет, исключившие из свого рациона яйца и молочные продукты. При недостатке цианокобаламина происходят изменения в клетках костного мозга, полости рта, языка и желудочно-кишечного тракта, что ведет к нарушению кроветворения, появлению симптомов неврологических расстройств (психические расстройства, полиневриты, поражение спинного мозга). В12-дефицитная анемия (понижение уровня витамина В12) может привести к заболеваниям печени, почек, заболеваниям крови, онкологическим заболеваниям, лейкозам. Дефицит витамина В12 в молоке матери приводит к мегалобластической анемии у ребенка.
Билет 36
1. Классификация и номенклатура ферментов. Виды энзимопатологий. Наследственные энзимопатии
Оксиредуктазы катализ. ок-восст. р-ции путем переноса эл. или Н с одного субст. на другой. В кач. акцептора эл. исп НАД, НАДФ, ФАД, ФМН, гем, ионы металлов. Дегидрогеназы, оксидазы, гидроксилазы, Трансферазы катал. перенос функ. гр. с одного субст. на др. Гидролазы гидролизируют слож. хим. струк. до низкомолек. в-в, необх в пр-се перевар. пищи. Лиазы расщ. или обр. 2ые связи, без уч-я окисления или гидролиза, отщ от субстр. опр гр. при этом выд СО2, Н2О, NН3, Н2S. Коферм. м.б. пиридоксальфосат, ТДФ. Изомеразы катал. внутримолек. превращ. Коферм. пиридоксальфосфат, дезоксиаденилкобаламин, НАД. взаимопревращ. альдоз и кетоз, перемещ. двойных связей внутри молек. Внутремолек. перенос гр. осущ. мутазы. Лигазы (синтетазы) соед. 2 молек. за счет разрыва макроэргич.
связей. (в АТФ и др. нуклеозидфосфатах), или синтазы (в др. макроэрг. св)
1.Наследственные энзимопатии, связанные: а) с полным выпадением синтеза какого-либо фермента; б) с конституциональной слабостью отдельных
звеньев ферментных процессов.
2.Токсическая энзимопатия, обусловленные: а) избирательным угнетением активности отдельных ферментов; б) специфическим угнетением биосинтеза ферментов;
в) неспецифическим угнетением биосинтеза белка.
3.Алиментарные энзимопатии, вызванные:
а) дефицитом витаминов; б) дефицитом белка;
в) дефицитом микроэлементов; г) разбалансированностью рационов питани
2. Анаэробный распад глюкозы (анаэробный гликолиз). Гликолитическая оксидоредукция,
субстратное фосфорилирование. Биологическое значение анаэробного гликолиза.
Аэробный гликолиз включает - процесс окисления глюкозы с образованием 2 молекул ПВК, общий путь катаболизма, включающий превращение пирувата в ацетил-КоА и его дальнейшее окисление в цитратом цикле; В результате гликолиза образуется ПВК, который далее окисляется до СО2 и Н2О в цикле Креббса. Выход АТФ при окислении 1 моль глюкозы до СО2 и Н2О составляет 38 моль АТФ.В процессе аэробного распада глюкозы происходят 6 реакций дегидрирования. Реакции гликолитической оксидоредукции полностью обратимы. В отсутствие кислорода сколько НАДН2 образуется на 6-й стадии, столько же НАДН2 и отдаст свой водород на пируват. Поэтому в анаэробных условиях конечный продукт распада глюкозы — лактат. Гликолитическая оксидоредукция — сопряжение между 6-й реакцией (окисление ФГА) и 11-й реакцией (восстановление пирувата до лактата) гликолиза.
Субстратное фосфорилирование (биохимическое), синтез богатых энергией фосфорных соединений за счёт энергии окислительно-восстановительных реакций гликолиза (катализируемых фосфоглицеральдегиддегидрогеназой и енолазой) и при окислении a-кетоглутаровой кислоты в трикарбоновых кислот цикле (под действием a-кетоглутаратдегидрогеназы и сукцинаттиокиназы). Для бактерий описаны случаи С. ф. при окислении пировиноградной кислоты. С. ф., в отличие от фосфорилирования в цепи переноса электронов не ингибируется "разобщающими" ядами (например, динитрофенолом) и не связано с фиксацией ферментов в мембранах митохондрий. Вклад С. ф. в клеточный фонд АТФ в аэробных условиях
значительно меньше, чем вклад фосфорилирования в цепи переноса электронов.
3. Химическое строение желчных кислот и их роль в переваривании липидов
Желчные кислоты – это стероидные монокарбоновые кислоты, производные холановой кислоты, образующиеся в печени человека и животных и выделяющиеся с желчью в двенадцатиперстную кишку.
Первичные желчные кислоты - холевая кислота и хенодезоксихолевая кислота - синтезируются в
печени из холестерина, конъюгируются с
глицином или таурином и секретируются в составе желчи. Вторичные желчные кислоты, включая дезоксихолевую кислоту и литохолевую кислоту, образуются из первичных желчных кислот в толстой кишке под действием бактерий.
Желчные кислоты играют важную роль в
переваривании и всасывании липидов.
Желчные кислоты, соединяясь с последними, образуют холеиновые кислоты, хорошо растворимые в воде и поэтому легко всасывающиеся кишечными ворсинками в верхних отделах тонкой кишки. Холеиновые кислоты в виде мицелл всасываются из просвета подвздошной кишки внутрь клеток, сравнительно легко проходя мембраны клеток.
4. Механизм действия катехоламинов на клетки-мишени
Дофамин (Д), норадреналин (Н), адреналин(Адр)
-мозг- усил.кровотока, повыш обмена глюкозы;
-ССС- увелич, частоты и силы СС, сужение периферических сосудов;
-легочн.сист- повышен.снабжения кислор., расширен. Бронхов, увеличен.вентиляции;
-мышцы- повышение гликогенолиза и сократимости
-печень-повышен продукции глю, , сниж синтеза гликогена
-жир.ткань-повышение липолиза, увелич уровня жирн кислот и глицерола
-кожа- сниж кровотока
-скелетн м-цы-сниж поглащения и утилизации глю
-ЖКТ и мочеполов систсниж синтеза белка
-лимфоидная тканьповыш протеолиза.
5.В результате биохимического анализа крови
уровень мочевой кислоты у пациента оказался в два раза выше нормы. Ваш комментарий
Мочевая кислота выводит избыток азота из организма человека. Мочевая кислота синтезируется в печени и в виде соли натрия содержится в плазме крови.
Повышение мочевой кислоты или гиперурикемия — основной симптом первичной и вторичной подагры. Гиперурикемия может возникать из за нарушения фермента ФРДФ-
синтетаза, гипоксантингуанинфософорибозилтрансферраза (синлром ЛешиНихена) или аденинфосфорибоилтрансфераза.
В диагностике подагры анализ мочевой кислоты имеет важное значение. Поскольку первичная подагра может протекать бессимптомно, проявляясь только в повышении уровня мочевой кислоты. Вторичная подагра может быть вызвана нарушениями в работе почек, злокачественными образованиями, разрушениями тканей или голоданием. Первичная подагра развивается на фоне замедления вывода мочевой кислоты из организма или при преизбыточном синтезе мочевой кислоты. Кристаллы мочевой кислоты могут откладываться в суставах, подкожной клетчатке, почках. В результате развивается подагра, хронический артрит. Гиперурикемия вследствие вторичной
подагры наблюдается при таких заболеваниях, как: лейкоз, лимфома анемия, вызванная дефицитом витамина В12, некоторые острые инфекции (пневмония, скарлатина, туберкулез) заболевания печени и желчных путей сахарный диабет хроническая экзема псориаз крапивница заболевания почек токсикоз у беременных ацидоз вторичная «подагра алкоголика» (острое алкогольное отравление).
