
Bilety2
.pdf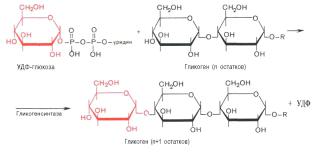
более высокий потенциал, чем предыдущее. Наруж. мембрана митох. проницаема для большинства мелких молекул и ионов, внутренняя почти для всех ионов (кроме протонов Н) и для большинства незаряженных молекул. Компоненты дых. цепи встроены во внутр. мембрану. Процессы ок. и образования АТФ из АДФ и фосфорной к-ты т.е. фосфорилирования протекают в митох. Внутр. мембрана образует множество складок - крист. Про-во органиченное внутренней мембраной - матриксом. Пр-во между внутр. и наруж. мембранами наз. межмембранным. Протоны, перенесённые из матрикса в межмембранное пр-во, не могут вернуться обратно в матрикс. Создаётся протонный градиент, при котором концентрация протонов в межмембранном пространстве больше, а рН меньше, чем в матриксе. В дыхат. цепи есть только 3 участка - уч-ки сопряжения и фосфолирования, где перенос электронов сопряжен с накоплением энергии, достаточным для обр-я АТФ, на др. этапах возник-я разн. потенциалов для этого прса недостаточна. Теория сопряжения Митчела - ок-е субстрата и фосфолир-е АДФ через протонный градиент. Часть энергии эл.
трансформир. в энергию трансмембранного электрохим. потенциала, созд-го путем перекачки протонов из матрикса митох. в межмебр. пр-во. В дальнейшем протоны через канал сопрягаещего устройства возвр. в матрикс, конц. протонов выравнивается, мембрана разряж., а энергия трансмемранного потенциалал исп. для синт. АТФ.
Пути синтеза полисахаридов на примере гликогена. Роль УТФ в синтезе полисахаридов. Гликогенозы и биохимические механизмы их возникновения.
Роль УТФ в синтезе полисахаридов.
В силу обратимости реакции глюкозо-6-фосфат ↔ глюкозо-1-фосфат синтез гликогена из глюкозо-1-фосфата и его распад оказались бы также обратимыми и поэтому неконтролируемыми. Чтобы синтез гликогена был термодинам. необратимым, необходима дополнительная стадия образования уридиндифосфатглюкозы из УТФ и глюкозо-1- фосфата. Нуклеотидная часть УДФ-глюкозы играет существенную роль в действии гликоген синтазы, выполняя функцию "рукоятки", при помощи которой фермент располагает глюкозу в полисахаридной цепи в нужном положении. Необходима для узнавания субстрата при катализе.
Гликогенозы. гр. наслед. заб., обусловленная недостат. 1 или неск. ферментов, уч-х в синтезе или распаде гликогена.
Гликогеноз I типа (болезнь Гирке) - дефект синтеза глюкозо-6-фосфатазы. Набл. отсут. аппетита, рвота, гипогликемия. Гепатомегалия и нефромегалия за счет гликогенной инфильтрации. Отставание в росте, диспропорция формы тела, гипотония м-ц, пол. созр. задерж. Нервно – психич. разв. удовл В крови повыш. ур. пвк и лактата
Образование кетоновых тел и основные причины усиления кетогенеза
При низком соотношении инсулин/глюкагон в крови в жир. тк. акт. распад жиров. Жир. к-ты поступ. в печень в большем кол-ве, чем в норме,
поэтому увеличивается скорость β-окисления. Ск-ть реакций ЦТК в этих условиях сниж., т. к. оксалоацетат исп-ся для глюконеогенеза. В резте ск-ть образования ацетил-КоА превышает способность ЦТК окислять его. Ацетил-КоА накапл. в митохондриях печени и используется для синтеза кетоновых тел. Синтез кетоновых тел происходит только в митохондриях печени. При длительном голодании кетоновые тела становятся основным источником энергии для скелетных мышц, сердца и почек. Глюкоза сохр. для ок-я в мозге и эритроцитах. Уже через 2-3 дня после начала голодания конц-ция кет. тел в крови достаточна для того, чтобы они проходили в клетки мозга и окислялись, снижая его потребности в глюкозе. β-Гидроксибутират), попадая в клетки, дегидрируется НАДзависимой ДГ и превращ. в ацетоацетат. Ацетоацетат активируется, взаимодействуя с сукцинил-КоА - донором КоА:
Ацетоацетат + Сукцинил-КоА → АцетоацетилКоА + Сукцинат.
Ок-е 1 молек. β-гидроксибутирата до СО2 и Н2О обесп-т синтез 27 молекул АТФ.
Прогестерон, роль в метаболизме и лалала
. Прогестерон сост из 18 ат. С. Эти горм выз. разв. вторич. пол. признаков., прог. подгот. слиз. об. матки к имплант. яйцекл., торм. овуляцию и стимул. разв. тк. молоч. ж-зы. Эстрогены оказ. анаболич. дейст., стимул. синтез белка. Связ. с внутриклет. рецеп. и регулир. транскрип. генов подобно стер. горм.
Количество прямого билирубина в крови у больного мужчины 30 лет оказалось равным 50 с чем-то мкМ. Возможные причины этого явления. Билирубин - важнейший красножелтый пигмент желчи, образуется в результате распада гемоглобина в ретикулоэндотелиальных клетках печени, селезенки и костного мозга. Билирубин является обычным компонентом плазмы крови, где он присутствует в виде двух фракций вместе составляющих общий билирубин крови: Прямой (связанный, или конъюгированный) билирубин и Непрямой (свободный, несвязанный или неконъюгированный) билирубин Прямой билирубин: 0.0 – 4.3 мкмоль/л : повышение общего и прямого (связанного) билирубина в сыворотке крови - гемолитическая ( дети, гемолиз эритроцитов при нарушении в них пентозного пути) и печеночно-клеточная желтухавозникает при: острых и хронических диффузных заболеваниях печени, первичный и метастатический рак печени, первичный билиарный цирроз печени,токсическое повреждение печени лекарственные отравления
БИЛЕТ 19
1. Физико-химические свойства белков. Их
классификация. Потребность |
Белки обладают: |
в белках. Азотистый баланс. |
амфотерностью, |
Белковая недостаточность. |
растворимостью и |
Квашикор |
денатурацией. |
Амфотерность , то есть в зависимости от условий проявляют как кислотные, так и свойства основные.
Растворимость , то есть белки различаются по степени растворимости в воде. Водорастворимые белки называются альбуминами, к ним относятся белки крови и молока. К нерастворимым, или склеропротеинам, относятся, например кератин и фиброин. Растворимость белка определяется не только его структурой, но внешними факторами, такими как природа растворителя, ионная сила и pH раствора.Белки также делятся на гидрофильные и гидрофобные (водооталкивающие). К гидрофильным относится большинство белковцитоплазмы, ядра и межклеточного вещества, в том числе нерастворимые кератин и фиброин. К гидрофобным относится большинство белков, входящих в состав биологических мембран .
Денатурацией белка называют любые изменения в его биологической активности и/или физикохимических свойствах, связанные с потерей четвертичной, третичной или вторичной структуры .
Потребность человека в белке определяется интенсивностью процессов его обновления в тканях организма и зависит как от индивидуальных особенностей организма, пола, возраста, роста и т. п., так и от трудовой деятельности человека. Оптимальные количества белка в питании должны не только поддерживать азотистое равновесие, но и обеспечивать сопротивляемость организма к инфекциям и другим вредным агентам внешней среды, способствовать улучшению здоровья и повышению работоспособности.
Потребность растущего организма в белке значительно выше и зависит от возраста.
в 2—3 года — 4 грамма,
в 3—5 лет — 3,8,
в 5—7 — 3,5 грамма
и т. п.
Такая высокая потребность в белке у детей объясняется
тем, что в растущем
организме преобладают синтетические процессы, и белок пищи необходим не только для поддержания азотистого равновесия, но и
для обеспечения роста и формирования тела.
Азотистый баланс – разница между введением с пищей азота и выведением его в виде конечных продуктов азотистого обмена.
Различают 3 вида азотистого баланса:
1.Положительный –
количество выводимого из организма азота меньше
количества азота, вводимого
с пищей. Азот остается в организме и расходуется на синтез белков. Характерен для растушего организма и во время беременности.
2.Отрицательный –
количество выделяемого азота превышает количество азота, поступающего в течение суток. Встречается при голодании, белковой недостаточности, тяжелых заболеваниях, когда происходит интенсивный распад белков тела. Отрицательный азотистый баланс наблюдается у пожилых людей.
3.Азотистое равновесие –
количество азота выводимого из организма, равно количеству получаемого с пищей азота. Характерно для здорового взрослого человека.
Квашиоркор — вид тяжёлой дистрофии на фоне
недостатка белков в пищевом рационе. Болезнь обычно возникает у детей 1-4 лет, хотя бывает, что она возникает и в более старшем возрасте (например, у взрослых или у более старших детей).
Когда ребёнка кормят грудью, он получает определённые аминокислоты , необходимые для роста, из материнского молока. Когда ребёнка отлучают от груди, в случае, если продукты, заменяющие материнское молоко, содержат много крахмалов и сахаров и мало белков (как это обычно случается в странах, где основная диета людей состоит из крахмалосодержащих овощей, или там, где начался массовый голод), у ребёнка может начаться квашиоркор.
Болезнь, скорее всего возникает из-за дефицита одного из нескольких видов питательных веществ (например, железа, фолиевой кислоты, йода, селена, витамина С), особенно тех, которые необходимы для выработки защитных антиоксидантов.
Важные антиоксиданты в организме, которых может не
хватать у детей с квашиоркором, могут включать глютатион, альбумин, витамин Е и
полиненасыщенные жирные кислоты. Поэтому, если ребёнок с ограниченными возможностями получения одного или другого вида питательных веществ или антиоксидантов подвергается стрессу (наприм ер, ВИЧ-инфекции или отравлению токсинами), у него есть больше вероятности заболевания квашиоркором.
Один из симптомов — вздутость животов детей (асцит).
2.Цикл трикарбоновых кислот (цикл лимонной кислоты, цикл Кребса). Это циклическая последовательность ферментативных реакций, в которой участвуют ди- и трикарбоновые кислоты, являющиеся промежуточными продуктами при распаде белков, жиров и углеводов у животных, растений и микробов. Он происходит в митохондриях. Цикл трикарбоновых кислот поставляет вещества для различных биосинтезов. Он осуществляется в аэробны условиях.
Главная роль ЦТК — образование большого количества АТФ. Значения ЦТК :
1)главный источник АТФ. Энергию для образования большого количества АТФ дает полный распад АцетилКоА до СО2 и Н2О;
2)универсальный терминальный этап катаболизма веществ всех классов;
3)играет важную роль в процессах анаболизма (промежуточные продукты ЦТК): а) из цитрата —— >синтез жирных кислот; б) из a-кетоглутарата и ЩУК (щавеливо-уксусная кислота) ——> синтез аминокислот; в) из ЩУК ——> синтез углеводов; г) из СукцинилКоА ——> синтез гема гемоглобина.
последовательность Нач.
цикл с присоед. ацетил-КоА к оксалоацетату и обр-ия цитрата. Затем лимонная кислота (шестиуглеродное соединение) путем ряда дегидрирований и двух декарбоксилирований теряет два углеродных атома и снова в цикле К. превращается в оксалоацетат (четырехуглеродное соединение), т.е. в рез-те полного оборота цикла одна молекула ацетил-КоА сгорает до СО2 и Н2О, а молекула
оксалоацетата регенерируется. Ц. К. дает поток электронов в связ. НАДН2 и АТФ форме. При окислении 1 молек. ацетилКоА в ц. К. и системе окислительного фосфорилирования может обр-ся 12 АТФ.
3.Роль печени в липидном обмене. Печень участвует во всех этапах липидного обмена, начиная с переваривания липидов и заканчивая специфическими метаболическими превращениями отдельныхипидныхфракций: ·синтезжелчныхкислотиобраз ованиежелчи; ·β-окислениежирныхкислот; ·биосинтезжирныхкислот; ·бразованиекетоновыхтел; ·распадисинтезфосфолипидов
;
·синтез холестерола и образование его эфиров; соотношение эфиры холестерина/свободный холестерин в норме составляет примерно 0,5 – 0,7 %; снижение этого коэффициента до 0,3 – 0,4 % наблюдается при поражениях печени и является неблагоприятным признаком;
·основное место синтеза липопротеинов очень низкой плотности и липопротеинов высокой плотности;
·гидроксилирование
витамина D по 25-му положению.
4. Витамин В1
Витамин В1(тиамин). Постр. из пиримидинового и тиазолового колец, соед. метиленовой гр. тиаминдифосфат (ТПФ,ТДФ). Акт. формаВып. ф-цию простетической гр. ферментовдекарбоксилаз, уч-
х в метаболизме ПВК и aкетоглутората, явл. кофактором транскетолазы катализир. петозофосфатный путь Витамин В1 регулирует углеводный, жировой. белковый обм., обладает с- витаминсберегающей ф-цией, оказ. влияние на проведение нервного возбуждения в синапсах. ТПФ — кофактор прямого декарбоксилир. ПВК, окислит. декарбоксилир. ПВК и a-кетокислот, катализируя нач. этап их превращение в пределах пируватдегидрогеназного комплекса кетоглуторатдегидрог-го компл. и аТДФ явл. коферментом транскетолазы, перенос. 2углеродные фрагм. от ксилулозо-5-фосфата к рибулозо-5-фосфату. В1 принимает уч-е в синтезе ацетилхолина, катализ. обр-е ацетил-КоА, уч. в кроветворении, стероидогенезе.
5. В плазме крови пациента в результате лабораторного анализа было обнаружено, что концентрация общего холестерина составляет 12 мМ. Ваше заключение
Холестерин — органическое соединение, важнейший компонент жирового обмена.
Роль холестерина в организме: холестирин
используется для построения
мембран клеток, в печени холестерин — предшественник желчи, холестерол участвует в синтезе половых гормонов, в синтезе витамина D. Нормы холестерина общего в крови
— 3,0—6,0 ммоль/л.
Определение холестерина крови — обязательный этап диагностики заболеваний сердечно-сосудистой системы (ишемическая болезнь сердца, инфаркт миокарда), атеросклероза и заболеваний печени. Повышенный холестерин или гиперхолестеринемия приводит к образованию атеросклеротических бляшек: холестирин присоединяется к стенкам сосудов, сужая просвет внутри них. На холестериновых бляшках образуются тромбы, которые могут оторваться и попасть в кровеносное русло, вызвав закупорку сосудов в
различных органах и тканях, что может привести к атеросклерозу, инфаркту миокарда и другим заболеваниям. Анализ холестерина покажет повышенное содержание холестерина в крови, что характерно для людей, в чьем рационе преобладает пища, богатая углеводами и насыщенными жирами.
БИЛЕТ 20
Токсичность кислорода: образование активных форм кислорода (супероксид анион, перекись водорода, гидроксильный радикал). Повреждение мембран в результате перекисного окисления липидов. Защита от токсического действия кислорода.
Токсичность кислорода.
Среда с сод-м кислорода явл. агрессивной по отнош. к орг. формам жизни, что связано с обр-м активных форм О2 в процессе жизнедеят. или под дейст. различ. форм ионизир. излучения. Фактор, опр-й жизнеспос. орг-ма в среде ккислорода - наличие у него функциональной антиоксидантной системы, спос. к элиминации . Супероксиддисмутаза элим. супероксид-анион, каталаза
элим. перекись водорода, цитохром - ферм., отвеч за перенос эл. от НАДН к О2. Дполнит. защита обеспеч.
синтезом или накоплением низкомолек. антиоксидантов вит. А, С, Е. лим. к-ты.
Осн. субстратом перикисного окисления липидов явл. полиненасыщенные цепи жирных к-т, входящих в сост. клеточ. мембр., липопротеинов. Их атака кислородными радикалами приводит к обр-ю гидрофобных радикалов, взаимодейст. др. с др.
Антиоксиданты - ингибиторы окисления прир. или синтетич. в-ва. спос. тормозить окисление. Мех-м действия сост. в обрыве реакционных цепей, молек. антиокс. взаимод с акт. радик. с обр. малоакт. радик., уменьш скорость окисления
Регуляция действия ферментов, аллостерические механизмы, фосфорилированиедефосфорилирование. Примеры метаболических путей, регулируемых этими механизмами. Классификация ферментов, ее принципы. Характеристика оксидоредуктаз.
Основы количественного определения активности ферментов
Активность фермента
выражается в скорости накопления продукта или скорости убыли субстрата в пересчете на количество материала, содержащего фермент за единицу времени:
-единицы количества вещества – моль (и его производные ммоль, мкмоль), грамм (кг, мг),
-единицы времени – минута, час, секунда,
-единицы массы или объема – грамм (кг, мг), литр
(мл)
Необходимо наличие
избытка субстрата, чтобы работали все имеющиеся в растворе молекулы фермента.Активирующее влияние на скорость
ферментативной реакции
оказывают разнообразные органические и неорганические вещества природы.Особенно часто активаторами являются ионы двух и трех валентных металлов.Ингибиторы ферментов делят на два класса: обратимые и необратимые.Эти вещества вызывают либо частичное либо полное торможение
реакции,катализируемой ферментом
Пример метаб.путей: — процесс переноса остатка фосфорной уислоты от фосфорилирующего агентадонора субстрату, как правило, катализируемый ферментами и ведущий к образованию эфиров фосфорной кислоты
АТФ + R-OH 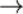 АДФ + R- OPO3H2
АДФ + R- OPO3H2
Аллост. ферм. – это регуляторный Ф, которые в своей молекуле ,помимо активного центра ,имеют регуляторный – аллостерический центр ,с которым взаимодействуют эффекторы ,изменяющие каталитическую активность Ф в следствии его конформационных перестроек.
Фосфолир./дефосфорилирова ние ковал. модифик. аминок- т ост., фосф-е осущ протеинкиназами., а дефосф- е - фосфопротеинфосфатазами. Присоед. ост. фосф. к-ты прив. к изм. конформ. акт. ц. и его каталит. акт-ти. Ферм. может как акт-ся, или станов. менее акт. Изм-е обратимо. Акт-ть протеинкиназ и фосф-з регул гормонами.
Классификация ферментов
1)Оксиредуктазы катализ. ОВР,окисляя субстрат
(S)путем дегидрирования с переносом 2-х электронови протонов на кислород(Наз. Аэробными дегидрогеназами)Путем присоединения 1 или 2-х атомов кислорода,при участии моноили диокигеназ. Ферменты этого класс сложные белки,коферментами которых могут быть – НАД, НАДФ, ФАД ,ФМН
2)Трансферазы - катализируют перенос атомных групп,радикалов с S на S.Коферменты-KoASH, ТГФК, АДФ, УДФ, ФАФ.
3)Гидролазыкатализируют разрывсвязи с присоединением воды.Диполиризуют сложные S до низкомолекулярных веществ.
4)Лиазы-катализируют негидролитический и неокислительный распад веществ по –C-C-. –C-O-. –C-N-
связями ,с замыканием двойных цепейи выведением простых веществ:CO2,NH3,H2O, а
также обратные этим реакции и тогда называются синтазами.
5)Изомеразы катал. внутримолек. превращ. Коферм. пиридоксальфосфат, дезоксиаденилкобаламин,
НАД. взаимопревращ. альдоз и кетоз, перемещ. двойных связей внутри молек. Внутремолек. перенос гр. осущ. мутазы.
6)Лигазы (синтетазы) соед. 2 молек. за счет разрыва макроэргич. связей. (в АТФ и др. нуклеозидфосфатах), или синтазы (в др. макроэрг. св.)
Ненасыщенные жирные кислоты, их физикохимические свойства и значение для клеток, химизм окисления. Незаменимые липидные факторы питания.
Ненасыщ. жир. к-ты человека
иживотных, участвующие в построении липидов, обычно содержат двойную связь между (9-м и 10-м атомами углеводородов); дополнительные двойные связи чаще бывают на участке между 11-м атомом углерода
иметильным концом цепи. Своеобразие двойных связей природных ненасыщенных жирных кислот заключается в том, что они всегда отделены двумя простыми связями, т.е. между ними всегда имеется хотя бы одна метиленовая группа (—СН=СН—СН2— СН=СН—). при наличии двойной связи в жирнокислотной цепи вращение углеродных атомов относительно друг друга ограничено. Это обеспечивает существование
ненасыщенных жирных кислот в виде геометрических изомеров причем природные ненасыщ. жир. к-ты имеют цис-конфигурацию. Цисконфиг. делает ненасыщенную кислоту менее стабильной и более подверженной катаболизму.
Ненасыщ. жир. к-ты: пальмитолеиновая
(C15H29COOH, 1 двойная связь), олеиновая
(C17H33COOH, 1 двойная связь)
Полиненасыщ. жир. к-ты:
линолевая (C17H31COOH, 2
двойные связи), линоленовая
(C17H29COOH, 3 двойные связи), арахидоновая
(C19H31COOH, 4 двойные связи).
Ткани жив. обладают весьма огранич. спос-тью превращать насыщенные жирные кислоты в ненасыщенные. Поэтому в пище животных должны обязательно присутствовать некоторые поли ненасыщенные жирные кислоты , содержащиеся в продуктах растительного происхождения. Это незам. жир. к-ты. Точка плавления и текучесть жиров зав. от сод-я
вних ненасыщенных жир. к-т
. Фосфолипиды клет. мембр. содержат ненасыщ. к-ты, которые играют важную роль
вобеспечении текучести
мембран . Простагландины и тромбоксаны являются гормонами местного действия; при необх. они быстро синт. и действуют в непосредственной близости от места их синтеза. Основная физиол. ф-ция простагландинов состоит в модулировании акт-ти аденилатциклазы и выраж., например, в регуляции агрегации тромбоцитов или ингибировании действия АДГ в почках. Лейкотриены обладают свойством вызывать мышечное сокращение и хемотаксис , это позволяет предполагать, что они играют существенную роль в аллергических реакциях и при воспалении.
Фолиевая кислота, ее строение и медикобиологическое значение.
ТГФК служит донором одноуглерод. радик. в р-циях синт. пуриновых нукл-в.
1. участвует в синтезе пуринов (аденин и гуанин), встраивая 2 и 8 углеродные атомы в пуриновое кольцо,2.
впревращении урацила в тимин, 3. в обмене глицина и серина, 4. в ресинтезе SАМ (S- аденозилметионин)из SАН (S- аденозилгомоцистеин)приуча стии метилкобаламина. (SАМ участвует в метилировании норадреналина в адреналин,
вметилировании серотонина
вмелатонин, в метилировании этаноламина
вхолин и, соотвно, в синтезе
– ацетилхолина, лецитина, сфингомиелина).
5. При энзимологическом исследовании плазмы крови пациентов было обнаружено, что активность амилазы увеличена в 5 раз. Ваш комментарий.
Альфа-амилаза крови катализирует гидролиз гликозидных связей крахмала и гликогена, секретируется поджелудочной и слюнными железами.
Амилаза представлена двумя изоферментами: P-тип, панкреатический (из поджелудочной железы), S- тип, слюнной (из слюнных желез). В отличие от большинства ферментов. Наибольшую диагностическую значимость имеет определение панкреатического изофермента. Активность амилазы в сыворотке крови повышается при остром панкреатите (более, чем в 5
раз, в основном, за счет панкреатического изофермента), при раке поджелудочной железы, вирусном гепатите, поражении слюнных желез (эпидемический паротит), почечной недостаточности, при приеме кортикостероидных препаратов, тетрациклина, гистамина.
.
БИЛЕТ 21
1.Синтез белка на рибосомах. Условия, необходимые для реализации этого процесса.
СИНТЕЗ БЕЛКА про ис ходит в 2 этапа :
1. транскрипция – переписывание последовательности
нуклеотидов ( н/т ) ДНК в последовательность н/т и РНК по принципу комплементарности
(между
пуринами и пиримидинами: А=Т(У), Г ≡Ц), и с заменой Т на У. 1′. посттранкрипционный процессинг –
созревание проиРНК: вырезание интронов → сплайсинг (сшивание экзонов) → «кэпирование» иРНК по 5′концу:
(+ )е метилированных н/т), и (+)е полиаденилата по 3′концу.
2. трансляция (происходит на рибосомах при участии тРНК, п риносящей а/к к месту синтеза полипептидной цепи) – раскодирование последовательности н/т и РНК в последовательность аминокислот белка: 3 н/т кодируют 1 а/к (
триплетность генетичес к ого кода ).
