
- •Гидравлика 1 а.М. Калякин
- •Введение
- •Физические свойства жидкостей и газов
- •1. Объект изучения
- •2. Физическое строение жидкостей и газов
- •3. Гипотеза сплошности
- •4. Силы, действующие на жидкость
- •5. Плотность
- •6. Вязкость
- •7. Температурное расширение капельных жидкостей
- •8. Сжимаемость жидкостей
- •9. Идеальная жидкость
- •10. Поверхностные явления в жидкостях
- •11. Уравнение состояния
- •12. Испарение. Кипение. Конденсация
- •13. Растворимость газов в жидкостях
- •Метод анализа размерностей
- •1. Основные определения
- •2. Правило размерности
- •Окончательный ответ записывается так
- •Затем ищем степенную комбинацию
- •Последнее равенство приводится к виду
- •4. Примеры из гидравлики
- •Относительное движение тела и жидкости
- •Зависимость для силы принимает вид
- •И обычно записывается
- •Чем будет число и окончательно
- •Определение вида функции c(,Re) является одной из важнейших задач гидромеханики и аэродинамики.
- •Вид функциональной зависимости для силы
- •Дополнительная часть д.1. Коэффициент с как функция безразмерных переменных
- •Возвращаясь к стандартной схеме
- •Д.2.Учет суммарного эффекта нескольких факторов
- •Их суммарный эффект можно оценить так
- •Точное решение задачи имеет вид
- •Заключение
- •Литература
- •Оглавление
- •Саратовский государственный технический университет
11. Уравнение состояния
В состоянии равновесия давление жидкости (или газа) p меняется с изменением ее плотности ρ и температуры T. Оно однозначно определяется значениями этих параметров. Соотношение
p=f(ρ,T)
между давлением, плотностью и температурой в состоянии равновесия называется уравнением состояния.
Для капельных жидкостей уравнения состояния очень сложны и поэтому в большинстве гидравлических расчетов принимают его в предельно простой форме
ρ = соnst, (11.1)
(т.е. плотность капельных жидкостей имеет постоянное значение).
Для газов (воздух, природный газ, перегретый пар) уравнение состояния при относительно небольших температурах и давлениях принимает такую форму
pV=RT, (11.2)
где p – абсолютное давление; Т – термодинамическая температура, К; V-удельный объем, связанный с плотностью соотношением V=1/ρ; R – универсальная газовая постоянная: для воздуха R = 287 Дж/(кг.К).
Уравнение состояния может быть записано в виде (с учетом V=1/ρ)
p/ρ=RT. (11.3)
Это уравнение позволяет определить плотность газа при данном давлении и известной температуре. Зная уравнение состояния,возможно определить фактически все основные параметры и характеристики жидкой среды. В частности, для газов коэффициент объемного сжатия определяется при Т= соnst , а коэффициент температурного расширения при p= соnst.
Имея в виду уравнение состояния идеального газа, можно описать процессы изменения его состояния.
1. Изотермический процесс. В этом случае температура газа не меняется, т.е. Т=const на протяжении всего процесса, тогда
![]() = RT
= const.
= RT
= const.
Изотермический процесс возможен лишь при идеально хорошем обмене теплом между газом и внешними телами.
2. Адиабатический процесс – происходящий без обмена теплом с окружающими телами.
Уравнение адиабаты
pVk = const
или
![]() = const.
= const.
Последнее уравнение часто представляют в виде
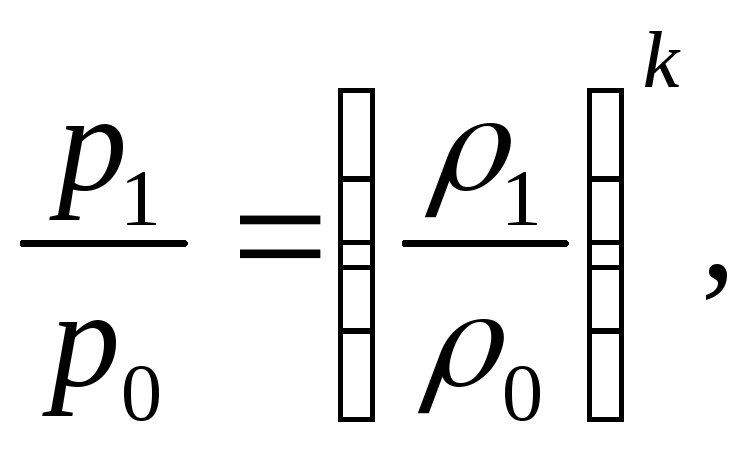
где k – коэффициент адиабаты.
3. Политропный процесс. Изотермический и адиабатический процессы являются идеальными, которые на практике осуществить нельзя, к ним можно только приблизиться. Изотермический процесс должен происходить бесконечно медленно, адиабатический процесс может протекать с конечной скоростью, но в адиабатной, теплонепроницаемой оболочке.
В природе происходят реальные процессы, являющиеся промежуточными между адиабатическими и изотермическими. Такие процессы называются политропными. Чтобы определить такой процесс, необходимо наложить на него только одно ограничение: считать, что повышение температуры тела пропорционально сообщенному телу количеству тепла ∆Q или, что то же, теплоемкость тела при политропном процессе постоянна, т.е.
∆Q = с ·∆T,
где с – const.
Для политропных процессов справедливы те же формулы, что и для адиабатических, например
![]() = const,
= const,
где γ имеет значение, промежуточное между сp/cv и единицей.
Задача 11.1. Определить коэффициент объемного сжатия для газов в изотермическом процессе (Т= соnst).
Решение. Имея в виду определение коэффициента βр в виде (8.1) и уравнение состояния (11.2) находим dW/dp (в данном случае через W обозначаем объем во всех зависимостях). Из (11.2), W=RT/p, при Т=соnst ,
dW/dp=(-RT/p2)
и окончательно
βр=1/p(при T=const).
Задача 11.2. Определить значение коэффициента температурного расширения для газов в изобарном процессе (при р= соnst).
Задача 11.3. По трубе подается воздух, его температура t = 15C, давление по манометру, присоединенному к трубе в некотором сечении равно PM=39 кПа. Атмосферное давление pат = 735 мм рт.ст. Определить плотность воздуха в данном сечении.
Решение. Определим плотность воздуха с помощью уравнения состояния (11.3)
![]() .
.
Давление p в числителе складывается из атмосферного давления pат = 735 мм рт.ст. = 97960,8 Па и избыточного pМ = 39000 Па = 39 кПа. Результирующее давление p равно p = 136960,8 Па. Плотность воздуха определится так
![]() кг/м3.
кг/м3.
