
ПАВ_курс лекций
.pdf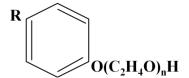
Рис. 45. Структурная формула неионного ПАВ типа ОП
Известен также ряд ПАВ типа «неонол-АФm-n», представляющих собой оксиэтилированные алкилфенолы с линейной структурой углеводородного радикала. Переменная m обозначает число атомов углерода в радикале, а n – степень оксиэтилирования.
Существуют, конечно, и другие виды неионных ПАВ (неоксиэтилированных), однако, на практике они используются реже, и они менее исследованы. В данном разделе мы коснемся только оксиэтилированных ПАВ.
Неионогенные ПАВ растворятся в воде в результате гидратации эфирных атомов кислорода оксиэтилированных групп. При понижении температуры ниже некоторой критической произойдет снижение растворимости ПАВ и разделение фаз. Одна из фаз будет представлять собой водный раствор оксиэтилированного ПАВ, а другая – кристаллогидрат этого вещества. Можно предполагать, что кристаллы неионного ПАВ образуются вследствие уменьшения интенсивности теплового движения и неспособности молекул преодолеть потенциальный барьер растворения, связанный в данном случае с разрушением достаточно плотной структуры воды и межмолекулярного притяжения углеводородных радикалов в кристаллах.
При повышении температуры раствора кристаллогидраты начинают растворяться, и система из гетерогенной переходит в гомогенную. Эта температура, подобно температурной границе точки Крафта, будет характеризовать фазовое превращение – растворение кристаллов ПАВ, обусловленное гидратацией оксиэтилных групп за счет возникновения водородных связей между молекулами воды и эфирными атомами кислорода, как показано на рис. 46.
81

Рис. 46. Гидратация оксиэтильной группы
Полиоксиэтиленовая цепь оказывается как бы «обшитой» молекулами воды по всей ее длине. Чем больше этиленгликолевых остатков в цепи, тем больше молекул воды связано с цепью водородной связью, и тем более гидрофильно соединение.
Дальнейшее нагревание раствора приводит к тому, что система вновь разделяется на две несмешивающиеся фазы – раствор неионогенного ПАВ и выделившееся дегидратированное вещество. Начало этого фазового разделения характеризуется резким помутнением раствора. При последующем повышении температуры мутность увеличивается, и после достижения некоторого максимального значения система несколько осветляется, вследствие выделения чистого ПАВ и образования макрофазы.
Следовательно, растворимость неионогенных ПАВ в воде имеет две ярко выраженные температурные границы – нижнюю границу растворения, связанную с недостаточной кинетической энергией молекул ПАВ, и верхнюю – связанную с уменьшением дигидратации эфирного кислорода оксиэтиленовых групп.
На рис. 47 показана типичная фазовая диаграмма состояния раствора неионогенного ПАВ на примере ОП-4.
Рис. 47. Диаграмма состояния раствора ОП-4
82
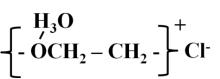
Гидратация молекул оксиэтилированных ПАВ сильно повышается в кислой среде. В такой среде молекулы воды, связанные с оксиэтиленовыми группами, принимают протон из раствора и образуют ион гидроксония. Благодаря этому молекула ПАВ приобретает положительный заряд, как показано на рис. 48:
Рис. 48. Гидратация оксиэтильной группы и образование
иона гидроксония
В связи с вышерассмотренным, некоторые кислоты, например, HCl, заметно повышают температуру помутнения ПАВ в связи повышением гидратации их оксиэтильных групп. Однако такой эффект может компенсироваться и перекрываться дегидратирующим действием аниона кислоты, и тогда температура помутнения повышается (в случае, например, с
H2SO4).
В отличие от кислот, основания всегда сильно понижают растворимость и температуру помутнения из-за разрушения водородных связей.
Электролиты, разрушая водородные связи, тоже вызывают дегидратацию. Поэтому в присутствии электролитов растворимость оксиэтилированных ПАВ и температура помутнения обычно снижаются. Понижение растворимости определяется главным образом природой аниона. Природа же катиона не играет существнной роли. Так, способность солей одновалентных катионов снижать температуру помутнения возрастает с переходом от хлоридов к сульфатам и карбонатам в ряду Cl- < SO42- < CO32-.
Температура помутнения зависит и от степени оксиэтилирования молекулы ПАВ. Чем длиннее оксиэтиленовая цепь, тем выше температура дегидратации, т.е. с увеличением степени оксиэтилирования молекулы температура помутнения повышается.
3.2. Влияние длины и строения углеводородного радикала на ККМ
Взаимосвязь между ККМ и числом метиленовых групп в углеводородных радикалах была одной из первых эмпирических закономерностей,
83
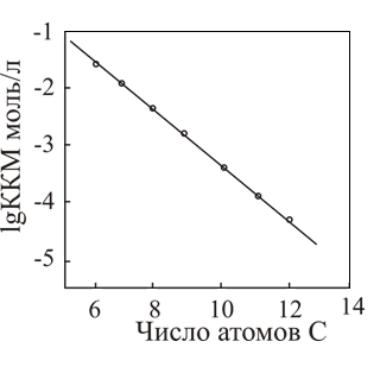
установленных при изучении растворов ПАВ. Экспериментальными исследованиями показано, что величина ККМ экспоненциально снижается при возрастании длины углеводородного радикала и неизменности природы полярных групп или величины оксиэтилированных цепочек. В общем виде эту зависимость можно представить так:
(122)
где А и В – константы, зависящие от строения радикала данного гомологического ряда и от температуры; nc – число атомов углерода в радикале. В частности, для калиевых солей карбоновых кислот:
RiCOOK |
|
25 C |
45 C |
|
|
|
|
|
A |
1,63 |
1,74 |
|
|
|
|
|
B |
0,290 |
0,292 |
|
|
|
|
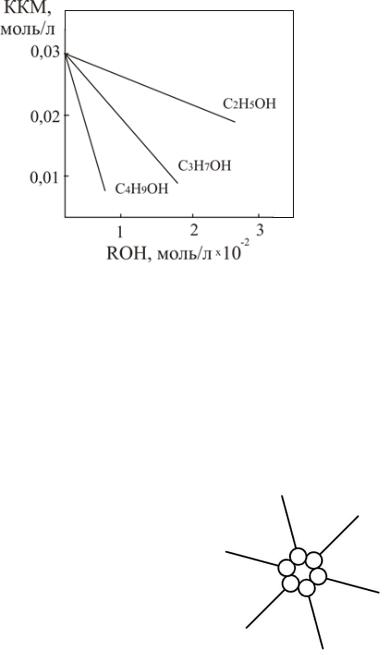
Для неионных ПАВ величина ККМ и растворимость с увеличением длины углеводородного радикала на каждую метиленовую группу уменьшаются пропорционально 1/3. В частности, для спиртов получена зависимость, представленная на рис. 49.
Рис. 49. Зависимость ККМ от длины радикала в случае неионных ПАВ (спиртов)
84
Наличие разветвленности в углеводородном радикале, как правило, приводит к увеличению растворимости и, соответственно, к росту ККМ.
Наличие одной двойной связи –СН=СН- (ненасыщенности) в углеводородном радикале увеличивает ККМ примерно в 3−4 раза по сравнению с насыщенным соединением.
Введение одного бензольного кольца (ароматичности) в углеводородную цепь эквивалентно увеличению длины радикала на 3−4 метиленовые группы, что приводит к падению ККМ, т.е. ароматические фрагменты ухудшают растворимость и снижают ККМ.
Как правило, увеличение числа углеводородных радикалов в молекуле приводит к ухудшению растворимости и снижению ККМ.
3.3. Влияние степени оксиэтилирования неионных ПАВ на ККМ
По аналогии с зависимостью ККМ от длины углеводородного радикала экспериментально получено уравнение, связывающее величину ККМ со степенью оксиэтилирования неионных ПАВ:
(123)
где A’ и B’ − эмпирические константы, а ne − степень оксиэтилирования. Для оксиэтилированных нонилфенолов при 25 C эта зависимость вы-
ражается уравнением:
(124)
где величина ККМ выражена в микромолях на литр раствора.
3.4. Влияние ионной группы на ККМ
Для некоторых алкилсульфатов натрия исследовалось влияние положения полярной группы в цепи на величину ККМ. В частности, было обнаружено, что ККМ увеличивается при перемещении сульфогруппы от конца к середине цепи.
тетрадецил-7-сульфат натрия |
тетрадецил-1-сульфат натрия |
|
|
ККМ = 9,7 ммоль/л |
ККМ = 2,4 ммоль/л |
|
|
85
Для ПАВ с несколькими полярными головками характерны более низкие температуры Крафта. Однако нельзя говорить о четкой зависимости между числом полярных групп в молекуле и величинах ККМ. Иногда на величину ККМ влияет наличие электростатического отталкивания полярных групп.
3.5. Влияние низкомолекулярных электролитов на ККМ
Добавки низкомолекулярных электролитов существенно изменяют ККМ ионных ПАВ. Можно записать эмпирическое выражение следующего вида:
(125)
где Кg – эмпирическая константа, обычно лежащая в пределах 0,4−0,6; сi – концентрация противоинов.
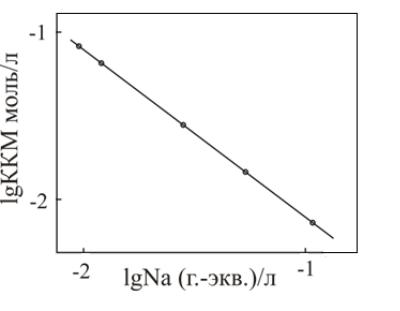
Экспериментальные данные, полученные для додецилсульфата натрия в присутствии хлорида натрия, представлены на рис. 50.
Рис. 50. Зависимость ККМ додецилсульфата натрия от содержания хлорида натрия
3.6. Влияние спиртов на ККМ
Поскольку довольно широкий круг ПАВ синтезируется с использованием спиртов, оценивать влияние непрореагировавших спиртов на ККМ является актуальной задачей. В целом, присутствие спиртов снижает ККМ.
86
При небольших количествах спирты способны избирательно адсорбироваться на поверхности мицелл. Оценить влияние содержание спирта (СROH) на ККМ можно, используя следующее уравнение:
( |
|
) |
(126) |
|
|
||
|
|
где m − число атомов углерода в молекуле ионного ПАВ; m’− число атомов углерода в молекуле спирта.
В частности, для ионного ПАВ – лаурата калия – получены данные, представленные на рис. 51.
Рис. 51. Зависимость ККМ лаурата калия
от содержания различных спиртов
4. Особенности мицеллообразования в неводных средах
Рассмотренные выше закономерности касались мицеллообразования в водной среде, т.е. при образовании прямых мицелл. При мицеллообразовании в органической среде существует ряд особенностей, которые здесь будут рассмотрены очень кратко.
Строение обратной мицеллы можно представить следующей схемой:
87
В отличие от водных сред, обратная мицелла не окружена ДЭС, т.е. полностью незаряжена. При мицеллообразовании в органической среде очень часто поверхностная активность выражена слабо, т.е. адсорбция на границе раствор-воздух не существенна. Как правило, ККМ в органической среде и степени агрегации ПАВ значительно ниже, чем в воде.
Длина углеводородного радикала очень слабо влияет на величину ККМ. Наиболее распространенными методами определения ККМ являются рефрактометрический метод, метод светорассеяния и солюбилизации.
5. Понятие о солюбилизации. Емкость солюбилизации. Изотермы солюбилизации
Одним из наиболее характерных свойств мицеллярных растворов ПАВ является их способность растворять нерастворимые в данном растворителе вещества. Такое свойство по предложению Мак-Бена получила название солюбилизация. Процесс солюбилизации можно рассматривать как распределение труднорастворимого вещества между истинным раствором и мицеллами ПАВ. Для водных растворов ПАВ характерна солюбилизация «маслоподобных» веществ (органических), для растворов ПАВ в неполярных растворителях – солюбилизация воды.
Изотермы солюбилизации чаще всего имеют вид, показанный на рис. 52. Это кривая, не проходящая через начало координат, так как солюбилизация возможна только после образования мицелл. Солюбилизацию выражают либо по аналогии с растворимостью, как количество вещества в единице объема ПАВ, т.е. моль/л. Либо ее относят к одному молю мицеллярного ПАВ. Тогда говорят о молярной солюбилизации (моль солюбилизата/моль ПАВ).
Для описания изотермы солюбилизации используют уравнение:
|
̅ |
( |
) |
(127) |
|
̅ |
|
||
где S – солюбилизация, выраженная в моль/л; |
̅ − средняя солюбилизаци- |
|||
онная емкость мицелл (количество солюбилизированных молекул в одной мицелле); ̅ − число агрегации (среднее количество молекул ПАВ в мицелле).
88
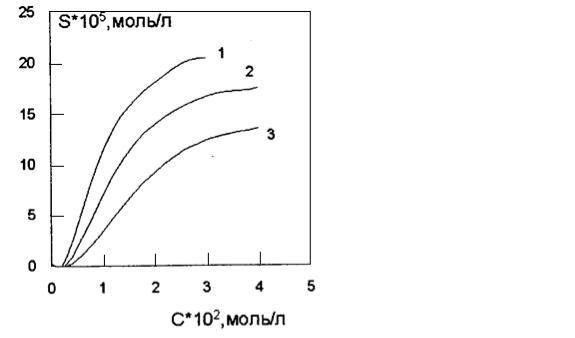
Рис. 52. Изотерма солюбилизации красителя оранжевого–ОТ растворами неионных ПАВ:
С11Н23(ОС2Н4)7ОН (1); С14Н29(ОС2Н4)6ОН (2); С10Н21(ОС2Н4)5ОН (3)
При ̅⁄ ̅ |
изотерма принимает линейный вид. Для молярной |
|||||||
солюбилизации получено уравнение: |
|
|
|
|||||
|
|
|
|
̅ |
|
|
(128) |
|
|
|
|
|
|
( |
|
) |
|
|
|
|
̅ |
|
|
|||
Таким образом, равновесная молярная солюбилизация определяется соотношением трех характеристик растворов ПАВ – солюбилизационной емкостью мицелл, числом агрегации и концентрацией неассоциированных молекул ПАВ, примерно соответствующей ККМ. Молярная солюбилизация изменяется скачкообразно при переходе одной формы мицеллы к другой. Такая типичная зависимость приведена на рис. 53.
После завершения формирования сферических мицелл (точка А) молярная солюбилизация остается постоянной вплоть до ККМ2, когда формируются цилиндрические мицеллы, емкость которых больше. После завершения их образования (точка В) их солюбилизационная емкость какоето время также остается постоянной, вплоть до достижения ККМ3 и т.д. В слоистых мицеллах нет предела солюбилизации, поскольку солюбилизат располагается между слоями ПАВ. Итак, анализируя представленную зависимость можно независимым путем определять величины ККМ исследуемого ПАВ.
89
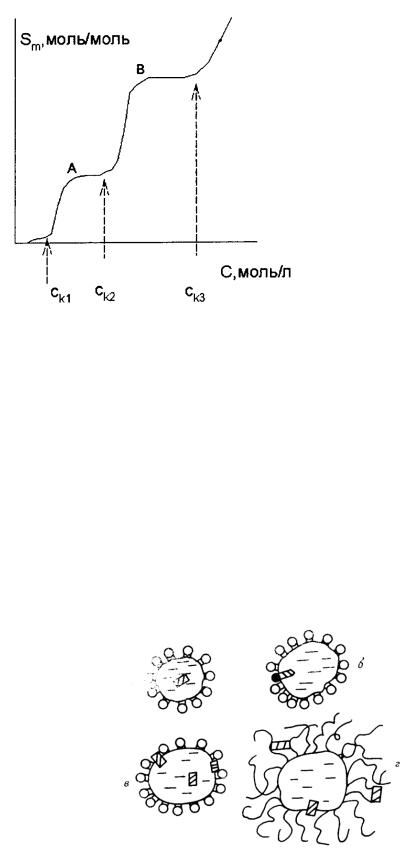
Рис. 53. Изотерма молярной солюбилизации (схема)
Величина солюбилизации зависит от химической природы ПАВ – длины углеводородного радикала; строения радикала; присутствия различных заместителей, положения и числа гидрофильных групп и т.д. Эти же факторы оказывают влияние и на размер мицелл. Чем больший внутренний объем имеет мицелла, тем больше способность данного ПАВ к солюбилизации (рис. 54). Обычно соединения с разветвленной углеводородной цепью обладают значительно большей солюбилизирующей способностью, чем алифатические соединения с эквивалентной длиной цепи. Введением в растворы ПАВ некоторых добавок (электролитов, спиртов и пр.), способных изменять размеры мицелл, можно добиться увеличения (уменьшения) солюбилизационной емкости.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
б |
|
|
а |
|||||||
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
в |
|
г |
|
|
|
|
|
|
Рис. 54. Схема распределения солюбилизата в мицеллах:
а− неполярный солюбилизат; б − полярный солюбилизат;
в− слабополярный солюбилизат;
г− солюбилизация в обратных мицеллах
90
