
ПАВ_курс лекций
.pdfмицелл. Обратные мицеллы образуются при относительно небольших площадях концевых групп (голов) и нескольких углеводородных радикалах в молекуле ПАВ. Ионные ПАВ, как правило, формируют прямые сферические мицеллы, однако, при большой ионной силе способны и к образованию цилиндрических мицелл. ПАВ с двумя углеводородными радикалами и относительно большими головками склонны к образованию полостей или изогнутых бислоев. ПАВ с двумя углеводородными радикалами
инебольшими головками формируют, как правило, плоские бислои.
Взаключение можно отметить, что для прогнозирования геометрии структур параметр упаковки может быть использован как на границе раздела жидкость-газ, так и на границе жидкость-жидкость.
Рекомендуемая литература
1.Фролов Ю.Г. Курс коллоидной химии: поверхностные явления и дисперсные системы. М.: Химия, 1982. ( 3 изд. − 2004).
2.Ланге К.Р. Поверхностно-активные вещества. Синтез, свойства, анализ и применение /пер. с англ. под ред. Л.П. Зайченко. СПб.: Профессия, 2005. 240 с.
3.Агеев А.А., Волков В.А. Поверхностные явления и дисперсные системы в производстве текстильных материалов и химических волокон. М.: МГТУ им. А.И. Косыгина, 2004.
71
ЛЕКЦИИ 8−11. МИЦЕЛЛООБРАЗОВАНИЕ В РАСТВОРАХ ПАВ. КРИТИЧЕСКАЯ КОНЦЕНТРАЦИЯ МИЦЕЛЛООБРАЗОВАНИЯ.
ВЕЗИКУЛЫ. МИЦЕЛЛЯРНАЯ МАССА И МЕТОДЫ
ЕЕОПРЕДЕЛЕНИЯ
1.Элементы термодинамики мицеллообразования
Помимо классификации ПАВ по химическому строению (неионные и ионные – катионные, анионные и амфотерные), все ПАВ можно разделить еще на две группы, основываясь на их поведении в растворе – истинно растворимые и коллоидные. Истинно растворимые ПАВ при всех концентрациях образуют истинные растворы, коллоидные ПАВ способны к мицеллообразованию при определенных концентрациях – критических концентрациях мицеллообразования – ККМ.
Изотермы поверхностного натяжения коллоидных ПАВ отличаются от изотерм истинно растворимых ПАВ резким понижением поверхностного натяжения σ с увеличением концентрации ПАВ и наличием излома в области низких концентраций, отвечающих истинной растворимости, выше которых σ остается практически постоянным. Концентрация в точке излома соответствует ККМ, выше которой в растворе самопроизвольно протекают процессы мицеллообразования и система переходит в ультрамикрогетерогенную. Более резко точка ККМ заметна на изотерме, построенной в координатах σ = lg (c) (рис. 13).
Резкое снижение поверхностного натяжения до ККМ обусловлено адсорбцией молекул ПАВ на межфазной границе раствор-воздух в соответствие с фундаментальным адсорбционным уравнением Гиббса:
|
|
|
|
|
(110) |
∑ |
(в |
|
е виде) |
|
|
где Г – гиббсовская адсорбция и μ – химический потенциал. |
|
||||
Или для бинарного раствора ПАВ-вода: |
|
||||
|
|
( |
|
) |
(111) |
|
|
|
|
||
72

При полном заполнении монослоя на поверхности раздела (Г = А ) постоянному значению σ соответствует постоянное значение химического потенциала ПАВ в растворе, что определяет процесс мицеллообразования как процесс образования новой фазы. Поверхностную активность коллоидных ПАВ можно приблизительно оценить через ККМ с помощью соотношения:
(112)
где σ0 – поверхностное натяжение чистого растворителя.
У коллоидных ПАВ предельные значения σ0 – σККМ для границы раздела раствор-воздух мало отличаются и составляют при нормальной температуре около 72,5−28 = 43,5 мДж/м2. Значения ККМ разнятся на 2−3 порядка, поэтому можно считать, что поверхностная активность коллоидных ПАВ обратно пропорциональна ККМ. Последнее соотношение устанавливает связь между поверхностными и объемными свойствами ПАВ.
Значения ККМ соответствуют истинной растворимости ПАВ. При более высокой концентрации ПАВ образуется коллоидная система. Она является классическим примером лиофильных (согласно критерию Ребиндера−Щукина) гетерогенных систем – равновесных систем с минимумом энергии Гиббса, несмотря на огромную межфазную поверхность.
Под мицеллой ПАВ понимают агрегат дифильных молекул, лиофильные группы которых обращены к соответствующему растворителю
(далее речь пойдет только о прямых мицеллах, т.е. в качестве растворителя будет рассматриваться вода), а лиофобные соединяются друг с другом, образуя ядро. Число молекул, составляющих мицеллу, называют числом агрегации, а общую сумму молекулярных масс молекул мицеллы или произведение массы мицеллы на число Авогадро – мицеллярной массой. Определенное ориентирование дифильных молекул ПАВ в мицелле обеспечивает минимальное межфазное натяжение на границе раздела ми- целла-среда.
(113)
где а – в данном случае – размер мицеллы.
73

Установлено, что мицеллообразованию предшествует ассоциация молекул ПАВ в димеры, тримеры и т.д. С ростом концентрации ПАВ в растворе концентрация мономера остается практически постоянной, а количество мицеллярной фазы растет.
Несмотря на то что существование мицелл доказано многими учеными, единой теории мицеллообразования на сегодняшний день не существует. Наиболее известными считаются две модели мицеллообразования – модель фазового разделения, базирующаяся на рассмотрении мицелл в качестве отдельной фазы, и модель, основанная на законе действия масс.
Процесс мицеллообразования в простейшем виде в соответствии с законом действия масс можно выразить уравнением:
( |
) |
(114) |
где К+ – противоионы; R– – поверхностно-активный анион; М – мицелла; n – число R– в мицелле.
Константа равновесия уравнения (114) будет равна:
(115)
где γ – коэффициенты активности.
Стандартная энергия Гиббса мицеллообразования, приходящаяся на 1 моль мономера, составит:
(116)
или, выразив константу из предыдущего уравнения, получим:
* |
|
|
|
( |
) |
|
|
|
+ |
(117) |
|
|
|
|
|
|
|
||||
|
|
|
|
|
Принимая коэффициенты активности равными единице (так как раствор разбавленный), а также учитывая, что , окончательно имеем:
( |
|
) |
(118) |
|
|
||
|
|
Для полностью диссоциированных молекул ПАВ в мицеллах, а также для неионогенных ПАВ m=0; при полной ионной ассоциации в мицелле m/n = 1, т.е. отношение m/n для ионных мицелл может меняться от 0 до 1.
74

Энтальпию мицеллообразования можно определить из температурной зависимости ККМ в соответствии с уравнением Ван−Гоффа, допуская независимость размера мицелл от температуры:
(119)
( )
После интегрирования получим:
(120)
( )
Величина m изменяется от 2 до 5 при образовании ионных мицелл в предмицеллярной области и от 10 до 100 – при образовании мицелл.
Энтропия процесса мицеллообразования в соответствии с уравнением будет равна:
( |
|
) [ |
( |
|
) ] |
(121) |
|
|
|
||||
|
|
|
Термодинамическое рассмотрение процесса мицеллообразования позволяет сделать вывод о том, что с увеличением сродства молекул ПАВ к растворителю (их лиофильности) устойчивость мицелл снижается и соответственно увеличивается ККМ. Устойчивость мицелл снижается и при увеличении диссоциации молекул ПАВ и росте заряда мицеллы: увеличивается энергия отталкивания одноименно заряженных лиофобных ионов, образующих мицеллы.
Большую роль в процессе мицеллообразования в водных растворах играют так называемые гидрофобные взаимодействия. В данном случае они заключаются в стремлении устранить контакт между водой и неполярными углеводородными радикалами молекул ПАВ. Взаимодействие воды с гидрофобными радикалами невыгодно, что создает движущую силу выталкивания их из водного раствора. На молекулы углеводорода действует сила, стремящаяся перенести их в углеводородную фазу или любое другое неполярное окружение. Это может привести к макроскопическому разделению фаз или «маскировки» неполярных групп каким-то другим способом. При этом существенно изменяется структура самой воды – происходит ее частичное разрушение. Если к углеводородной молекуле присоединить полярную группу, возникает противоположная сила, препятствующая
75
макроскопическому разделению на фазы. Если эта сила невелика, разделение будет происходить. Если она больше гидрофобного эффекта, дифильное вещество может оставаться молекулярно растворенным или присутствовать в виде небольших агрегатов – димеров, тримеров и пр. Самоассоциация ПАВ всегда сопряжена с балансом гидрофобных и гидрофильных взаимодействий. Гидрофобные взаимодействия усиливаются с увеличением длины гидрофобной части ПАВ. При этом снижение растворимости прямо пропорционально коррелирует с уменьшением ККМ.
Взаимодействующие между собой углеводородные радикалы молекул ПАВ экранируются в процессе мицеллообразования полярными гидрофильными группами. Поэтому процесс мицеллообразования происходит самопроизвольно с минимальным межфазным натяжением на границе раздела мицелла-вода, что сопровождается уменьшением энергии Гиббса системы. Эффектом экранирования объясняется уменьшение энтальпии в процессе мицеллообразования. Взаимодействие отдельных частей молекулы ПАВ в молекулярном растворе с растворителем характеризуется различным изменением энтальпии: лиофильная часть взаимодействует с выделением теплоты, лиофобная – с поглощением теплоты. Именно поэтому энтальпия растворения ПАВ имеет небольшие положительные или отрицательные значения (для водных растворов – чаще положительные). В мицеллярном растворе экранирование лиофобных групп приводит к уменьшению поглощения теплоты, т.е. к снижению энтальпии системы по отношению к энтальпии образования истинного раствора. Так как процесс мицеллообразования является процессом возникновения новой фазы, то его можно сравнить с расслоением системы, т.е. с процессом ее упорядочивания. Для таких процессов характерно уменьшение энтропии. Если же процесс мицеллообразования рассматривать как самопроизвольное диспергирование, т.е. образование мицеллярного раствора из макрофаз компонентов, то, очевидно, такой процесс будет обеспечиваться энтропийной составляющей как процесс, приводящий систему в то же самое состояние, но с другой стороны.
76
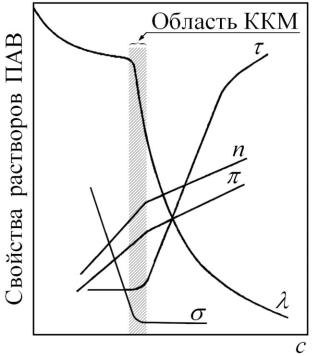
2. Методы определения ККМ
Из общего курса коллоидной химии известно, что определение ККМ может осуществляться при изучении практически любого свойства растворов ПАВ в зависимости от изменения концентрации. Наиболее часто в исследовательской практике используются зависимости мутности τ, эквивалентной электропроводности λ, поверхностного натяжения σ, показателя преломления n и осмотического давления π от концентрации ПАВ. Перечисленные зависимости показаны на рис. 39.
Рис. 39. Методы определения ККМ
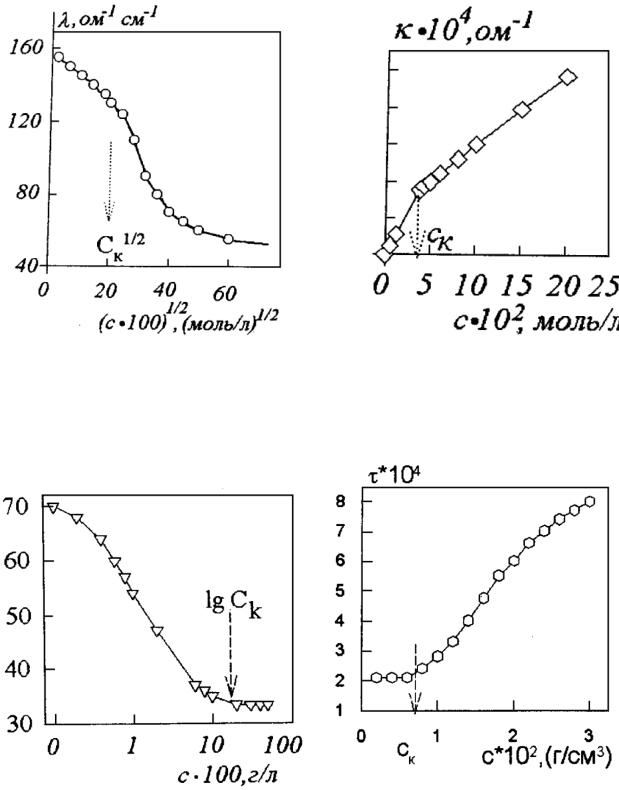
Критическую концентрацию мицеллообразования определяют по той точке, которая соответствует излому на этих кривых. Поскольку анализ каждой зависимости подробно обсуждался в общем курсе, здесь, для наглядности, будут приведены конкретные данные для некоторых ПАВ
(рис. 40−43).
Определение ККМ имеет важное практическое значение, так как именно в области этой концентрации ПАВ проявляют максимальную пенообразующую способность, наиболее эффективное моющее действие и т.д.
77
ом-1 см-1 |
|
|
|
|
|
|
4 |
-1 |
|
|
|
к∙10 |
|
, ом |
|
|
|||
|
|
|
|
|
80
40
|
|
|
|
0 |
5 |
10 |
15 |
20 |
25 |
|
|
|
|
|
|
|
|
|
с∙102, моль/л |
|
|||
|
(c∙100)1/2, (моль/л)1/2 |
|
|
|
|
|
|
|
|||
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
Рис. 40. Зависимость эквивалентной прово- |
|
Рис. 41. Зависимость удельной |
|
|
|||||||
|
димости от концентрации |
|
|
проводимости растворов |
|
|
|
||||
растворов децилтриметиламмоний |
децилсульфата натрия при 40 С |
|
|
||||||||
|
бромида при 40 С |
|
|
|
|
|
|
|
|
|
|
σ, мДж/м2
|
|
|
скр |
|
с |
|
|
г/л |
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Рис 42. Изотерма поверхностного |
Рис. 43. Зависимость мутности |
|||||
натяжения растворов |
растворов 6-оксиэтилированного |
|||||
додецилсульфата натрия при 25 С |
|
октанола при 20 С |
||||
78
3. Зависимость величины ККМ от различных факторов
3.1. Зависимость растворимости ПАВ от температуры. Точка Крафта. Температура помутнения
Прежде чем перейти к описанию большого количества факторов, влияющих на ККМ, остановимся на зависимости растворимости ПАВ от температуры. Поскольку влияние температуры на растворимость ионных и неионных ПАВ существенно отличается, каждый их этих классов ПАВ рассмотрим отдельно.
Влияние температуры на растворимость ионных ПАВ. Точка Крафта
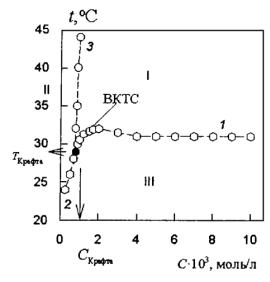
Температура довольно существенно влияет на поведение ионных ПАВ в водных растворах. Растворимость ПАВ при низких температурах может быть очень незначительной, но резко увеличивается в относительно узком температурном интервале. Эту закономерность называют явлением Крафта, а температуру, при которой резко увеличивается растворимость ПАВ вследствие образования мицелл – точкой (температурой) Крафта. Температурная зависимость растворимости ПАВ приведена на фазовой диаграмме (рис. 44).
Как видно из этого рисунка, точка Крафта Тк является тройной точкой на фазовой диаграмме – ПАВ – растворитель (вода). В этой точке существует равновесие между тремя фазами: чистое ПАВ – мицеллярный раствор ПАВ – истинный раствор ПАВ.
Рис. 44. Диаграмма состояния раствора ПАВ.
Точка Крафта
79
Эффект Крафта объясняется одновременным проявлением температурной зависимости молекулярной растворимости ПАВ и температурной зависимости ККМ. ККМ настолько слабо зависит от температуры, что, в первом приближении, можно считать, что ККМ практически не меняется с ростом температуры. В то же время распад мицелл на составные сольватированные ионы увеличивается с температурой, как это характерно для солей. Если растворение происходит ниже ККМ, мицеллы не образуются, и общая растворимость ПАВ лимитируется низкой молекулярной растворимостью. Если же молекулярная растворимость достигает ККМ, образуются мицеллы. Характерная особенность процесса мицеллообразования состоит в том, что при увеличении концентрации мицелл практически не происходит изменения активности (концентрации) молекулярно растворенного ПАВ.
Точка Крафта весьма сильно зависит от строения молекулы ПАВ. Так, для ПАВ с алкильными цепями характерны следующие закономерности:
Точка Крафта возрастает с увеличением длины алкильной цепи, причем это возрастание нерегулярное, проявляется различие между «хвостами» с четным и нечетным числом атомов углерода.
Точка Крафта сильно зависит от природы полярной группы и противоиона. Добавление солей обычно приводит к повышению точки Крафта. В то же время, многие другие растворенные вещества могут ее понизить. Общие закономерности, связывающие точку Крафта и природу противоина, на сегодняшний день однозначно не установлены.
Влияние температуры на растворимость неионных ПАВ. Температура помутнения
Наиболее распространенными и изученными неионными ПАВ являются продукты конденсации окиси с полярными органическими веществами, содержащими подвижный атом водорода. Так, выпускаемые отечественной промышленностью неионогенные ПАВ типа ОП являются продуктами оксиэтилирования алкил-или диалкилфенолов, общей формулой, показанной на рис. 45, где n – степень оксиэтилирования.
80
