
ПАВ_курс лекций
.pdf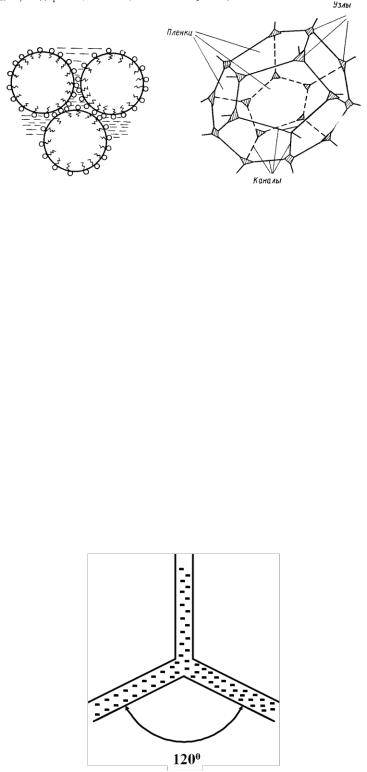
а б Рис. 27. Возможные формы пузырьков пены:
а − сферическая; б − полиэдрическая
Шаровая пена образуется, если объем жидкой фазы Vж превышает объем газовой фазы Vг более, чем в 10−15 раз. Пленки пузырьков такой пены имеют относительно большую толщину. Чем меньше соотношение Vж/Vг, тем меньше толщина пленки. По мере старения пены утончаются, и шаровая пена превращается в полиэдрическую.
Структура полиэдрических пен описывается правилом Плато. Три пузырька, стенки которых встречаются под углом 120° , образуют механически устойчивую систему. При их соединении пленки, разделяющие их, образуют трехгранный столбик жидкости, называемый каналом Плато−Гиббса (рис. 28).
Рис. 28. Каналы Плато−Гиббса
Площадь поперечного сечения канала S может быть рассчитана по уравнению:
̅(√ |
|
|
|
) |
(86) |
51 |
|
||||
|
|
||||
|
|
|
|
||

где r средний радиус пузырька пены.
Большая кривизна поверхности в точке контакта трех пузырьков (точка А) приводит к значительному перепаду давлений между газовой и жидкими фазами, в результате чего жидкость выдавливается из пленки в канал Плато−Гиббса. Стекание жидкости внутри пленки описывается уравнением Гиббса и соответствует течению вязкой жидкости между параллельными пластинами:
(87)
где ρ – плотность раствора; g – ускорение свободного падения; η – вязкость раствора и δ – толщина пленки.
Согласно Гиббсу, одной из основных характеристик пленки, прямо пропорциональной устойчивости пены, является ее сопротивление механическому воздействию. В качестве такой характеристики Гиббс предложил рассматривать упругость пленки Е.
( ) ( |
|
) |
(88) |
|
|
||
|
|
где Г21 − гиббсовская адсорбция второго компонента (см. лекцию 3); μ2 − химический потенциал второго компонента и m2 − масса второго компонента на единицу площади пленки.
Качественно величина Е характеризует способность пленки менять поверхностное натяжение σ в момент наложения растягивающего или сжимающего усилия. Таким образом, с другой стороны:
и и |
ее т |
(89) |
|
|
|
||
|
|
||
где S – площадь пленки.
При растяжении поверхности концентрация ПАВ уменьшается, что приводит к росту σ, препятствующему разрыву пленки.
Вышеприведенное уравнение (88) объясняет также один очевидный факт, почему чистые жидкости не пенятся. Для чистых жидкостей, при отсутствии второго компонента Г21 = 0, что приводит к нулю и величину Е, соответственно, к отсутствию возможности формирования пленки на поверхности и, как результат, самой пены.
52

2. Основные характеристики пены
Для характеристики пен используется несколько параметров, основные из которых будут рассмотрены ниже.
Пенообразующая способность – количество пены (мл) или высота столба пены (мм), которые образуются из постоянного объема раствора при определенных (концентрация, температура и т.д.) условиях. Пенообразующую способность определяют на приборе Росс−Майлса, согласно ГОСТ.
Кратность пены β – отношение объема пены Vп к объему жидкости Vж, пошедшего на ее образование.
( |
) |
(90) |
|
|
|
где Vг – объем газа в пене.
Стабильность пены – ее способность сохранять общий объем и дисперсный состав пузырьков. Часто в качестве меры стабильности пены используют время существования ее отдельного элемента – пузырька или пленки.
Дисперсность пены – средний размер пузырька, а также распределение пузырьков по размерам. В ряде случаев весьма важны такие характеристики пен, как вязкость, теплопроводность, электропроводность и оптические свойства пены, но в данном курсе мы этого касаться не будем. Остановимся поподробнее на пенообразующей способности, точнее факторах, влияющих на нее.
3. Зависимость пенообразующей способности от различных факторов
3.1. Зависимость пенообразующей способности от строения ПАВ. Ионные ПАВ
Если сравнивать пенообразующую способность ионных и неионных ПАВ при приблизительно одинаковой длине углеводородного радикала, то, несмотря на то, что, как правило, адсорбционная способность ионных ПАВ на границе с воздухом ниже, их растворы обладают большей пенооб-
53
разующей способностью. Это объясняется тем, что образующаяся пена стабилизируется двойным электрическим слоем (ДЭС), отсутствующим в случае неионных ПАВ.
1). Пенообразующая способность растворов натриевых солей жирных кислот нормального строения, как правило, повышается при увеличении радикала. Наибольшей пенообразующей способностью обладают водные растворы миристиновой кислоты, при концентрации ПАВ = 0,5 г/л.
Наибольшую пенообразующую способность в ряду солей ненасыщенных кислот имеют растворы олеата натрия.
Разветвленность органического радикала в молекуле солей жирных кислот положительно влияет на пенообразующую способность. Так, раствор натриевой соли 1,3-диметилтетрадекановой кислоты пенится сильнее, чем раствор пальмитата натрия.
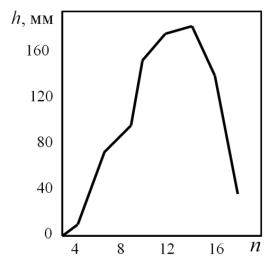
Пенообразующая способность водных растворов первичных алкилсульфатов также возрастает с ростом длины углеводородного радикала и достигает максимального значения при С12-, т.е. для додецилсульфата натрия. Дальнейший рост радикала приводит к снижению растворимости и, соответственно, к снижению пенообразующей способности алкилсульфатов (рис. 29). Растворы алкилсульфонатов начинают хорошо пениться, начиная только с длины радикала С11- и при концентрациях, не ниже 0,5 г/л. Причем, чем ближе расположена гидрофильная часть к середине молекулы таких ПАВ, тем выше пенообразующая способность. Формирование устойчивой пены зависит не только от поверхностной активности ПАВ, но и от типа пленки, которую он формирует на поверхности.
Рис. 29. Зависимость пенообразующей способности алкилсульфонатов от
длины радикала
54
2). Пенообразующая способность растворов ионных ПАВ зависит также и от типа катиона. В частности, для натриевых и калиевых мыл можно привести следующие данные (табл. 6).
Таблица 6
Зависимость пенообразующей способности от вида катиона
|
|
Высота пены*, мм |
|
Анион |
|
|
|
|
Катион |
||
|
|
|
|
|
Na+ |
|
K+ |
|
|
|
|
Лаурат |
169 |
|
232 |
|
|
|
|
Миристат |
489 |
|
494 |
|
|
|
|
Пальмитат |
54 |
|
204 |
|
|
|
|
Стеарат |
16 |
|
73 |
|
|
|
|
Олеат |
154 |
|
212 |
|
|
|
|
* − концентрация раствора − 0,5 г/л, температура 50 °C.
Обратите внимание на то, что калиевые соли, как правило, пенятся лучше, чем натриевые, причем наибольшей пенообразующей способностью также обладают миристаты.
3.2. Зависимость пенообразующей способности от строения ПАВ. Неионные ПАВ
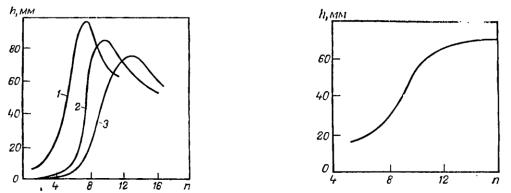
Пенообразующая способность оксиэтилированных ПАВ зависит как от длины радикала, так и от числа оксиэтилированных групп, что иллюстрируют рис. 30 и 31.
Рис. 30. Зависимость пенообразующей |
Рис. 31. Зависимость пенообразующей |
способности оксиэтилированных ПАВ |
способности оксиэтилированных ПАВ |
от длины радикала |
от степени оксиэтилирования |
|
55 |
В целом, как уже отмечалось, пенообразующая способность неионных ПАВ существенно ниже, чем ионных. Однако здесь необходимо обратить внимание на то, что смеси ПАВ (ионные + неионные) пенятся гораздо лучше, чем каждое из ПАВ в отдельности.
Стабильная пена получается за счет высокой адсорбционной способности неионных ПАВ и стабилизации их за счет ДЭС ионных ПАВ. Поэтому для создания устойчивых пен очень часто используют именно смеси ПАВ. Это можно проиллюстрировать такими экспериментальными данными:
ПАВ (1 г/л) |
|
Высота пены, |
мм |
|
|
|
|
|
|
|
|
|
15 °C |
20 °C |
25 |
°C |
70 °C |
|
|
|
|
|
|
Алкилоксиэтиловый эфир |
0 |
1 |
3 |
10 |
|
|
|
|
|
|
|
Алкилбензосульфонат натрия |
18 |
24 |
27 |
31 |
|
|
|
|
|
|
|
Смесь (1:1) |
40 |
58 |
70 |
75 |
|
|
|
|
|
|
|
3.3. Зависимость пенообразующей способности от температуры
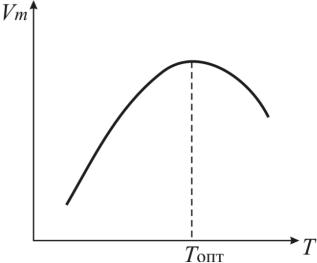
Зависимость пенообразующей способности (или объема пены) от температуры носит экстремальный характер (рис. 32).
Рис. 32. Зависимость пенообразующей способности от температуры
Для большинства ПАВ существует некоторая оптимальная температура, при которой раствор обладает максимальной пенообразующей спо-
56
собностью. Как правило, выход за пределы этой температуры приводит к изменению растворимости, что снижает пенообразование.
В частности, для ионных ПАВ получены следующие данные (табл. 7). Таблица 7
Влияние температуры на пенообразование растворов некоторых ПАВ
|
|
|
Объем пены, см3 |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
Катион |
|
|
|
|
|
|
|
|
|
|
|
Анион |
|
Na+ |
|
|
K+ |
||
|
18 °C |
|
50 °C |
|
18 °C |
|
50 °C |
|
|
|
|
|
|
|
|
Пальмитат |
21,0 |
|
33,4 |
|
31,0 |
|
45,0 |
|
|
|
|
|
|
|
|
Стеарат |
30,0 |
|
44,0 |
|
36,0 |
|
48,0 |
|
|
|
|
|
|
|
|
Олеат |
6,0 |
|
5,6 |
|
0,8 |
|
10,0 |
|
|
|
|
|
|
|
|
3.4.Зависимость пенообразующей способности от концентрации ПАВ
Зависимость пенообразующей способности от концентрации ПАВ
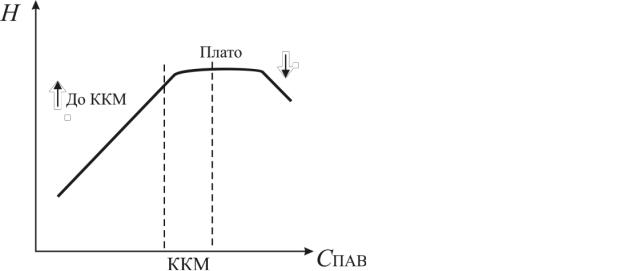
также проходит через максимум. Практически всегда максимум пенообразующей способности лежит в области величин ККМ1, после чего зависимость либо выходит на плато, либо снижается (рис. 33). При достижении ККМ1 величина адсорбции на границе раствор-воздух достигает максимального значения и, соответственно, максимальной пенообразующей способности, далее пенообразование снижается из-за затруднения диффузии ПАВ в поверхностный слой.
Рис. 33. Зависимость пенообразующей способности от концентрации ПАВ
57

3.5. Зависимость пенообразующей способности от величины поверхностного натяжения
Как правило, чем ниже поверхностное натяжение, тем выше пенообразующая способность, и, соответственно, больше кратность пены, как показано на рис. 34.
Рис. 34. Зависимость пенообразующей способности от величины поверхностного натяжения
3.6. Влияние величины рН растворов ПАВ на пенообразование
Влияние величины рН растворов ПАВ на пенообразование неоднозначно. В частности, растворы жирных кислоты и их солей практически не пенятся при рН<7. Оптимальная величина рН для таких ПАВ составляет
8−9.
Оксиэтилированные ПАВ хорошо пенятся в широком интервале рН = 3−9.
Растворы белков проявляют максимальную пенообразующую способность вблизи изоэлектрической точки (ИЭТ). В свою очередь, на положение ИЭТ существенное влияние оказывают электролиты.
4. Способы получения и разрушения пен
Как любая лиофобная система, пена может быть получена двумя способами – диспергированием и конденсацией. Под диспергированием в данном случае понимают перемешивание и барботаж; под конденсацией – любую химическую или биологическую реакцию, идущую с выделением газа.
58
Для разрушения пен используются определенные классы веществ, так называемые пеногасители. В настоящее время существует широкий круг пеногасителей – кремнийорганические, полимерные и пр. Необходимо отметить, что в лабораторной практике очень часто в качеств пеногасителей используются низкомолекулярные спирты − этанол и пропанол. Метанол не применяют в силу его токсичности. Низшие спирты разрушают адсорбционную пленку основного ПАВ, тем самым понижая его пенообразующую способность.
Рекомендуемая литература
1.Фролов Ю.Г. Курс коллоидной химии: поверхностные явления и дисперсные системы. М.: Химия, 1982. ( 3 изд. − 2004).
2.Адамсон А. Физическая химия поверхностей. М.: Мир, 1979.
3.Тихомиров В.К. Пены: теория и практика их получения и разрушения. М.: Химия, 1983. 282 с.
4.Поверхностно-активные вещества. Справочник / А.А. Абрамзон, В.В. Бочаров [и др.]; под ред. А.А. Абрамзона. Л.: Химия, 1979.
376 с.
5.Ланге К.Р. Поверхностно-активные вещества. Синтез, свойства, анализ и применение / пер. с англ. под ред. Л.П. Зайченко. СПб.: Профессия, 2005. 240 с.
59
ЛЕКЦИЯ 7. ГИДРОФИЛЬНО-ЛИПОФИЛЬНЫЙ БАЛАНС (ГЛБ). ПАРАМЕТР УПАКОВКИ
1. Понятие о гидрофильно-липофильном балансе. Шкалы ГЛБ
Как известно, молекула ПАВ является дифильной и состоит из углеводородного радикала и полярной головки. Для количественной характеристики соотношений гидрофильных и липофильных свойств молекул ПАВ используется понятие гидрофильно-липофильного баланса или чисел ГЛБ. Сама шкала ГЛБ достаточно условная, и существует ряд методов расчета чисел ГЛБ. Тем не менее, числа ГЛБ широко используются для характеристики ПАВ, в частности, они характеризуют области применения ПАВ (табл. 8).
|
|
|
Таблица 8 |
|
Значения ГЛБ и области применения ПАВ |
|
|
|
|
|
|
Числа |
Растворимость ПАВ в воде |
Область применения |
|
ГЛБ |
|
|
|
|
|
|
|
3−6 |
Не растворимо |
Эмульгатор |
обратных |
|
|
эмульсий |
|
|
|
|
|
7−8 |
Диспергируется |
Смачиватель |
|
|
|
|
|
8−15 |
Образует раствор от опалесцирующе- |
Эмульгатор |
прямых |
|
го до прозрачного |
эмульсий |
|
|
|
|
|
12−15 |
Образует прозрачный раствор |
Моющее вещество |
|
|
|
|
|
15−18 |
Образует прозрачный раствор |
Солюбилизатор |
|
|
|
|
|
Как уже говорилось, существует несколько методов для расчета чисел ГЛБ, рассмотрим некоторые из них.
1.1. Метод Гриффина
Данный метод является наиболее распространенным и основанным на избирательной способности ПАВ к стабилизации либо прямых (масло-
60
