
ПАВ_курс лекций
.pdf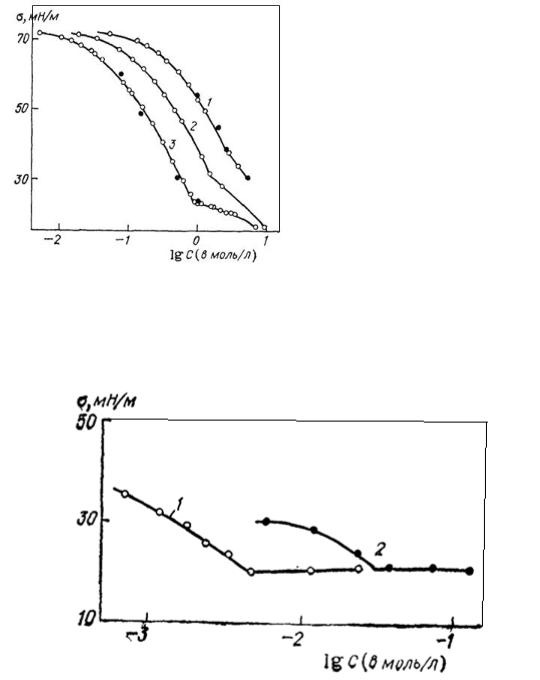
Это обусловлено высокой прочностью связи C-F и очень низкой энергией взаимодействия фторуглеродных цепей.
В частности, фторированные кислоты имеют очень высокую степень диссоциации и, следовательно, являются типичными анионными ПАВ. Так, на границе с воздухом для таких соединений получены данные, представленные на рис. 79.
Рис. 80. Изотермы поверхностного натяжения фторированных кислот:
1 − перфторуксусная;
2 – перфторпропионовая;
3 – перфтормасляная
Необходимо отметить, что фторированные ПАВ проявляют высокую поверхностную активность, а следовательно, и высокую адсорбционную способность и в органической среде, о чем свидетельствуют данные, показанные на рис. 80.
Рис. 80. Поверхностное натяжение пентадекафтордеканола-C7F15(CH2)3OH:
1 – в этиленгликоле; 2 − в тетрахлорэтилене
121
Существенным недостатком фторированных ПАВ является их токсичность и практически отсутствие биоразлагаемости.
2.ПАВ-близнецы (Gemini-ПАВ). Строение, синтез
иосновные свойства
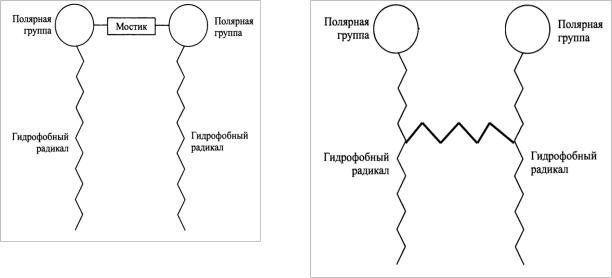
Молекулу димерного ПАВ (gemini-ПАВ) можно представить как две дифильные молекулы, соединенные мостиком (спейсером). Структура таких ПАВ в общем виде представлена на рис. 81.
Иногда такие ПАВ называют еще ПАВ-близнецы или бис-ПАВ. Мостик может быть гидрофильным или гидрофобным, жестким или гибким. Он связывает две молекулы по полярным группам или вблизи этих групп. Если мостик связывает не полярные группы, а углеводородные радикалы (см. рис. 82) , то такие ПАВ называются болаподобными. Свойства болаподобных ПАВ полностью отличаются от свойств димерных ПАВ и в этом разделе рассмотрены не будут.
Рис. 81. Строение димерных ПАВ |
Рис. 82. Болаподобные ПАВ |
Остановимся более подробно на способах получения и свойствах димерных ПАВ. На рис. 83 представлены некоторые примеры димерных ПАВ.
122
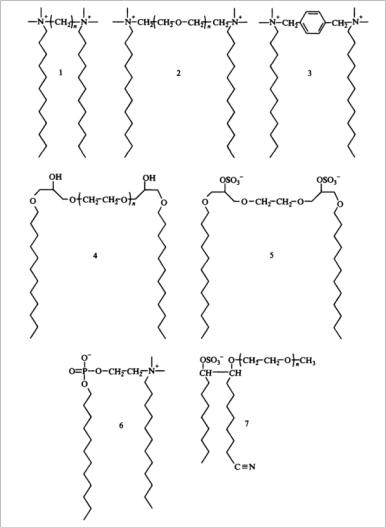
Рис. 83. Некоторые димерные ПАВ
2.1. Синтез димерных ПАВ
Катионные ПАВ обычно получают по реакции алкилдиметиламинов с α,ω-дигалогенпроизводными. Дибром-соединения обладают наибольшей реакционной способностью и обычно используются для синтеза в лабораторных условиях, дихлор-производные предпочтительнее в условиях крупномасштабного синтеза.
2R-N(CH3)3 + Br-X-Br R-N+(CH3)2-X-N+(CH3)2-R + 2Br – , где
R – алкильный радикал обычной для ПАВ длины, например, додецил-. Группа X алкилен − если нужен гидрофобный гибкий мостик;
-CH2CH(OH)CH2- или -CH2(CH2OCH2)nCH2- − чтобы получить гидро-
фильный гибкий мостик; наконец, CH2- -CH2- − если мостик должен быть гидрофобным и жестким ( − в этом случае – ароматическое кольцо).
123
В специальном, но весьма важном случае, если Х в представленной выше реакции должен быть группой -СН2СН2-, соединения типа HalCH2CH2Hal недостаточно реакционно способны. В этом случае приходится использовать другой путь синтеза:
2RBr + (CH3)2N-CH2CH2-N(CH3)2 R-N+(CH3)2-CH2CH2-N+(CH3)2-R + 2Br -
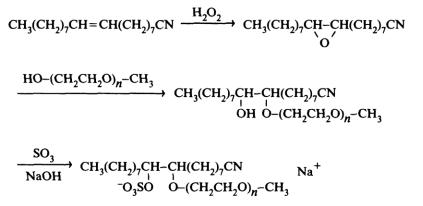
Анионные и неионные димерные ПАВ обычно получают путем раскрытия циклов биэпоксидов, в результате этой реакции в качестве промежуточного продукта получается бисгидроксиэфир. Ниже приведена возможная схема синтеза:
Рис. 84. Схема синтеза гетеродимерного ПАВ
2.2. Коллоидно-химические свойства димерных ПАВ
Уникальным свойством димерных ПАВ является то, что мицеллообразование в их растворах начинается при концентрациях на порядок ниже, чем для соответствующих мономерных ПАВ. Низкое значение ККМ – важнейшая характеристика, означающая, что димерные ПАВ очень эффективны при солюбилизаии неполярных соединений. Минимальное, в точке ККМ, поверхностное натяжение также существенно ниже, чем в случае мономерных ПАВ. В частности, для катионного димерного ПАВ это можно проиллюстрировать рис. 85.
Важно отметить, что динамика снижения поверхностного натяжения в случае димерных ПАВ также отличается от мономерных. Обнаружено, что в этом случае существенную роль играет природа и длина мостика. Чем длинее мостик и чем он более гибкий, тем меньше время снижения поверхностного натяжения.
124

Рис. 85. Изотермы поверхностного натяжения ПАВ:
1 − димерное ПАВ; 2 – мономер - C12H25N(CH3)3+Br-
Значения ККМ димерных ПАВ с гибкими мостиками, независимо от того, гидрофильные они или гидрофобные, гораздо ниже, чем у соответствующих ПАВ с жесткими мостиками. Это можно объяснить тем, что соединения первого типа легче упаковываются на межфазной поверхности.
Значения ККМ димерных ПАВ слабо зависят от полярности мостика, но они зависят от его длины, как показано на рис. 86.
Наличие максимума на этом рисунке связано с изменением конформации мостика, которая влияет на гидратацию полярной группы и на ориентацию алкильных цепей.
Рис. 86. Зависимоcть ККМ от числа метиленовых групп (s) в мостике для трех типов катионных ПАВ:
1– C10H21N(CH3)2 – (CH2)s – N(CH3)2C10H21+ Br-;
2− C12H25N(CH3)2–(CH2)s – N(CH3)2C12H25+ Br-;
3− C16H33N(CH3)2–(CH2)s – N(CH3)2C16H33+ Br-
125
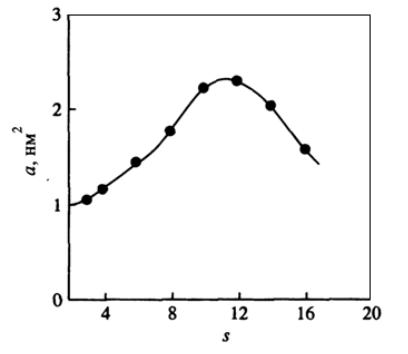
Площадь, которую занимает молекула ПАВ на поверхности водавоздух, достаточно велика. На рис. 87 показано изменение площади, приходящеймся на молекулу ПАВ, в зависимости от длины мостика для ряда катионных димерных ПАВ. Как видно, при длине мостика в 10−12 атомов углерода наблюдается максимальное значение площади.
Рис. 87. Зависимость посадочной площадки от длины мостика для катионного димер-
ного ПАВ: C12H25N(CH3)2 – (CH2)s – N(CH3)2C12H25+ Br-.
Такая зависимость объясняется изменением положения гидрофобного мостика на межфазной границе. При длине менее 10 атомов он располагается на поверхности почти плоско, занимая все большую и большую площадь с ростом числа метиленовых групп. При длине выше 12 атомов углерода, цепочка мостика начинает складываться в петли, которые частично могут выталкиваться в воздух, тем самым уменьшая посадочную площадку.
Интересной особенностью димерных ПАВ является также повышенная вязкость их растворов. Это обусловлено тем, что зачастую такие ПАВ образуют не сферические, а стержнеобразные мицеллы, упаковка которых значительно прочнее. Кроме того, при переходе одной формы мицелл к другой вязкость раствора может резко изменяться. В частности, для катионного димерного ПАВ получены данные, представленные на рис. 88.
126
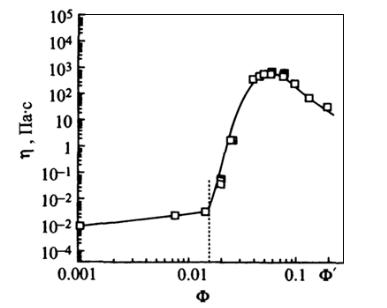
Рис. 88. Зависимость вязкости раствора димерного ПАВ
Необычные реологические свойства димерных ПАВ могут найти важные практические применения.
3. Экологически безопасные ПАВ
Молекулы традиционных ПАВ весьма устойчивы. Среди все ПАВ, используемых в быту, химически нестойкими являются только алкилсульфаты. Долгое время нестойкость таких ПАВ и, в частности, самого широко распространенного додецилсульфата натрия, к кислотному гидролизу рассматривалась как серьезная проблема. В настоящее время мнения изменились, поскольку вопросы экологии выходят на первый план. При деструкции ПАВ происходит потеря его поверхностной активности, что делает вещество с точки зрения экологии практически безопасным. Поэтому сейчас большое внимание уделяется синтезу ПАВ с легко разрушающимися связями, которые способны к деструкции и потере активности. Таким образом, необходимо синтезировать ПАВ с лабильными, легко разрушающимися связями.
Ниже будут представлены некоторые типы лабильных связей. Циклические ацетали. Лабильные ПАВ, производные циклических ацеталей – 1,3-диоксалана (пятичленный цикл) и 1,3-диоксана (шестичленный цикл) – схематично представлены на рис. 89.
127
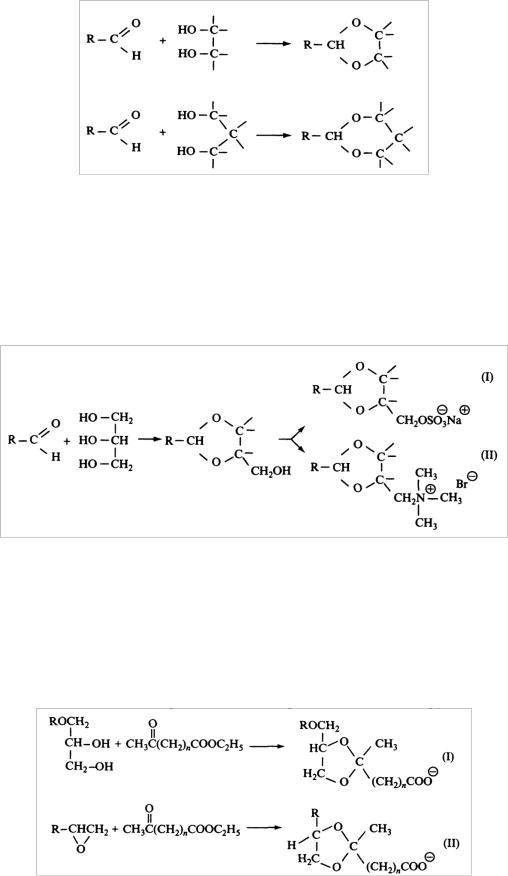
Рис. 89. Получение циклических ацеталей
Если реакцию проводить не с диолами, а с глицерином, образуется гидроксиацеталь. Модифицируя оставшуюся свободной гидроксильную группу, можно получать либо анионное, либо катионное ПАВ, как показано на рис. 90. Кислотный гидролиз таких соединений происходит достаточно легко при рН = 4−5.
Рис. 90. Примеры 1,3-диоксолановых ПАВ
Кетали. ПАВ, содержащие кетальные связи, можно получать из длинноцепочечных кетонов и диолов по аналогии с реакциями, рассмотренными выше. На рис. 91 представлены два способа получения таких ПАВ из эфиров кетокислот.
Рис. 91. Схема синтеза некоторых кеталей
128
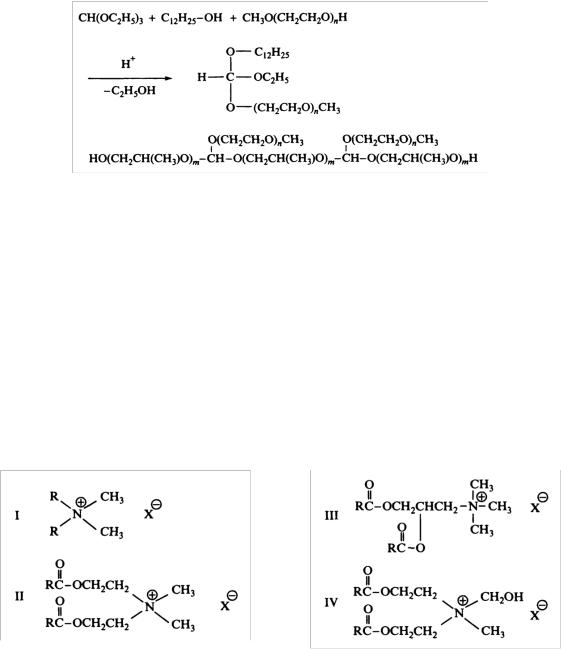
Ортоэфиры. Такие ПАВ относятся к новому классу недавно полученных соединений. Структуры молекул типичных ортоэфирных ПАВ и способы их получения приведены на рис. 92.
Рис. 92. Схема синтеза некоторых ортоэфиров
Все рассмотренные три класса соединений довольно легко гидролизуются в кислой среде. Остановимся теперь на некоторых соединениях, гидролизующихся под действием щелочи.
Нормальные сложные эфиры четвертичных аммониевых солей. Это ПАВ с общей формулой R4N+X, в которых длинноцепочечные радикалы присоединены к заряженной группе через сложноэфирную связь, как показано на рис. 93. Катионный заряд вблизи сложноэфирной связи делает такие соединения необычайно стабильными в кислых и лабильными в щелочных средах (рис. 94).
Рис. 93. Структура сложных эфиров четвертичных аммониевых солей
Эфиры бетаина. Простейший бетаин представляет собой соединение (CH3)3N+CH2COO-. Исключительно сильная зависимость от рН поведения таких ПАВ делает их чрезвычайно перспективными разрушающимися катионными ПАВ.
129
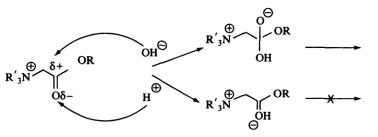
Рис. 94. Механизм кислотного и щелочного гидролиза эфиров бетаина
В заключение можно отметить, что кроме лабильных ПАВ, с легко гидролизующимися группами, поверхностная активность может быть потеряна при полимеризации, однако, полимерные (полимеризующиеся) ПАВ в данном курсе рассмотрены не будут.
Рекомендуемая литература
1.Поверхностно-активные вещества. Справочник / А.А. Абрамзон, В.В. Бочаров [и др.]; под ред. А.А. Абрамзона. Л.: Химия, 1979.
376 с.
2.Поверхностно-активные вещества и полимеры в водных растворах/ К. Холмберг, Б. Йѐнссон, Б. Кронберг, Б. Линдман. М.:
БИНОМ, 2007. 528 с.
130
