
ПАВ_курс лекций
.pdf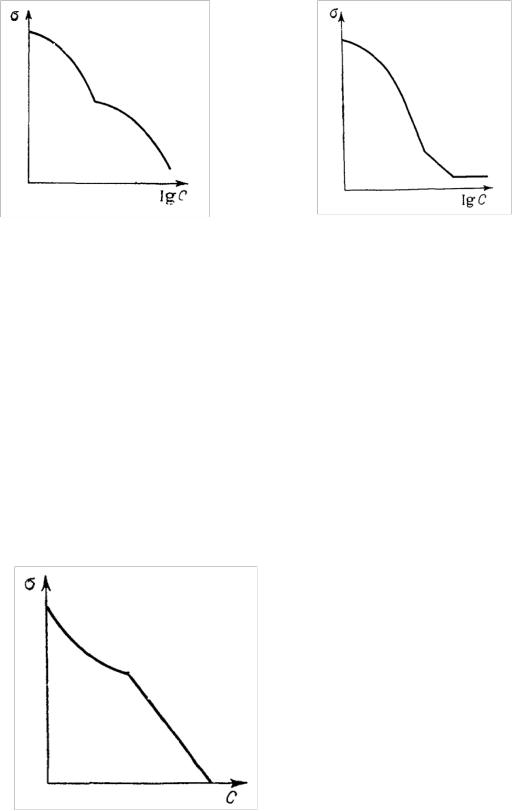
Для низших членов гомологических рядов ПАВ (кислот, аминов, спиртов), неограниченно растворимых в воде, характерна изотерма, показанная на рис. 18.
Иногда встречаются изотермы вида, представленного на рис. 19.
Рис. 18. Изотерма поверхностного |
Рис. 19. Изотерма поверхностного |
натяжения для гомологических рядов |
натяжения в случае образования |
ПАВ, неограниченно растворимых |
смешанных мицелл |
в воде |
|
Некоторые исследователи объясняют два перегиба наличием нескольких видов мицелл и, следовательно, нескольких ККМ, соответствующих каждому излому.
2.2.Изотерма межфазного натяжения на границе жидкость-жидкость
Всистемах жидкость-жидкость, если ПАВ неограниченно смешивается с жидкостями обеих фаз (например, циклогексиламин-толуол-вода или пропионовая кислота-гексан-вода) изотерма имеет вид, изображенный на рис. 20.
Рис. 20. Изотерма межфазного натяжения на границе жидкость-жидкость
41
Начальный (криволинейный) участок обусловлен процессом адсорбции ПАВ на межфазной границе, а прямолинейный – понижением поверхностного натяжения благодаря смешению жидких фаз и уменьшению разности их полярностей при увеличении концентрации ПАВ.
Переходим к непосредственному рассмотрению пленок ПАВ на поверхности жидкой фазы.
3. Поверхностные (адсорбционные) пленки ПАВ
3.1. Газообразные пленки
Перейдем к рассмотрению пленок, образованных на поверхности жидкости поверхностно-активными веществами. Из общего курса коллоидной химии известно, что такие пленки изучаются с помощью весов Лэнгмюра. При низких концентрациях ПАВ в водном растворе изотерма поверхностного натяжения имеет линейный вид и описывается следующим уравнением:
(67)
где σ и σ0 – поверхностные натяжения раствора и растворителя, соответственно; R – универсальная газовая постоянная; Т – температура; Kг – константа Генри; с – концентрация раствора.
Разность (σ0− σ) представляет собой поверхностное давление, обозначаемое как π.
(68)
С другой стороны, произведение константы Генри на концентрацию есть величина адсорбции А = Kг·с, тогда:
и и |
(69) |
|
|
|
|
Величина, обратная адсорбции, представляет собой площадь, занимаемую 1 моль ПАВ, т. е. SM .
Таким образом, получаем:
(70)
Итак, при низких концентрациях растворов ПАВ на поверхности формируются пленки, поведение которых описывается полученным урав-
42
нением |
, аналогичным уравнению Менделеева−Клайперона, за- |
|
писанному для 1 моль: |
. |
|
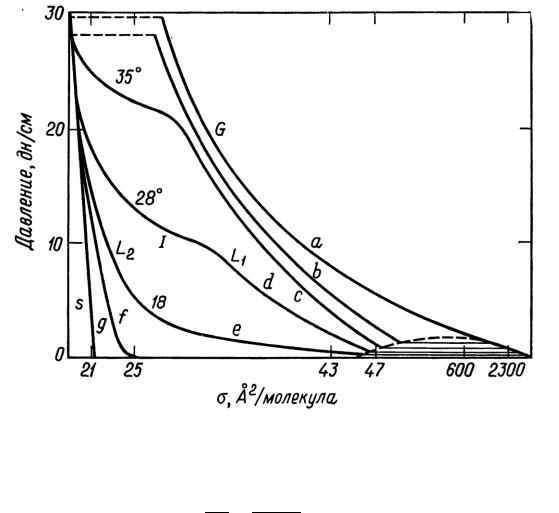
На рис. 21 представлены типичные изотермы поверхностного давления для различных случаев. Газообразные пленки обозначены на этом рисунке буквой G.
При повышенных концентрациях ПАВ в водных растворах изотерма
поверхностного натяжения описывается уравнением Шишковского: |
|
|||||
( |
) |
(71) |
||||
( |
) |
(72) |
||||
|
|
|
|
|
|
(73) |
|
|
|
|
|
|
|
( |
) |
|
|
|||
Рис. 21. Типичные изотермы поверхностного давления
Введем допущение о том, что (К·с)<<1, тогда
(74)
43

Вспомним уравнение Лэнгмюра в линейной форме:
(75)
тогда
(76)
Величина , т.е. когда вся поверхность заполнена молекулами
ПАВ (частокол Лэнгмюра). Величина β характеризует собственные размеры молекул ПАВ. В итоге получаем:
( |
) |
(77) |
В этом случае поведение адсорбционных пленок ПАВ аналогично уже не идеальному, а реальному газу, т.е. с учетом собственных размеров молекул.
Зная уравнения состояния пленок и изотермы поверхностного давления, можно рассчитать основные параметры адсорбционного слоя – площадь, занимаемую молекулой в плотном слое (посадочную площадку) – ω и толщину адсорбционного слоя − δ.
(78)
и
(79)
где VM – мольный объем; NA – число Авогадро.
3.2. Жидкообразные пленки
При дальнейшем повышении концентрации ПАВ в растворе возможно взаимодействие между молекулами ПАВ и начало конденсация пленки. В этом случае уравнение состояния пленки может быть описано следующим образом, аналогичное поведению двумерного газа:
( |
|
) ( |
) |
(80) |
|
|
|||
|
|
где параметр α характеризует взаимодействие между молекулами.
44
Конденсация в пленках приводит к формированию так называемых жидкообразных пленок, которые можно разделить на два типа – растянутые жидкие пленки – L1 и конденсированные пленки − L2.
Рассмотрим несколько подробнее и те, и другие, начиная с пленок L1. Такие пленки, как правило, однофазны и при низких давлениях легко переходят в газообразное состояние. Состояние L1 наблюдается преимущественно для длинноцепочечных ПАВ с сильно полярными группами – кислот, спиртов, амидов и нитрилов. Если молекула ПАВ имеет несколько полярных групп, то также, как правило, формируются пленки L1. ПАВ с дву-
мя короткими радикалами тоже чаще всего образуют пленку L1.
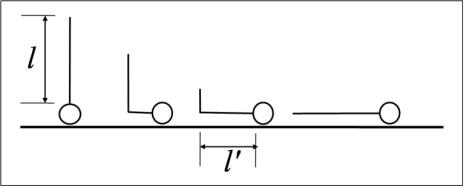
Состояние L1 удобно интерпретировать с помощью модели Миттельмана и Пальмера, согласно которой растянутая двумерная жидкость рассматривается как промежуточное состояние между газообразной пленкой, в которой все молекулы лежат на поверхности, и конденсированной пленкой, в которой все они ориентированы перпендикулярно поверхности (рис.
22).
При этом предполагается, что различные возможные конфигурации
характеризуются статистическим распределением. |
|
|
Энергия конфигурации описывается выражением: |
|
|
( |
) |
(81) |
где al − работа против поверхностного давления; а − ширина цепи; l − длина цепи на поверхности; ω – работа адгезии группы СН2 – к воде и − работа вращения связи С-С (около 800 кал/моль).
Рис. 22. Модель образования пленки L1-типа
45
Вероятность каждой конфигурации определяется формулой Больцмана:
* |
( |
) |
+ |
(82) |
|
|
|
Тогда средняя площадь, приходящаяся на 1 молекулу, равна:
∑ |
[ |
( |
) |
] |
(83) |
||
|
|
|
|
||||
|
|
|
|
|
|
|
|
∑ |
[ |
( |
) |
] |
|
|
|
|
|
|
|
||||
где σn – площадь полярной группы.
Это уравнение было экспериментально подтверждено на растворах олеиновой кислоты.
Несколько другая модель приводит к следующей разновидности двумерного уравнения Ван-дер-Ваальса:
( |
|
) [ ( |
|
) ] |
(84) |
|
|
|
|||
|
|
|
Эта модель предполагает, что пленка состоит из множества подвижных дисков диаметром d. Поправочный множитель (1−σ0/σ) берется из статистической теории двумерной жидкости, состоящей из твердых дисков с σ0 = πd2/4. Коэффициент а, характеризующий взаимное притяжение молекул, записывается в виде а = nεσ0, где n – число групп СН2-дисков, а ε – мера энергии взаимодействия между соседними группами СН2 –. Последнее уравнение хорошо описывает многочисленные экспериментальные данные и потому заслуживает дальнейшего использования и уточнения.
Пленки типа L2 представляют собой конденсированные пленки, содержащие то или иное количество растворителя (воды) между полярными группами ПАВ. При сжатии вода выдавливается из пленки до тех пор, пока не сформируется твердая пленка. В тех случаях, когда полярные группы ПАВ велики, предполагается, что они укладываются в шахматном порядке, т.е. при сжатии может происходить перестройка пленки.
Формирование пленки такого типа происходит через некоторое промежуточное состояние (I-пленки), что проиллюстрировано на рис. 23.
46
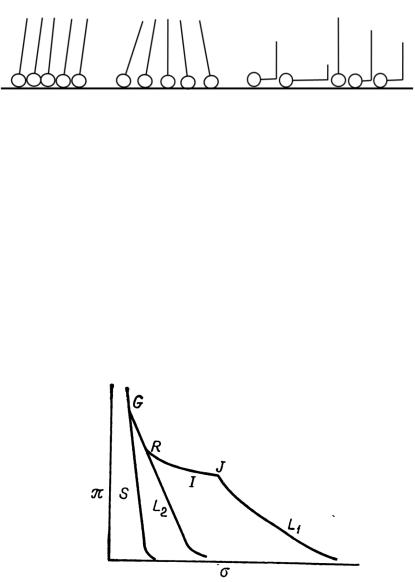
Рис. 23. Модель формирования пленки L2
Как правило, пленку L2 формируют молекулы ПАВ, состоящие из очень длинных цепей и больших полярных головок, чаще всего это трансизомеры. Однозначной модели для описания таких пленок нет.
3.3. Твердые пленки
Пленки S-типа (рис. 24) отличаются высокой плотностью и имеют вид либо жесткой, либо пластичной фазы.
Рис. 24. Изотерма поверхностного давления конденсированных пленок
Большинство жирных кислот и спиртов дают пленки этого типа при достаточно низких температурах или при наличии длинных углеводородных цепей. В этом случае уравнение состояния имеет довольно простой вид:
(85)
где
В заключение коснемся некоторых факторов, влияющих на формирование пленки того или иного типа.
Влияние некоторых факторов на тип пленки:
1. Длина цепи. Чем длиннее углеводородный радикал, тем, как правило, конденсированнее пленка.
47
2.Температура. Чем ниже температура, тем более вероятен S-тип образующейся пленки. Увеличение длины цепи на 1 метиленовую группу эквивалентно снижению температуры на 5 ºС.
3.Структура молекулы ПАВ. В случае длинных цепей или при низкой температуре образуются твердые пленки или пленки типа L2. Соединения, содержащие большие массивные полярные группы, чаще образуют пленку L2, чем S-типа. Молекулы ПАВ, содержащие несколько полярных групп, преимущественно образуют пленки L1-типа. Пленки сложных соединений (белков, стиролов, полимеров и пр.) обладают менее четко выраженными фазовыми свойствами, и их подразделяют на преимущественно твердые, преимущественно жидкие и аморфные. В случае смесей ПАВ (образования смешанных пленок), можно говорить о том, что обычно раствор двух пленок L-типа дают смешанную пленку такого же типа. При смешении пленок типа S и L1 , в итоге, как правило, образуется L2.
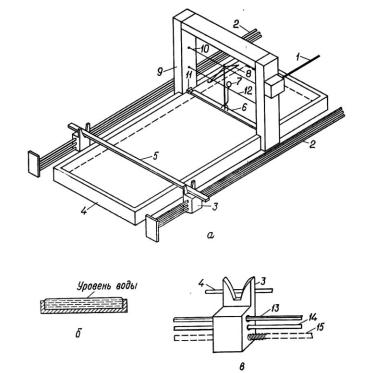
Необходимо напомнить, что поверхностное давление измеряется на весах Ленгмюра, схема которых представлена ниже (рис. 25).
Рис. 25. Схема весов Ленгмюра:
1 – контроль закручивания торсионной проволоки; 2 – привод подвижного барьера; 3 – держатель барьера; 4 – ванна; 5 – барьер; 6 – поплавок; 7 – зеркальце; 8 – коромысло для
калибровки; 9 – стойка; 10 – торсионная проволока; 11 – барьеры из золотой фольги; 12 – проволочный держатель; 13 – контроль уровня подвижного барьера; 14 – направляющая;
15 – винтовая передача
48
Рекомендуемая литература
1.Фролов Ю.Г. Курс коллоидной химии: поверхностные явления и дисперсные системы. М.: Химия, 1982. ( 3 изд. − 2004).
2.Адамсон А. Физическая химия поверхностей. М.: Мир, 1979.
3.Оно С., Кондо С. Молекулярная теория поверхностного натяжения в жидкостях. М.: ИИЛ,1963.
4.Поверхностно-активные вещества. Справочник / А.А. Абрамзон, В.В. Бочаров [и др.]; под ред. А.А. Абрамзона. Л.: Химия, 1979.
376 с.
49
ЛЕКЦИЯ 6. ПЕНЫ И ИХ ОСНОВНЫЕ КОЛЛОИДНО-ХИМИЧЕСКИЕ ХАРАКТЕРИСТИКИ
1. Строение пен
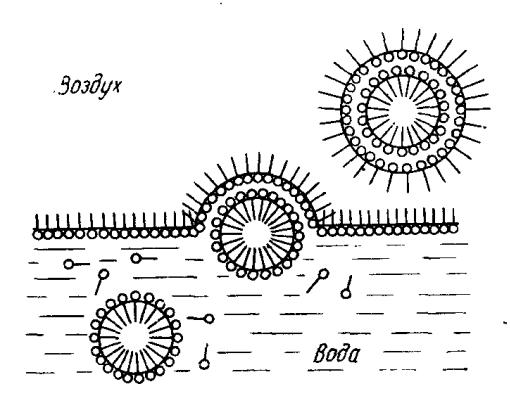
Первой стадией процесса пенообразования является формирование газовой эмульсии (эмульсии газ (воздух) – раствор ПАВ). На межфазной поверхности пузырьков образуется адсорбционный слой ПАВ, как показано на рис. 26.
Рис. 26. Схема образования пузырьков пены на поверхности воды
При флокуляции пузырьков на поверхности раствора формируется пленочный каркас пены, в котором прослойки жидкости между адсорбционными слоями ПАВ на пузырьках пены взаимосвязаны, благодаря чему образуется единая структура.
Структура пены определяется соотношением объемов газовой и жидкой фаз. В зависимости от этого соотношения пены могут иметь сферическую форму ячейки (сферические пены), полиэдрическую форму ячейки (полиэдрические пены), а также переходную ячеистую форму ячейки (рис. 27).
50
