
Леонтева Сборник лабораторныкх работ по физике Молекулярная физика 2015
.pdf
3.ТЕПЛОВЫЕ ЯВЛЕНИЯ В ТВЕРДЫХ ТЕЛАХ
ИЖИДКОСТЯХ
ВВЕДЕНИЕ К РАБОТАМ № 27–31
Теплоёмкостью тела C называется величина, численно равная количеству тепла, которое нужно сообщить телу, чтобы изменить его температуру на один градус:
C= δQ. δT
Теплоёмкость тела является аддитивной величиной, пропорцио- нальной массе тела. Тепловые свойства вещества характеризуются удельной теплоёмкостью, т.е. теплоёмкостью единицы массы тела. Очевидно, что между удельной теплоёмкостью c и теплоёмкостью тела C существует соотношение
С = mc,
где m – масса тела.
Данное здесь определение теплоёмкости само по себе ещё недо- статочно, так как требуемое для нагревания количество тепла зави- сит не только от изменения температуры, но и от других условий, в которых проводится нагревание. Поэтому определяют теплоём- кость с указанием условий, при которых происходит нагревание, в частности: теплоёмкость при постоянном давлении, теплоёмкость при постоянном объёме.
В дальнейшем преимущественно будем пользоваться молярной теплоёмкостью – теплоёмкостью одного моля, обозначая её C с соответствующим индексом: так CV – молярная теплоёмкость при постоянном объёме, CP – молярная теплоёмкость при постоянном давлении.
Из первого начала термодинамики δQ = dE + PdV следует, что при постоянном объёме V количество тепла δQ равно приращению внутренней энергии тела dE. Поэтому если вещество взято в коли- честве одного моля, то
∂ E
CV = ∂ T V .
61

Индекс V у производной означает, что дифференцирование про- изводится при постоянном объёме. Это указание необходимо, так как внутренняя энергия тела может зависеть не только от его тем- пературы, но и от других величин, характеризующих состояние те- ла. Поэтому результат дифференцирования зависит от того, какая именно из этих величин предполагается постоянной.
Если тело нагревается при постоянном давлении Р, то
δQ = dE + PdV = d(E + PV) (P = const).
Мы видим, что количество тепла, полученное телом, оказывает- ся равным приращению величины W = E + PV, которая называется энтальпией тела (употребляется также название «теплосодержа- ние»). Таким образом,
∂ W
CP = ∂ T P . Всегда выполняется соотношение
CP ≥ CV.
Можно установить общее соотношение между удельными теп- лоёмкостями CP и CV:
|
|
|
|
|
|
|
|
|
|
− C = T |
α2 |
|
|
|
|
|
|
|
|
|
C |
P |
|
, |
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
V |
ρβ |
||
|
|
|
|
|
|
|
|
|
|
|
||
где Т |
– абсолютная температура |
тела, ρ – его плотность, |
||||||||||
α = |
1 |
|
∂ V |
– термический коэффициент объёмного расширения, |
||||||||
|
|
|
|
|
|
|||||||
|
|
|
|
|||||||||
|
V |
|
∂ T P |
|
|
|
|
|||||
β = − |
|
1 ∂ V |
|
|
|
|
||||||
|
|
|
|
|
– изотермическая сжимаемость тела. |
|||||||
|
|
|
|
|||||||||
|
V ∂ p |
T |
|
|
|
|
||||||
У всех твёрдых тел коэффициент теплового расширения мал (α ~ 10-5 град-1), поэтому CP и CV незначительно отличаются друг от друга (у железа, например, отношение теплоёмкостей CP/CV = 1,02), и можно не делать между ними различия, говоря просто об удель- ной теплоёмкости твёрдого тела С.
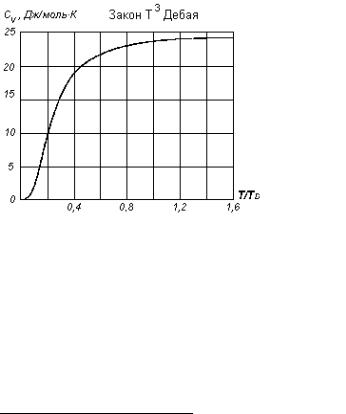
Согласно теореме Нернста CV → 0 при T → 0, поэтому CV с по- нижением температуры должна убывать. В диэлектриках с про- стыми кристаллическими решётками CV (T/TD)3 (закон кубов Де- бая) при малых Т, а в области высоких температур CV = 3R (закон Дюлонга и Пти). Низкими или, соответственно, высокими являют-
62
ся температуры, которые удовлетворяют соответственно неравен- ствам:
T << TD, T >> TD,
где TD – так называемая температура Дебая. Различные вещества имеют разные температуры Дебая, которые для большинства ве- ществ составляют несколько сот градусов Кельвина.
Если рассматривать зависимость CV от T/TD, то она оказывается универсальной для всех твёрдых тел с простыми кристаллическими решётками. На рис. 3.1 приведён график зависимости молярной теплоёмкости кристалла с простой кристаллической решёткой от температуры.
Рис. 3.1
В молекулярных кристаллах зависимость CV от Т носит более сложный характер. В металлах вклад в теплоёмкость вносят также и электроны проводимости. Правда этот вклад весьма мал, так что его следует учитывать либо при очень низких температурах, когда теплоёмкость кристаллической решётки становится очень малой, что происходит при температурах порядка нескольких градусов
Кельвина, либо при очень точных измерениях в области высоких температур (T > TD)1.
1 Теплоёмкость электронного газа CV ~ RT/T0, где T0 – так называемая тем- пература вырождения, она имеет величину 104 К.
63

Все эти особенности поведения теплоёмкости при низких тем- пературах объясняются квантовыми эффектами. Если тело нагрето неравномерно, то в нем возникают потоки тепла, направленные из мест с высокой температурой в места с низкой температурой. Со- отношение между потоком тепла dQ, протекающим за время dt, че- рез однородную пластинку толщины dx и площади S при разности температур dT на ее поверхностях определяется законом Фурье:
dQ = − k d T S dt, d x
где k – коэффициент, характеризующий свойства среды и называе- мый коэффициентом теплопроводности.
Процесс теплопроводности в жидкостях и газах носит более сложный характер, так как наличие различных температур в раз- ных точках жидкости обычно приводит к возникновению макро- скопических движений в жидкости (конвекции). Перенос тепла при конвекции обусловлен движением жидкости (газа) и не подчиняет- ся закону Фурье. Теплообмен твёрдого тела с газом или жидкостью подчиняется закону Ньютона, согласно которому q – тепло теряе- мое (или поглощаемое) единицей площади поверхности тела в еди- ницу времени определяется разностью температур T тела и окру- жающей его среды:
Q = α T,
где α – коэффициент, зависящий от свойств поверхности тела и среды.
Нагревание твёрдого тела приводит к изменению его размеров (тепловое расширение), а при достаточно высоких температурах происходит плавление тела. Причины теплового расширения твёр- дых тел можно понять, если учесть ангармоничность тепловых ко- лебаний атомов в кристаллической решётке. Если обозначить через x смещение атома от его положения равновесия, то с учётом ангар- монизма потенциальную энергию атомов можно записать в виде
U(x) = ax2 – bx3,
где а и b – положительные константы.
Второе слагаемое описывает асимметрию потенциальной энер- гии, т.е. учитывает ангармонизм колебаний.
64

Обычно это слагаемое мало по сравнению с первым членом раз- ложения1.
Оценим среднее смещение атома от положения равновесия, счи- тая среднюю за период колебаний силу, действующую на атом, равной нулю:
F = − |
dU |
|
= −2a x + 3b x2 = 0. |
||||
dx |
|||||||
|
|
|
|
|
|||
Отсюда находим |
|
|
|
|
|||
|
|
|
= |
3b |
x2 |
||
|
|
x |
|
|
. |
||
|
|
|
|
||||
|
|
|
|
2a |
|||
Средний квадрат смещения x2 найдём, считая ангармоничность колебаний малой, что позволяет воспользоваться теоремой о рав- нораспределении тепловой энергии по степеням свободы, согласно которой
E = U = |
1 |
a x2 |
= |
kT |
. |
|||||||
|
|
|
||||||||||
кин |
2 |
|
|
|
2 |
|
||||||
|
|
|
|
|
||||||||
Откуда |
|
|
|
|
|
|
|
|
|
|
|
|
|
x 2 = |
k T |
. |
|
|
|
||||||
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
a |
|
|
|
|
|
Тем самым, получим: |
|
|
|
|
|
|
|
|
|
|
|
|
|
x = |
3 |
|
|
|
b |
k T. |
|
|
|
||
|
|
a2 |
|
|
|
|||||||
|
2 |
|
|
|
|
|
|
|
||||
Равновесное положение каждого атома в решётке определяется взаимодействием его с соседними атомами. Поэтому x показывает изменение среднего расстояния между атомами решётки. Как сле- дует из полученного результата, среднее увеличение равновесного расстояния между атомами x растёт с ростом температуры по ли- нейному закону, что представляет собой обычное свойство тепло- вого расширения: размер тела растёт линейно с ростом температу-
1 В принципе, в разложении потенциальной энергии по степеням x есть слагаемые любых порядков по x. Но так как нас интересует лишь каче- ственная сторона явления, то достаточно ограничиться лишь первой ан- гармонической поправкой порядка x3, так как все остальные члены разло- жения с более высокими степенями x малы по сравнению с учтёнными нами первыми членами разложения (ax2-bx3).
65
ры. Кроме того, тепловое расширение обусловлено именно ангар- монизмом тепловых колебаний, так как x b. Связать подобным же образом постоянные а и b с температурой плавления тела не удаётся, хотя ясно, что плавление тоже связано с эффектами ангар- монизма колебаний решётки.
Переход тела из одного агрегатного состояния в другое (фазо- вый переход) происходит при определённой температуре, которая зависит от давления. Эта зависимость описывается уравнением Клапейрона–Клаузиуса:
dP |
= |
λ |
, |
|
T ( V2 − V1 ) |
||
dT |
|
||
где V2 и V1 удельные (на единицу массы) объёмы тела в соответ- ствующих агрегатных состояниях (фазах), λ – удельная теплота фа- зового перехода из состояния 1 в состояние 2, т.е. то количество тепла, которое необходимо сообщить единице массы тела, чтобы осуществить этот переход.
Если при фазовом переходе T = const, то и P = const. Но тогда количество тепла, полученное телом при фазовом переходе:
λ = Q = E + P V = (E + PV) = W.
Иными словами, удельная теплота фазового перехода равна приращению энтальпии тела при фазовом переходе.
Следует иметь в виду, что достижение температуры, при кото- рой возможен фазовый переход, ещё не означает, что этот переход непременно осуществится. Дело в том, что образование новой фазы начинается в отдельных точках тела, где образуются зародыши но- вой фазы. Размеры этих зародышей малы, поэтому благодаря дей- ствию сил поверхностного натяжения давление в них будет боль- ше, чем в окружающем их веществе. Это нарушает тепловое равно- весие зародыша и тела, и зародыши начинают уменьшаться вплоть до исчезновения.
Образованию и росту зародышей способствуют различные де- фекты в теле (примеси и т. д.). Кроме того, большинство твёрдых тел смачивается их расплавом полностью, а это означает, что плав- ление начинается с поверхности тел. В самом деле, если, например, при плавлении капля расплава образовалась на поверхности тела, то она растечётся по его поверхности и давление в ней будет равно
66
атмосферному, так как радиус кривизны такой капли R очень ве- лик, а поверхностное давление 1/R окажется пренебрежимо ма- лым. Наблюдать перегрев в таких веществах можно лишь в том случае, когда нагрев тела происходит изнутри, например, электри- ческим током, а поверхность его при этом интенсивно обдувается холодным воздухом. Также в случае окисленной поверхности воз- можен перегрев тела при плавлении, так как температура плавле- ния окисла несколько отличается от температуры плавления чисто- го кристалла. Тогда плавление может начаться изнутри, а в этом случае важную роль будет играть эффект поверхностного натяже- ния, который и приведёт к перегреву. Аналогичные процессы име- ют место и при фазовых переходах жидкость – газ.
Работа № 27
ОПРЕДЕЛЕНИЕ УДЕЛЬНОЙ ТЕПЛОЕМКОСТИ ТВЕРДЫХ ТЕЛ КАЛОРИМЕТРИЧЕСКИМ МЕТОДОМ
Цель работы: определить удельную теплоёмкость тела, прове- рить выполнение закона Дюлонга и Пти.
Приборы и принадлежности: калориметр с мешалкой, термо- метр, нагреватель, латунный стакан с подвижным дном, электро- плитка, барометр-анероид, таблицы, исследуемое вещество.
Описание установки и методика измерений
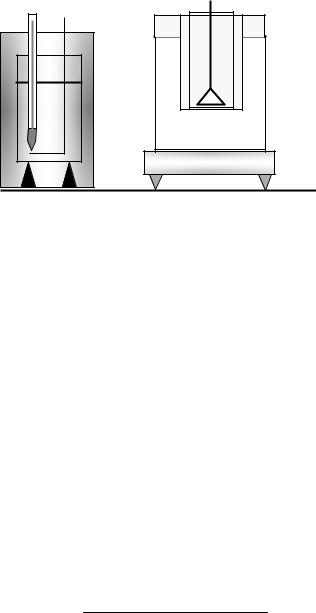
На рис. 3.2 изображена установка для проведения опыта, кото- рая состоит из калориметра К, водяного нагревателя Н, и специ- ального латунного стакана Л.
Калориметр К представляет собой два цилиндра (внешний – пластмассовый и внутренний – алюминиевый), разделённых воз- душным зазором и подставкой из плохо проводящего тепло мате- риала (для уменьшения тепловых потерь за счёт теплопроводно- сти). Калориметр имеет мешалку М и термометр Т.
67
Т |
М |
|
К |
Л
Н |
Рис. 3.2
Для нагревания исследуемого тела используется специальный латунный стакан Л, устроенный так, чтобы можно было быстро, избежав нежелательного охлаждения, перенести исследуемое тело из нагревателя в калориметр. Исследуемое тело (металлические дробинки и т.п.) помещается в латунный стакан. Стакан устанавли- вается в углублении съёмной крышки водяного нагревателя Н. Та- кая конструкция нагревателя позволяет сохранить исследуемое те- ло сухим. Для подогрева нагревателя используется бытовая элек- трическая плитка.
Тело массы m с неизвестной теплоёмкостью Сx, нагретое в нагревателе до температуры t, опускают с помощью латунного ста- кана в калориметр. Охлаждаясь, тело нагревает калориметр и нали- тую в него воду от начальной температуры t0 до температуры θ. Зная массу воды Мводы, налитой в калориметр, массу калориметра (алюминиевого стакана) с мешалкой mAl, их удельные теплоёмко- сти Своды и СAl соответственно и начальную температуру воды и ка- лориметра t0, легко составить уравнение теплового баланса. Если пренебречь потерями тепла в окружающую среду, то можно запи- сать:
Cxm(t – θ) = Mводы Cводы (θ – t0) + mAlCAl (θ – t0),
откуда искомая удельная теплоёмкость
Cx = (M воды Cводы + mAl CAl ) ( θ − t0 ),
m ( t − θ)
68

а её относительная погрешность1
Cx |
= |
(θ − t0 ) + |
(t − θ). |
|
|||
Cx |
θ − t0 |
t − θ |
|
Заметим, что величина погрешности убывает с увеличением разности θ – t0, которую следует сделать максимально возможной. Температура θ в условиях эксперимента зависит от массы воды, налитой в калориметр. Чем меньше воды, тем сильнее она нагрева- ется. Поэтому количество воды следует брать как можно меньшим: объём её должен быть таким, чтобы она лишь слегка покрыла тело, опущенное в калориметр.
Порядок выполнения работы
1. Взвесьте исследуемый металл (дробь) на технических весах и запишите результаты в табл. 3.1. Поместите дробь в латунный ста- кан и установите стакан в углубление (см. рис. 3.2) крышки нагре- вателя. Предварительно проверьте, есть ли в нагревателе вода, и, если слой воды не менее 2–3 см, можно включить электроплитку и начать нагрев.
Таблица 3.1
т, г |
mAl |
CAl |
Mводы |
Cводы |
t0 |
t |
θ |
|
|
|
|
|
|
|
|
Cx |
|
|
|
|
|
|
|
Cx |
|
|
|
|
|
|
|
2.Пока вода в нагревателе будет нагреваться, взвесьте внутрен- ний сосуд калориметра вместе с мешалкой (вынув термометр). За- пишите полученный результат в табл. 3.1.
3.Наполните калориметр водой комнатной температуры (воду получите у лаборанта) так, чтобы толщина слоя воды составляла 2–
3 см, взвесьте его и определите массу воды Мводы. Запишите полу- ченный результат в табл. 3.1.
4. Поставьте калориметр с водой во внешний сосуд, опустите в него термометр и перед тем, как переносить в него исследуемое те-
1 Мы пренебрегли здесь погрешностью измерения масс.
69
ло, отметьте начальную температуру t0 воды и калориметра. Запи- шите полученный результат в таблицу 3.1.
5.Когда исследуемое тело в нагревателе прогреется (нагрев при температуре кипения воды t вести 15–20 мин), отметьте температу- ру, до которой нагрелась дробь, и запишите её в таблицу 3.1. После этого выньте за изолирующую ручку стакан из нагревателя и по возможности быстрее, не касаясь воды дном стакана, опустите ме- талл в калориметр. Сразу же начните следить за повышением тем- пературы.
6.Заметьте максимальную температуру θ, до которой нагревается вода в калориметре и запишите её в табл. 3.1.
7.Запишите в табл. 3.1. значения теплоёмкости воды и алюми- ния. Нанные возьмите из справочника.
8.По данным взвешиваний, измерений давления и температуры подсчитайте удельную теплоёмкость Сх. Зная молярную массу ве- щества тела, определите его молярную теплоёмкость. Запишите ре- зультаты в тетрадь. Сравните молярную теплоёмкость с тем значе- нием, которое даётся законом Дюлонга и Пти.
9.Если ваш результат заметно отличается от закона Дюлонга и Пти, оцените по графику на рис. 3.1 температуру Дебая.
10.Оцените погрешности измерений.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1.Что называется теплоёмкостью тела, удельной теплоёмкостью?
2.Что можно сказать о разности теплоёмкостей СР и СV для твёрдых
тел?
3.Как зависит теплоёмкость твёрдого тела от температуры?
4.Докажите закон Дюлонга и Пти.
5.Что называется характеристической температурой Дебая?
6.Если полученная вами молярная теплоёмкость соответствует зако- ну Дюлонга и Пти, то что вы можете сказать о температуре Дебая для данного металла?
7.Как используется в работе уравнение теплового баланса для опре- деления удельной теплоёмкости?
8.Что в данной работе является основным источником погрешно-
стей?
70
