
новая папка / аку 47=298
.pdf
РАЗДЕЛ I
136 |
МЕТОДЫ ДИАГНОСТИКИ |
•обследование на наличие возбудителей TORCH-комплекса и присутствие
HBSAg и анти-HCV (при первом посещении; тест на гепатиты В и С необходимо повторить в III триместре беременности).
При невынашивании беременности, обусловленном инфекцией, дополнительно
крутинному обследованию необходимо провести:
•бактериоскопическое и бактериологическое мониторирование отделяемого влагалища и цервикального канала (1 раз в 2–3 нед на протяжении всей беременности);
•исследование на наличие вирусов в отделяемом цервикального канала (1 раз в 2–3 нед на протяжении всей беременности).
Замечания по проведению других дополнительных тестов:
•Нет необходимости проводить бактериологическое исследование или ПЦР вагинального отделяемого на Gardnerella vaginalis, Ureaplasma urealyticum и Mycoplasma hominis, так как результаты не имеют диагностического значения при отсутствии клинических симптомов воспаления.
•Микробиологическое исследование с количественным определением дрожжеподобных грибов и их видовая идентификация целесообразны при обследовании пациенток с хроническим рецидивирующим кандидозом, особенно при проведении противорецидивной поддерживающей терапии. В остальных случаях можно ограничиться микроскопическим исследованием клинических материалов.
•Бактериологическое или ПЦР-исследование на генитальные микоплазмы проводят по показаниям: наличие воспалительных заболеваний нижних отделов мочеполового тракта при отсутствии патогенных микроорганизмов, осложнённое течение настоящей беременности, предполагающее возможное инфицирование плода (для выявления M. genitalium используют исключительно ПЦР, для других микоплазм и уреаплазм — культуральный метод или ПЦР в реальном времени).
Особенности взятия клинического материала
Основные принципы:
•Выбор клинических материалов, транспортных систем и диагностических методов зависит от конкретного возбудителя и технических возможностей лаборатории.
•Разные лаборатории могут использовать различные коммерческие тест-систе- мы для диагностики и взятия материала. Необходимо при этом строго соблюдать требования соответствующих инструкций.
•Необходимо поддерживать контакт с лабораторией для получения дополнительной информации.
•Качество результата лабораторного исследования зависит от состояния пациентки на момент взятия материала. Наиболее информативным может быть материал, если он получен при следующих условиях:
наличие клинических признаков заболевания;
пациентка не использовала местного лечения минимум в течение последних
48–72 ч;
пациентка не спринцевалась в течение 24 ч.
Если нет возможности придерживаться вышеупомянутых условий, то следует помнить, что это может повлиять на качество исследования и исказить результаты.
Всегда необходимо учитывать, что проведение системной терапии, особенно антибактериальными препаратами, может значительно повлиять на результат исследования и снизить его диагностическую значимость.
Перед взятием образца важно понимать, какой материал должен быть взят и что предполагается обнаружить. Обычно во время обследования пациентки

ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ БЕРЕМЕННОСТИ |
137 |
необходимо брать несколько клинических образцов для различных лабораторных исследований. Важно помнить несколько правил:
•Из уретры материал для микроскопического исследования берут раньше других или сразу же после взятия выделений или проб для бактериологического исследования на гонорею.
•Материал для приготовления нативного мазка из влагалища берут раньше всех других вагинальных проб. Участок влагалища, с которого нужно взять пробу, выбирают в зависимости от клинической ситуации. Если пациентку беспокоят обильные выделения и есть подозрение на трихомонадную или кандидозную инфекцию, образец забирают с заднего свода, где концентрация предполагаемого инфекционного агента наибольшая. Если количество выделений обычное, образец следует брать с боковой стенки влагалища. Такой материал даст наиболее надёжную информацию о состоянии влагалища в данный момент.
•Из шейки матки образец для микроскопического исследования берут первым или сразу же после взятия мазка для культурального исследования на
N. gonorrhoeae.
•Предметные стёкла должны быть сухими, чистыми, непоцарапанными (оптимально применять новые стекла для каждого нового пациента).
•Мазок наносят тонким слоем только на одну сторону предметного стекла.
•Если количество материала небольшое или необходимо поместить на одно стекло несколько образцов материала от одного пациента, материал наносят ближе к центру стекла в заранее обозначенных областях.
•При использовании метода прямой микроскопии физиологический раствор должен быть тёплым (оптимально 37 °С). Подвижные трихомонады при этой температуре распознать легче.
•Клинический материал можно получать с помощью пластиковой бактериологической петли, ложечки Фолькмана или тампона (ватного или дакронового). Предпочтение во всех случаях следует отдавать дакроновым тампонам.
•Образец из уретры берут с помощью бактериологической петли объёмом 1 мкл. При наличии большого количества выделений наружное отверстие должно быть очищено с помощью марлевого тампона. При отсутствии свободных выделений врач может провести лёгкий массаж уретры. Для микроскопического и иммунофлуоресцентного исследования после получения клинического материала петлю накладывают на поверхность стекла и передвигают по нему несколько раз с лёгким нажатием. Петля должна оставить на стекле тонкую полоску клинического материала. Для культурального исследования и ПЦР материал помещают в соответствующие пробирки с транспортной средой.
•Из цервикального канала образец берут при помощи зеркал ватным или дакроновым тампоном, специальной щёточкой или ложечкой Фолькмана. Необходимо тщательно очистить наружное отверстие цервикального канала при помощи большого марлевого тампона от вагинальных выделений для предотвращения возможного заражения. После введения тампона в шеечный канал на 1–2 см его вращают несколько раз. Для микроскопического и иммунофлуоресцентного исследования клинический материал должен быть нанесён на стекло как можно более тонким слоем. Для культурального исследования и ПЦР материал помещают в соответствующие пробирки с транспортной средой.
•Для микроскопического исследования вагинальных мазков материал берут при помощи зеркал с заднего или боковых сводов бактериологической петлёй 10 мкл или ложечкой Фолькмана и тонким слоем распределяют на предметном стекле. Для культурального исследования и ПЦР материал помещают в соответствующие пробирки с транспортной средой.
10 ГЛАВА

|
138 |
МЕТОДЫ ДИАГНОСТИКИ |
I |
• При взятии первой порции мочи для молекулярно-биологического или для |
|
РАЗДЕЛ |
|
бактериологического (посев мочи для выявления бактериурии) исследований |
|
|
|
пациентку следует обеспечить одноразовым стерильным контейнером для сбора мочи, попросить собрать только первые 10–15 мл свободно выпущенной мочи, при этом пациентка в течение двух часов до взятия проб не должна подмываться.
• Взятие крови для исследования производят из локтевой вены. Хранить кровь необходимо при температуре от +2 °C до +80 °С не более 48 ч. Для более длительного хранения необходимо отобрать сыворотку, образцы следует заморозить и хранить при температуре –200 °С и ниже и избегать повторного размораживания.
Транспортировка материала
После взятия клинического материала для проведения прямой микроскопии нативных препаратов необходимо срочно (в течение нескольких минут) доставить материал в лабораторию при соблюдении температурного режима (20–37 °С). При наличии определённого опыта врач может сам на приёме провести микроскопическое исследование нативных препаратов.
Для исследования окрашенных анилиновыми красителями препаратов их необходимо высушить на воздухе и доставить в лабораторию в тот же день. При более длительном хранении препарат можно зафиксировать в пламени горелки (для окрашивания по Граму), холодным ацетоном или смесью Никифорова (для окрашивания по Романовскому–Гимзе), или 96% этиловым спиртом (для окрашивания метиленовым синим). Фиксированные препарты можно хранить при комнатной температуре в течение нескольких дней.
Препараты, предназначенные для исследования методами прямой иммунофлуоресценции (ПИФ), необходимо в тот же день доставить в лабораторию. При необходимости фиксированные в течение 1–2 мин холодным ацетоном препараты можно хранить при 6±2 °C в течение трёх дней, при –20 °С — в течение месяца.
Для культуральной диагностики хламидийной инфекции до транспортировки материал следует сохранять в специальной транспортной среде в холодильнике при 4–6 °С и в течение 24 ч доставить в лабораторию, обложив пробу льдом. Исследование требует сохранения живых хламидий (поддержание необходимой температуры при транспортировке может быть решающим для получения достоверного результата).
Для культуральной диагностики гонореи и трихомониаза образцы следует направлять в лабораторию как можно быстрее (сразу после посева на специальную среду). Материал необходимо транспортировать в лабораторию при температуре не ниже 18 °С (не охлаждать!). При нарушении правил транспортировки вероятность выделения гонококков и трихомонад резко снижается.
Для микробиологической диагностики герпесвирусной инфекции материал для исследования следует доставить в лабораторию как можно быстрее, предпочтительно в течение первых четырёх часов после взятия. В ожидании транспортировки образцы необходимо хранить в холодильнике при 4–6 °С. При транспортировке материал не следует замораживать.
Для микробиологической диагностики бактериальных инфекций и кандидоза взятый материал доставляется в лабораторию в специальной транспортной среде как можно быстрее, но не позднее 24 ч после взятия.
Перечень заболеваний, подлежащих обязательной регистрации
(Приказ МЗ РФ № 403 от 12.08.2003)
•Сифилис.
•Гонорея.

ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ БЕРЕМЕННОСТИ |
139 |
•Хламидиоз.
•Трихомоноз.
•Герпес урогенитальный.
•Аногенитальные бородавки.
•Микроспория.
•Фавус.
•Трихофития.
•Микоз стоп.
•Чесотка.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Кишкун А.А. Руководство по лабораторным методам диагностики. — М.: ГЭОТАР-Медиа, 2007. — 800 с.
Методические рекомендации МЗ РФ (пособие для врачей), 1997 г. Профилактика, диагностика и лечение заболеваний, передающихся половым путём.
Приказ МЗ РФ № 87 от 26.03.2001. О совершенствовании серологической диагностики сифилиса.
Приказ МЗ РФ № 403 от 12.08.2003. Об утверждении и введении в действие учетной формы №089/у-кв.
Савичева А.М., Соколовский Е.В., Смирнова Т.С. и др. Методические материалы по диагностике, лечению и профилактике наиболее распространенных инфекций, передаваемых половым путём. Метод. пособие. СПб: Н-Л, 2002. — 112 с.
Савичева А.М., Соколовский Е.В., Домейка М. Краткое руководство по микроскопической диагностике инфекций, передаваемых половым путём. — СПб: Фолиант, 2004. — 128 с.
Савичева А.М., Соколовский Е.В., Домейка М. Порядок проведения микроскопического исследования мазков из урогенитального тракта. Метод. рекомендации для специалистов по лабораторной диагностике. СПб: Н-Л, 2007. — 64 с.
Савичева А.М., Соколовский Е.В., Домейка М. Порядок проведения микроскопического исследования мазков из урогенитального тракта. Метод рекомендации для лечащих врачей. СПб: Н-Л, 2007. — 60 с.
Соколовский Е.В., Савичева А.М., Айламазян Э.К. и др. Инфекции, передаваемые половым путём. Руководство для врачей. М.: Медпресс-Информ, 2006. — 256 с.
Таранов А.Г. Лабораторная диагностика в акушерстве и гинекологии. — М.: ЭликсКом, 2004. — 80 с.
UK National Guidelines on Sexually Transmitted Infections and Closely Related Conditions // STI, 1999. — Vol. 75 (Suppl. 1). — 89 p.
Guidelines for the Management of Sexually Transmitted Infections // WHO, 2001. — 79 p. European STD Guidelines // International J. of STD AIDS, 2001. — Vol. 12 (Suppl 3). —
107 p.
Sexually transmitted and other reproductive tract infections. A guide to essential practice. — Geneva // WHO. — 2005. — 186 р.
10.9. ПРЕНАТАЛЬНЫЙ СКРИНИНГ
Скрининг — совокупность мероприятий и медицинских исследований, тестов и других процедур, направленных на предварительную идентификацию лиц, среди которых вероятность наличия определённого заболевания выше, чем у остальной части обследуемой популяции. Скрининг — начальный предварительный этап обследования популяции, а лица с положительными результатами скрининга нуждаются в дальнейшем диагностическом обследовании для установления или исключения факта наличия патологического процесса.
Основные аспекты правильной организации скрининга подробно изложены в специальной литературе (А.В. Михайлов, «Ультразвуковое исследование в 11–13 недель беременности»).
10 ГЛАВА

РАЗДЕЛ I
140 |
МЕТОДЫ ДИАГНОСТИКИ |
Скрининг — комплексная система, включающая не только проведение определённых тестов, но и предоставление пациенту адекватной информации о заболевании, на поиск которого направлен скрининговый тест.
Чувствительность скринингового теста — способность правильно идентифицировать лиц, имеющих скринируемое заболевание.
Специфичность — способность теста правильно идентифицировать лиц, у которых данного заболевания нет.
При отсутствии сочетания между результатами теста и наличием у пациентки заболевания отмечают ложноположительные и ложноотрицательные результаты.
Вероятность наличия заболевания при условии известного результата теста называют его прогностической значимостью.
Эффективность скринингового теста оценивают благодаря отношению правдоподобия, в котором обобщают ту же информацию, что и показатели чувствительности, специфичности и прогностической значимости положительного и отрицательного результата теста, а также с помощью которого можно рассчитать риск наличия или отсутствия заболевания.
У каждой беременной существует определённый риск хромосомной патологии. Базовый (исходный) риск зависит от возраста женщины и срока беременности. Величину индивидуального риска конкретной пациентки рассчитывают путём умножения величины исходного риска на значение отношений правдоподобия скрининговых тестов, проведённых при данной беременности.
Базовые методы пренатальной диагностики во многих развитых странах:
•Биохимический скрининг.
•Эхография.
•Инвазивная диагностика (биопсия хориона, амниоцентез, плацентоцентез и кордоцентез).
СКРИНИНГ В I ТРИМЕСТРЕ
Комбинированный тест (проводят на 10–14 нед беременности) включает определение биохимических маркеров: концентрации β-ХГЧ, плацентарного протеина, ассоциированного с беременностью, и измерение толщины воротникового пространства (ТВП) эмбриона с помощью УЗИ.
При интерпретации результатов исследования биохимических маркеров следует учитывать, что их количественное содержание может варьировать в различных популяциях и этнических группах, а также зависит от метода исследования. По этой причине индивидуальные результаты оценивают с помощью МоМ (Multiple of Median) — отношения индивидуального значения маркёра к медиане соответствующего нормативного ряда, установленной для определённой популяции. Нормальными значениями концентраций биохимических маркёров для любого срока беременности принято считать МоМ от 0,5 до 2.
•Плацентарный протеин, ассоциированный с беременностью (молекулярная масса 820 кД), секретирует трофобласт. В течение первых 8 нед концентрация этого вещества в крови удваивается каждые 4,9 сут и к 10 нед увеличивается примерно в 100 раз, а в последующем градиентно возрастает до момента родов.
Нормальное содержание плацентарного протеина, ассоциированного с беременностью, в I триместре ассоциировано с благоприятным исходом беременности в 99% случаев. Концентрация этого белка существенно не зависит от пола и массы ребенка.
При хромосомных аномалиях у плода концентрация плацентарного протеина, ассоциированного с беременностью, в I и начале II триместра существенно снижается, причём это наиболее выражено на 10–11 нед беременности (около 0,5 МоМ). Наиболее резкое уменьшение концентрации отмечают

ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ БЕРЕМЕННОСТИ |
141 |
при трисомиях 21, 18 и 13, в меньшей степени — при анеуплоидиях по половым и трисомии 22.
Снижение концентрации плацентарного протеина, ассоциированного с беременностью, наблюдают не только при хромосомной патологии плода, но и при различных осложнениях беременности (самопроизвольные аборты, преждевременные роды, ЗРП, мертворождения).
•ХГЧ — гликопротеид с молекулярной массой 36 000–40 000 кД, состоящий из двух субъединиц (α и β), из которых только β-цепь определяет специфичность данного гормона. ХГЧ продуцируют любые типы трофобластной ткани, включая пузырный занос, деструирующую хорионаденому и хорионкарциному.
При нормальной беременности примитивный трофобласт начинает продуцировать ХГЧ очень рано. Гормон выявляют через 9 сут после пика ЛГ, уже через сутки после имплантации оплодотворённой яйцеклетки. Его концентрация, начиная с 8-го дня гестации, неуклонно возрастает, удваиваясь каждые 2 сут, достигает пика в 8 нед, а затем снижается до постоянной величины (5000–50 000 МЕ/л), которая сохраняется до родов.
Установлено, что при синдроме Дауна содержание свободной цепи ХГЧ в крови существенно повышено уже в I триместре (около 2 МоМ), тогда как концентрация димерной формы резко повышается только во II триместре. Кроме того, отмечено снижение содержания данного белка при синдроме
Эдвардса и других анеуплоидиях. Диагностическая ценность определения β-ХГЧ в моче приближается к таковой в крови.
•ТВП — ультразвуковой маркёр, характеризующий подкожное скопления жидкости в тыльной области шеи плода в I триместре беременности. Оптимальный срок для измерения ТВП — 11–14 нед гестации. В этом случае минимальная величина КТР эмбриона составляет 45 мм, а максимальная не превышает 84 мм. В норме ТВП возрастает с увеличением КТР. Известны значения медианы и 95% центили ТВП для каждого значения КТР. Величина ТВП определяет значение отношения правдоподобия, на которое необходимо умножить исходный риск, определённый на основании возраста матери. Чем больше значение ТВП, тем больше величина отношения правдоподобия и, соответственно выше индивидуальный риск. Для оценки ТВП необходимы как ультразвуковые аппараты с высокой разрешающей возможностью (до десятых долей миллиметра), так и тщательное соблюдение стандартов технологии измерения. Увеличение ТВП сочетается с повышением риска трисомии 21, 18, синдрома Тёрнера и других хромосомных заболеваний, а также с наличием многих ВПР и генетических синдромов.
Таким образом, на сроке 10–14 нед беременности при синдроме Дауна у плода концентрация β-ХГЧ в крови беременной бывает увеличена (2 МоМ) по сравнению с нормальными значениями для данного срока беременности, тогда как содержание плацентарного протеина, ассоциированного с беременностью, снижено (0,5 МоМ). При трисомии 18 и 13 происходит однонаправленное снижение концентрации как β-ХГЧ, так и плацентарного протеина, ассоциированного с беременностью. При аномалии половых хромосом у плода уровень β-ХГЧ бывает не изменен. Для каждой недели беременности величина концентрации плацентарного протеина, ассоциированного с беременностью, и β-ХГЧ имеет определённое отношение правдоподобия, которое следует умножить на исходный риск данной пациентки для определения нового индивидуального риска.
Частота обнаружения у плода трисомии 21 при проведении комбинированного скрининга составляет 86% при частоте ложно-положительных результатов теста 5%. Кроме того, комбинированный скрининг позволяет выявить 90% плодов с хромосомной патологией при частоте ложно-положительных результатов 6%.
10 ГЛАВА

РАЗДЕЛ I
142 |
МЕТОДЫ ДИАГНОСТИКИ |
Самый современный вариант комбинированного скрининга предложен Kypros H. Nicolaides. Алгоритм обследования включает 2 этапа. На первом этапе у всех пациенток при однодневном посещении производят исследование концентрации плацентарного протеина, ассоциированного с беременностью, свободной фракции β-ХГЧ, оценку ТВП, и на основании результатов с помощью специальной компьютерной программы, учитывающей возраст матери, рассчитывают индивидуальный риск рождения ребенка с хромосомной патологией. При высоком риске (1% и выше) предлагают провести пренатальное определение кариотипа. При низком риске (0,1% и ниже) показано обычное наблюдение. При среднем риске (0,1–1%) рекомендовано пройти второй этап специализированного УЗИ с оценкой костей носа, скоростей кровотока в венозном протоке и через трикуспидальный клапан. В этой группе пренатальное кариотипирование проводят только в случаях отсутствия изображения костей носа или обнаружения реверсного кровотока в венозном протоке и трикуспидальной регургитации.
Такой подход позволяет выявить более 90% плодов с хромосомной патологией при частоте ложно-положительных результатов 2–3%, что оказывает прямое влияние на количество необходимых инвазивных процедур.
СКРИНИНГ ВО II ТРИМЕСТРЕ
В качестве скрининг-тестов в большинстве стран используют определение содержания α-фетопротеина (АФП), ХГЧ и неконъюгированного эстриола на сроке 15–20 нед гестации. При определении риска хромосомной патологии плода по уровню этих биохимических маркеров необходимо обязательно учитывать данные, полученные при проведении скрининга в I триместре:
•АФП (молекулярная масса 70 000 Д), синтезирует желточный мешок, печень
ив незначительном количестве органы ЖКТ плода. АФП выводится в АЖ фетальными почками и трансплацентарно попадает в материнскую кровь с 6 нед гестации. Содержание АФП в крови плода, матери и в АЖ зависит от срока гестации. В материнской крови концентрация АФП возрастает с конца I триместра, достигая максимума к 32–33 нед.
При снижении содержания АФП, особенно на фоне высокой концентрации ХГЧ повышен риск трисомий, в частности синдрома Дауна.
Увеличение концентрации АФП ассоциировано с повышением риска дефектов нервной трубки и передней брюшной стенки плода, атрезий пищевода и кишечника, патологии почек.
•Неконъюгированный эстриол (молекулярная масса 288,4 Д) — один из трёх главных эстрогенов. Он синтезируется фетальными печенью, надпочечниками и плацентой; 90% неконъюгированного эстриола имеет плодовое происхождение, и лишь 10% образуется из эстрона и эстрадиола, секретируемых яичниками матери. При нормально развивающейся беременности продукция неконъюгированного эстриола повышается в соответствии с увеличением срока гестации. Снижение концентрации этого гормона в крови матери наблюдают при синдроме Дауна, анэнцефалии, оно служит также прогностическим фактором угрозы прерывания беременности и преждевременных родов.
Эффективность выявления у плода синдрома Дауна при исследовании концентрации АФП и β-ХГЧ составляет 59%, при исследовании содержания β-ХГЧ, АФП и неконъюгированного эстриола — 69%. Использование АФП как единственного маркёра приводит к снижению эффективности скрининга более чем в 3 раза. Замена в «тройном тесте» неконъюгированного эстриола димерным ингибином A позволяет повысить диагностику до 79%.
Скрининг I–II триместров (интегральный тест) выполняют в 2 стадии.
•Первую стадию, включающую определение ТВП и содержания плацентарного протеина, ассоциированного с беременностью, рекомендовано проводить в 12 нед (возможно в 11–14 нед).

ЛАБОРАТОРНЫЕ МЕТОДЫ ДИАГНОСТИКИ БЕРЕМЕННОСТИ |
143 |
•Исследование концентрации АФП, неконьюгированного эстриола, ХГЧ и ингибина A (2-я стадия скрининга) показано в 16 нед (до 20 нед).
Эффективность выявления синдрома Дауна при проведении интегрального теста достигает 85–90% при 5% ложноположительных результатов, что совпадает с аналогичным показателем при комбинированном скрининге I триместра.
Понятие «скрининг» имеет принципиальные отличия от понятия «диагностика». Невозможность проведения диагностических тестов, позволяющих установить или исключить факт наличия патологического процесса при положительном результате скрининга, делает бессмысленным проведение самого скрининга.
Для диагностики хромосомной патологии плода необходимо инвазивное вмешательство в целях получения материала плодового происхождения. Основными методами инвазивной диагностики в настоящее время служат хорионбиопсия и амниоцентез.
•Частота прерывания беременности при хорионбиопсии в I триместре составляет 1% и не отличается от таковой после амниоцентеза во II триместре. Хорионбиопсию не следует выполнять до 10 нед беременности в связи с опасностью возникновения поперечных редукций конечностей, микрогнатии и микроглоссии плода.
•Амниоцентез не рекомендовано делать до 15 нед гестации в связи с более высокой частотой прерывания беременности при раннем его проведении, а также вероятностью возникновения эквиноварусной деформации стоп.
Эффективность массовых скринирующих программ, если учитывать конечную цель их проведения (снижение детской смертности), можно повысить только путём сочетания скринингового исследования на хромосомные аномалии и ВПР с ранней доклинической диагностикой ряда осложнений беременности, зачастую бывающих причиной смерти в перинатальном периоде (ПН и ЗРП, ведущая роль в прогнозировании которых в настоящее время принадлежит допплерометрии).
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Николаидес К. Ультразвуковое исследование в 11–13 недель беременности: Пер. с англ. / К. Николаидес. — СПб.: ИД «Петрополис», 2007.
Медведев М.В. Алгоритмы пренатальной диагностики: Учеб. пособие / М.В. Медведев. — М.: «Реальное Время», 2005.
Энкин М. и др. Руководство по эффективной помощи при беременности и рождении ребенка: Пер. с англ. / М. Энкин — СПб.: ИД «Петрополис», 2003.
10 ГЛАВА

144 |
МЕТОДЫ ДИАГНОСТИКИ |
РАЗДЕЛ I
11.1. УЛЬТРАЗВУКОВОЕ ИССЛЕДОВАНИЕ
Ультразвуковое исследование (эхография, сканирование) —
единственный высокоинформативный, безопасный неинвазивный метод, позволяющий проводить динамическое наблюдение за состоянием плода с самых ранних этапов его развития.
ОБОСНОВАНИЕ
Воснове ультразвуковой диагностики лежит обратный пьезоэлектрический эффект. Ультразвуковые волны, по-разному отражаясь от органов и тканевых структур, улавливаются приёмником, расположенным внутри датчика, и преобразуются в электрические импульсы. Данныеимпульсывоспроизводятся на экранепропорционально расстоянию от датчика до соответствующей структуры.
Вакушерстве наибольшее распространение получили два основные метода: трансабдоминальное и трансвагинальное сканирование. При трансабдоминальном сканировании применяют датчики (линейные, конвексные) с частотой 3,5 и 5,0 мГц, при трансвагинальном — секторальные датчики с частотой 6,5 мГц и выше. Использование трансвагинальных датчиков позволяет в более ранние сроки установить факт беременности, с большей точностью изучить развитие плодного яйца (эмбриона и экстраэмбриональных структур), уже с I триместра диагностировать большинство грубых аномалий развития эмбриона/плода.
ЦЕЛЬ
Основные задачи эхографии в акушерстве:
•установление факта беременности, наблюдение за её течением;
•определение числа плодных яиц;
•эмбриометрия и фетометрия;
•диагностика аномалий развития плода;
•оценка функционального состояния плода;
•плацентография;
•осуществление контроля при проведении инвазивных исследований [биопсии хориона, амниоцентеза, кордоцентеза, внутриутробной хирургии (фетохирургии)].

ИНСТРУМЕНТАЛЬНЫЕ НЕИНВАЗИВНЫЕ МЕТОДЫ ДИАГНОСТИКИ |
145 |
Задачи УЗИ в I триместре беременности:
•установление маточной беременности на основании визуализации плодного яйца в полости матки;
•исключение внематочной беременности;
•диагностика многоплодной беременности, типа плацентации (бихориальная, монохориальная);
•оценка роста плодного яйца (средний внутренний диаметр плодного яйца, КТР эмбриона/плода);
•оценка жизнедеятельности эмбриона (сердечной деятельности, двигательной активности);
•исследование анатомии эмбриона/плода, выявление эхомаркёров хромосомной патологии;
•изучение экстраэмбриональных структур (желточного мешка, амниона, хориона, пуповины);
•диагностика осложнений беременности (угрожающий аборт, начавшийся аборт, полный аборт, пузырный занос);
•диагностика патологии гениталий (миом матки, аномалий строения матки, внутриматочной патологии, образований яичников).
Задачи УЗИ во II триместре беременности:
•оценка роста плода;
•диагностика пороков развития;
•исследование маркёров хромосомной патологии;
•диагностика ранних форм ЗРП;
•оценка локализации, толщины и структуры плаценты;
•определение количества ОВ.
Задачи УЗИ в III триместре беременности:
•диагностика пороков развития с поздней манифестацией;
•определение ЗРП;
•оценка функционального состояния плода (оценка двигательной и дыхательной активности, допплерометрия кровотока в системе «мать–плацента–плод»).
ПОКАЗАНИЯ
Ультразвуковой скрининг беременных в нашей стране проводится в сроки
10–14, 20–24 и 30–34 нед.
МЕТОДИКА ИССЛЕДОВАНИЯ И ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ
Диагностика маточной беременности при УЗИ возможна с самых ранних сроков.  от зачатия в полости матки начинает визуализироваться плодное яйцо в виде эхонегативного образования округлой или овоидной формы диаметром 5–6 мм.
от зачатия в полости матки начинает визуализироваться плодное яйцо в виде эхонегативного образования округлой или овоидной формы диаметром 5–6 мм.  возможна визуализация эмбриона — эхопозитивной полоски размером 6–7 мм. Головка эмбриона идентифицируется виде отдельного анатомического образования округлой формы средним диаметром 10–11 мм.
возможна визуализация эмбриона — эхопозитивной полоски размером 6–7 мм. Головка эмбриона идентифицируется виде отдельного анатомического образования округлой формы средним диаметром 10–11 мм.
Наиболее точный показатель срока беременности в I триместре — КТР (рис. 11-1, см. цв. вклейку). В табл. 11-1 приведены гестационные нормативы КТР при неосложнённой беременности.
Средняя ошибка в определении срока беременности при измерении плодного яйца составляет ±5 дней, КТР — ±2 дня.
Оценка жизнедеятельности эмбриона в ранние сроки беременности основывается на регистрации его сердечной деятельности и двигательной активности. При УЗИ регистрировать сердечную деятельность эмбриона можно 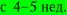 ЧСС постепенно увеличивается с 150–160 в минуту в 5–6 нед до 175–185 в минуту в 7–8 нед с последующим снижением до 150–160 в минуту
ЧСС постепенно увеличивается с 150–160 в минуту в 5–6 нед до 175–185 в минуту в 7–8 нед с последующим снижением до 150–160 в минуту  Двигательную активность оценивают с 7–8 нед.
Двигательную активность оценивают с 7–8 нед.
11 ГЛАВА
