
- •Рецензенты:
- •Оглавление Введение
- •1.1.2. Понятие горения. Условия возникновения и прекращения горения
- •1.1.3. Описание горения с позиции электронной и молекулярно-кинетической теории строения материи
- •1.2. Классификация процессов горения. Пламя. Продукты горения
- •1.2.1. Классификация процессов горения
- •1.2.2. Пламя. Процессы, протекающие в пламени
- •1.2.3. Продукты горения. Дым
- •1.2.4. Расчет объема воздуха, необходимого для горения
- •1.2.5. Расчет объема продуктов горения
- •1.3. Тепловые эффекты и тепловой баланс процессов горения
- •1.3.1. Теплота горения
- •1.3.2. Температура горения и ее виды
- •Глава 2. Возникновение горения по механизму самовоспламенения и вынужденного воспламенения
- •2.1. Понятие самовоспламенения
- •2.2. Теории окисления горючего вещества кислородом
- •2.3. Теория самовоспламенения
- •2.4. Температура самовоспламенения. Снижение пожарной опасности веществ с помощью факторов, влияющих на температуру самовоспламенения
- •2.4.1. Влияние на температуру самовоспламенения объема реакционного сосуда
- •2.4.2. Влияние на температуру самовоспламенения формы реакционного сосуда
- •2.4.3. Влияние на температуру самовоспламенения состава горючей смеси, давления и степени измельчения
- •2.4.4. Влияние на температуру самовоспламенения катализаторов
- •2.5. Вынужденное воспламенение (зажигание) как вид возникновения горения
- •Глава 3. Возникновение горения по механизму самовозгорания
- •3.1. Сущность и классификация самовозгорания
- •3.2. Тепловое самовозгорание
- •Тепловое самовозгорание масел и жиров
- •Тепловое самовозгорание ископаемых углей и торфа
- •Тепловое самовозгорание сульфидов железа
- •Тепловое самовозгорание растительных веществ
- •3.3. Химическое самовозгорание
- •Химическое самовозгорание веществ при контакте с сильными окислителями
- •Химическое самовозгорание химически активных веществ на воздухе
- •3.4. Микробиологические самовозгорание
- •Растительные материалы
- •Глава 4. Горение газопаровоздушных смесей
- •4.1. Основные закономерности горения газопаровоздушных смесей
- •4.2. Концентрационные пределы распространения пламени (кпрп) газопаровоздушных смесей, снижение пожарной опасности веществ с помощью факторов, влияющих на кпрп
- •Факторы, влияющие на кпрп
- •Расчет кпрп
- •4.3. Распространение горения по газопаровоздушным смесям
- •Кинетическое горение газов и паров
- •Диффузионное горение газов и паров
- •Ламинарное диффузионное горение
- •Турбулентное диффузионное горение
- •4.4. Взрыв газопаровоздушной смеси
- •Факторы, влияющие на давление взрыва
- •Глава 5. Горение жидкостей
- •Значение испарения в горении жидкостей. Показатели пожаровзрывоопасности жидкостей
- •Процесс вынужденного воспламенения и горения жидкостей
- •5.3. Процесс выгорания жидкости. Пожары резервуаров
- •6.1.2. Процессы, протекающие при нагревании твердых горючих веществ и материалов
- •6.1.3. Воспламенение и горение древесины
- •6.1.4. Распространение горения по твердым горючим веществам и материалам
- •6.1.5. Развитие пожаров твердых горючих веществ в помещении
- •Стадии развития пожара в помещении
- •6.1.6. Газообмен на пожаре
- •6.1.7. Очаг пожара. Очаговые признаки
- •6.2. Особенности горения пылей
- •6.2.1. Свойства пылей, влияющие на их пожаровзрывоопасность
- •6.2.2. Показатели пожаровзрывоопасности пылей и способы обеспечения их пожаровзрывобезопасности
- •6.2.3. Механизм горения аэрозолей и аэрогелей
- •6.3. Особенности горения металлов
- •Глава 7. Оценка пожаровзрывоопасности веществ и материалов
- •7.1. Понятие и методика оценки пожаровзрывоопасности веществ и материалов
- •Алгоритм оценки пожаровзрывоопасности веществ и материалов
- •7.3. Классификация веществ по гост 12.1.044
- •Заключение
- •Библиографический список
- •1. Общие положения
- •2. Показатели пожаровзрывоопасности веществ и материалов
- •3 94006 Воронеж, ул. 20-летия Октября, 84
1.2.5. Расчет объема продуктов горения
Расчет объема продуктов горения V пг применяется при расчете температуры горения Тгор, температуры взрыва Твзр, давления взрыва Рвзр (что, в свою очередь, необходимо при определении категории помещений по пожарной и взрывопожарной опасности).
Для расчета объема продуктов горения применяются следующие формулы.
Для твердых горючих веществ и материалов и жидкостей:
![]() [м3], (1.10)
[м3], (1.10)
где ni – количество киломолей продуктов горения;
m – масса горючего вещества, кг;
Vt – обьем одного киломоля горючего вещества при заданных условиях (1.6);
М – молекулярная масса.
Если давление и температура по условиям задачи не соответствую нормальным, то объем одного киломоля вещества рассчитывают по формуле
![]() [м3]. (1.11)
[м3]. (1.11)
Если горение протекает с избытком воздуха, то непрореагировавший кислород воздуха, а с ним и азот, будут попадать в продукты горения. Поэтому при расчете общего числа киломолей продуктов горения учитывается избыточное количество киломолей кислорода и азота:
О2= (-1) [кмоль], (1.12)
N2=3,76 (-1) [кмоль]. (1.13)
Объем продуктов горения, образующийся при горении газов, рассчитывается по формуле
![]() [м3],
(1.14)
[м3],
(1.14)
где VГ.Г – объем горючего газа (м3).
Объем продуктов горения, образующийся при горении сложных смесей химических соединений, рассчитывается по формуле
![]() (1.15)
(1.15)
Подробней порядок решения задач рассмотрен в [21].
Вопросы для самоконтроля
1. Для каких целей производится расчет объема продуктов горения?
2. Для каких видов веществ производится расчет объема продуктов горения?
3. Как учитывается в расчетах объема продуктов горения избыток воздуха?
1.3. Тепловые эффекты и тепловой баланс процессов горения
1.3.1. Теплота горения
Химические реакции могут сопровождаться поглощением энергии (в этом случае они называются эндотермическими) и выделением энергии (экзотермические). Горение относится к экзотермическим реакциям.
Количество тепла, выделившееся при сгорании горючего вещества, называется теплотой горения Qг [кДж].
Если выделившееся тепло приводится к единице количества вещества, то говорят об удельной теплоте горения [кДж/кг, кДж/м3, кДж/моль].
Значение теплоты горения Qг (или теплового эффекта реакции горения) используют при определении концентрационных пределов распространения пламени (КПРП), температуры горения. Значения теплоты горения горючих веществ приведены в справочниках.
Теплота пожара Qп практически всегда меньше табличных значений теплоты горения, так как на пожаре обычно сгорает не все горючее вещество, т.е. Qп = Qгор, где – коэффициент недожога (0,7–0,8).
ЗАКОН ГЕССА
Тепловой эффект химического превращения не зависит от пути, а зависит от начального и конечного состояния системы (если давление Р и температура Т одинаковы в начале и конце реакции).
Превращение углерода С в диоксид углерода СО2 может протекать двумя путями, см. рис. 1.5.
С+02 = 110,5 кДж/кг СО +О2=285,5 кДж/кг
 СО+О2
СО+О2
С
 СО2
СО2
396 кДж/кг
Рис. 1.5. Пути превращения углерода в диоксид углерода
Как можно увидеть, действительно тепловой эффект реакции в обоих случаях составляет 396 кДж/кг и, таким образом, не зависит от пути протекания реакции.
В пожарно-технических расчетах чаще применяют следствие из закона Гесса: теплота горения Qг равна разности между суммой теплоты образования продуктов горения и теплотой образования горючего вещества.
Qг = Нп.г. – Н г.в. [кДж/моль]. (1.16)
Если известны Нп.г. и Нг.в., можно определить Qг.
Пример. Определить теплоту горения Qг С2Н6 (Нг.в С2Н6 = 88,4 кДж/моль).
1. Составляем уравнение реакции горения:
С2Н2 + 3,5(О2 + 3,76N2) = 2СО2 + 3Н2О + 2,5 3,76N2 + Qг .
2. По справочным данным определяем:
Н СО2 = 396,9 кДж/моль; Н Н2О = 286,6 кДж/моль;
Нп.г. = 2 396,9 + 3 286,6 = 1653,6 кДж/моль.
Qг = 1653,6 – 88,4 = 1565,2 кДж/моль.
Различают низшую теплоту горения Qн и высшую теплоту горения Qв.
Qн – количество тепла, выделяемое при полном сгорании горючего вещества при условии, что вода в продуктах горения испаряется до пара.
Qв – количество тепла, выделенное при сгорании горючего вещества, но вода при этом находится в жидком состоянии.
Известно, что в гомологическом ряду веществ значение Qн возрастает. Например, метан Qн=35875 кДж/м3; бутан Qн = 110809 кДж/м3. Этот факт можно использовать для ориентировочной оценки теплоты горения при известном ее значении для одного из членов гомологического ряда.
Существует нижний предел теплоты горения Qпред. Если Qн<2100 кДж/кг, то вещество является негорючим. Поэтому Qн можно применять для ориентировочной оценки горючести вещества. Сравним: Qн бумаги =13400 кДж/кг, Qн древесины – 12–17000 кДж/кг, Qн керосина – 43000 кДж/кг.
Однако нужно иметь в виду, что на горючесть вещества значительно влияет скорость отвода тепла. Так, бумага является горючим материалом, однако наклеенная на бетонную или металлическую стену – становится трудногорючей.
Под пожарной нагрузкой понимают количество теплоты, отнесенное к единице поверхности, которое может выделиться в помещении при пожаре.
Способы определения значения теплоты горения приведены на рис. 1.6.
Рис.
1.6. Способы определения значений теплоты
горения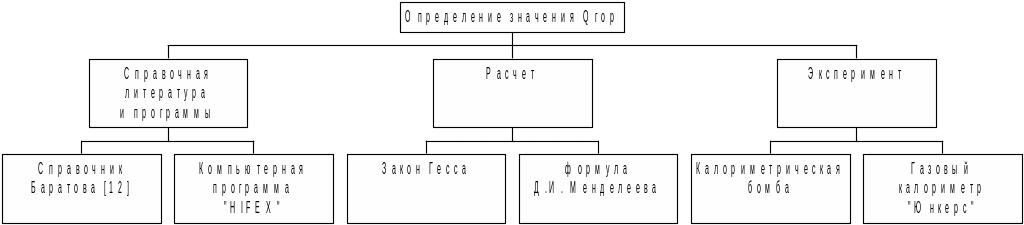
Предпочтительным является экспериментальный метод, как наиболее точный [7].
С формулой для расчета теплоты горения по закону Гесса (1.15) мы познакомились выше.
Для определения теплоты сгорания веществ с известным процентным составом используют формулу Д.И. Менделеева.
Для низшей теплоты горения:
Qн = 339С + 1256Н – 109(О+N–S) – 25(9Н + W) кДж/кг ; (1.17)
для высшей теплоты горения:
Qв = 339С + 1256Н – 109 (О+N–S) кДж/кг, (1.18)
где C, H, O, N, S, W – содержание соответственно углерода, водорода, кислорода, азота, серы и влаги [%].
Для применения указанных формул необходимо знать процентное содержание вещества. Иногда эти данные известны (например, по условию задачи). В противном случае их можно определить по известной химической формуле горючего вещества.
Например, определим процентное содержание углерода, % С, в оксиде углерода СО. Подсчитаем молекулярную массу СО, М=12+16=28.
Зная количество атомов углерода n и атомную массу углерода Ас = 12, составим пропорцию:
М – 100 %
nАс – х %.
Откуда х (%С) = nАс100 / М.
Для нашего случая %С = 112100 / 28 = 42 %.
Для перерасчета значений теплоты горения из кДж/моль в кДж /кг (м3) и наоборот используют следующие зависимости:
![]() [кДж/кг], (1.19)
[кДж/кг], (1.19)
![]() [кДж/м3],
(1.20)
[кДж/м3],
(1.20)
где
![]() –
теплота горения в кДж/моль.
–
теплота горения в кДж/моль.
Как уже отмечалось выше, горение подчиняется закону сохранения энергии. Одной из главных особенностей горения является выделение тепла, что обусловливает повышенную опасность пожара.
Если учесть тепловые реакции горения, то уравнение реакции горения будет одновременно являться обобщенной записью и теплового баланса процесса горения:
СН4+2(О2+3,76N2)=СО2+Н2О+23,76 N2+Qгор.
В расчете на единицу количества горючего вещества тепловой баланс зоны горения можно записать так:
Qн + Qисх – Qнедож = Qпг + Qпож, (1.21)
где Qн – низшая теплота сгорания горючего вещества,
Qн = Qх.р./nг (где nг – количество киломоль горючего вещества);
Qисх – количество тепла, поступающее в зону горения с горючим веществом и окислителем (13 % от Qн);
Qнедож – количество тепла, не выделившееся вследствие химического или механического недожога (5–25 % Qн);
Qпг – количество тепла, затраченного на нагрев продуктов горения (от 40100 % Qн);
Qпож – количество тепла, теряемого из зоны горения (до 60 % от Qн).
Другими словами, сколько тепла было до горения в системе, столько его и осталось после горения.
Уравнение теплового баланса позволяет определять расчетом температуру горения (см. 1.25).
Для пожарно-технических расчетов полезно представлять, куда расходуется выделившееся тепло:
Qп = Qподг.Г.В + Qакт + Qконстр + Qпр. гор+ Qлуч + Qv, (1.22)
Qп – тепло, выделившееся на пожаре;
QподгГ.В – тепло, расходуемое на подготовку горючего вещества к горению (испарение, разложение);
Q акт – тепло, расходуемое на активацию (возбуждение молекул);
Q луч – тепло, теряемое лучистым теплообменом;
Qконстр – тепло, идущее на нагрев конструкций;
Q пг – тепло, расходуемое на нагрев продуктов горения (1000 – 1500 С).
Иногда при расчете необходимо произвести перевод значения теплоты горения из кДж/кмоль в кДж/кг /м3 и наоборот.
Это производится по следующим формулам:
[кДж/кг], (1.23)
[кДж/м3], (1.24)
где – теплота горения в кДж/моль.
Вопросы для самоконтроля
Что понимают под теплотой горения?
Что понимают под пожарной нагрузкой?
Почему значение теплоты пожара меньше теплоты горения?
Опишите способы определения теплоты горения.
Назовите значение нижнего предела горения, средние значения теплоты горения древесины, нефтепродуктов.
Приведите формулы для расчета теплоты горения.
