
- •Рецензенты:
- •Оглавление Введение
- •1.1.2. Понятие горения. Условия возникновения и прекращения горения
- •1.1.3. Описание горения с позиции электронной и молекулярно-кинетической теории строения материи
- •1.2. Классификация процессов горения. Пламя. Продукты горения
- •1.2.1. Классификация процессов горения
- •1.2.2. Пламя. Процессы, протекающие в пламени
- •1.2.3. Продукты горения. Дым
- •1.2.4. Расчет объема воздуха, необходимого для горения
- •1.2.5. Расчет объема продуктов горения
- •1.3. Тепловые эффекты и тепловой баланс процессов горения
- •1.3.1. Теплота горения
- •1.3.2. Температура горения и ее виды
- •Глава 2. Возникновение горения по механизму самовоспламенения и вынужденного воспламенения
- •2.1. Понятие самовоспламенения
- •2.2. Теории окисления горючего вещества кислородом
- •2.3. Теория самовоспламенения
- •2.4. Температура самовоспламенения. Снижение пожарной опасности веществ с помощью факторов, влияющих на температуру самовоспламенения
- •2.4.1. Влияние на температуру самовоспламенения объема реакционного сосуда
- •2.4.2. Влияние на температуру самовоспламенения формы реакционного сосуда
- •2.4.3. Влияние на температуру самовоспламенения состава горючей смеси, давления и степени измельчения
- •2.4.4. Влияние на температуру самовоспламенения катализаторов
- •2.5. Вынужденное воспламенение (зажигание) как вид возникновения горения
- •Глава 3. Возникновение горения по механизму самовозгорания
- •3.1. Сущность и классификация самовозгорания
- •3.2. Тепловое самовозгорание
- •Тепловое самовозгорание масел и жиров
- •Тепловое самовозгорание ископаемых углей и торфа
- •Тепловое самовозгорание сульфидов железа
- •Тепловое самовозгорание растительных веществ
- •3.3. Химическое самовозгорание
- •Химическое самовозгорание веществ при контакте с сильными окислителями
- •Химическое самовозгорание химически активных веществ на воздухе
- •3.4. Микробиологические самовозгорание
- •Растительные материалы
- •Глава 4. Горение газопаровоздушных смесей
- •4.1. Основные закономерности горения газопаровоздушных смесей
- •4.2. Концентрационные пределы распространения пламени (кпрп) газопаровоздушных смесей, снижение пожарной опасности веществ с помощью факторов, влияющих на кпрп
- •Факторы, влияющие на кпрп
- •Расчет кпрп
- •4.3. Распространение горения по газопаровоздушным смесям
- •Кинетическое горение газов и паров
- •Диффузионное горение газов и паров
- •Ламинарное диффузионное горение
- •Турбулентное диффузионное горение
- •4.4. Взрыв газопаровоздушной смеси
- •Факторы, влияющие на давление взрыва
- •Глава 5. Горение жидкостей
- •Значение испарения в горении жидкостей. Показатели пожаровзрывоопасности жидкостей
- •Процесс вынужденного воспламенения и горения жидкостей
- •5.3. Процесс выгорания жидкости. Пожары резервуаров
- •6.1.2. Процессы, протекающие при нагревании твердых горючих веществ и материалов
- •6.1.3. Воспламенение и горение древесины
- •6.1.4. Распространение горения по твердым горючим веществам и материалам
- •6.1.5. Развитие пожаров твердых горючих веществ в помещении
- •Стадии развития пожара в помещении
- •6.1.6. Газообмен на пожаре
- •6.1.7. Очаг пожара. Очаговые признаки
- •6.2. Особенности горения пылей
- •6.2.1. Свойства пылей, влияющие на их пожаровзрывоопасность
- •6.2.2. Показатели пожаровзрывоопасности пылей и способы обеспечения их пожаровзрывобезопасности
- •6.2.3. Механизм горения аэрозолей и аэрогелей
- •6.3. Особенности горения металлов
- •Глава 7. Оценка пожаровзрывоопасности веществ и материалов
- •7.1. Понятие и методика оценки пожаровзрывоопасности веществ и материалов
- •Алгоритм оценки пожаровзрывоопасности веществ и материалов
- •7.3. Классификация веществ по гост 12.1.044
- •Заключение
- •Библиографический список
- •1. Общие положения
- •2. Показатели пожаровзрывоопасности веществ и материалов
- •3 94006 Воронеж, ул. 20-летия Октября, 84
1.1.3. Описание горения с позиции электронной и молекулярно-кинетической теории строения материи
Как мы выяснили, в основе горения чаще всего лежат окислительно-восстановительные реакции, то есть такие, которые приводят к перераспределению валентных электронов между атомами взаимодействующих молекул.
Перераспределение валентных электронов проявляется в изменении степени окисления элементов, то есть в изменении структуры внешнего (валентного) электронного уровня.
Это можно наблюдать при определении степени окисления на примере горения углерода в кислороде: С + О2 С +4 О-22.
Видно, что углерод С повысил степень окисления от 0 до +4, кислород отобрал электроны и понизил степень окисления до -2. Так как степень окисления элементов изменилась, данная реакция является окислительно-восстановительной.
Ранее мы выяснили, что для возникновения горения необходимы три условия, которые часто изображаются в виде мнемонической схемы – классического треугольника пожара: горючее – окислитель – источник зажигания. Это качественная сторона явления. Количественный подход требует более глубокого понимания физической сущности процессов горения, физики и химии горения.
Более строгие представления о процессах воспламенения, распространения пламени, о концентрационных и температурных пределах распространения пламени, условиях прекращения процессов горения и многих других явлениях при горении можно получить при рассмотрении этих сложных процессов с позиций молекулярно-кинетической теории (МКТ) строения материи [11].
С точки зрения МКТ химические реакции между двумя компонентами, находящимися в газовой фазе, следует рассматривать как взаимодействие молекул реагирующих газов, т. е. взаимодействие молекул горючего, например, водорода Н2 (или метана СН4, этилена С2Н4 и т.д.) с молекулами окислителя – кислорода О2. При горении жидкости или твердого вещества картина принципиально не меняется, только вместо молекулы газа выступает молекула пара, а при горении твердого горючего вещества следует рассматривать взаимодействие подвижной молекулы газа-окислителя и менее подвижной молекулой, «закрепленной» в кристаллической решетке.
Известно, что силы молекулярного взаимодействия, т. е. взаимного притяжения и отталкивания молекул, находящихся в непрерывном хаотическом тепловом движении, проявляются лишь при очень малых расстояниях между ними, а с увеличением расстояния резко убывают. Поэтому взаимодействие между молекулами горючего и окислителя возможно только при полном их сближении, которое можно рассматривать как соударение молекул. Без соударения молекул невозможно какое-либо их взаимодействие, а тем более столь сильное, как химическая реакция, связанная с разрывом существующих в молекуле связей между атомами и перераспределением атомов и т. д. Следовательно, химической реакции взаимодействия горючего с окислителем должен предшествовать процесс смешения горючего с окислителем и физический акт сближения молекул горючего и окислителя, рассматриваемый как упругое соударение молекул.
В элементарной кинетической теории газов взаимодействие движущихся молекул рассматривается как упругое соударение жестких шаров радиусом r1 и r2 (рис. 1.2).
Рис. 1.2.
Схема соударения молекул
горючего (1) и
окислителя (2)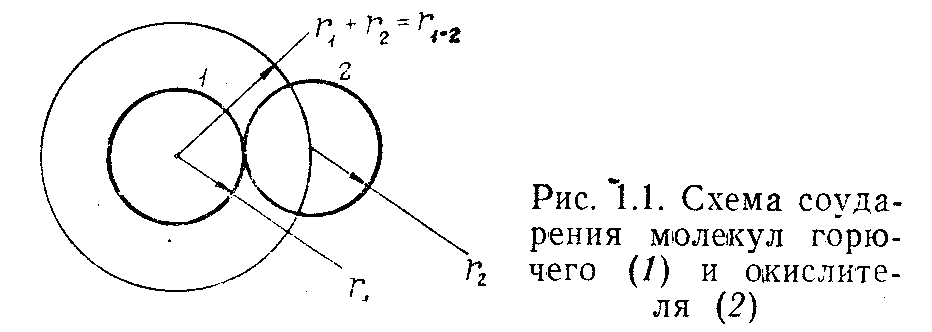
Величина r1 и r2 для большинства молекул веществ порядка (1 – 5) 10-8 см. При соударении двух молекул с радиусом r1и r2, центры молекул сближаются до расстояния r1-2= r1+ r2, а затем молекулы разлетаются в противоположные стороны в соответствии с законами механики.
Выделим мысленно часть объема, заполненного равномерно перемешанными молекулами двух газов, горючего – водорода Н2 и окислителя – кислорода О2. Расчеты показывают, что число соударений молекул горючего и кислорода при комнатной температуре и атмосферном давлении достигает очень большой величины, порядка Z1-2=8,31028 см-3с-1, т.е. до 1,5 раза больше, чем число молекул в этом объеме. Однако в этих условиях без внесения источника зажигания реакция горения полностью отсутствует, т.е. все эти соударения не приводят к химической реакции (т.е. число «эффективных» соударений ничтожно мало). Для начала реакции горения молекулы необходимо «возбудить».
По своей природе такое возбуждение может быть:
химическим, когда атомы или молекулы вещества, обладая одной или двумя свободными валентностями, называются радикалами и обозначаются

 ;
;
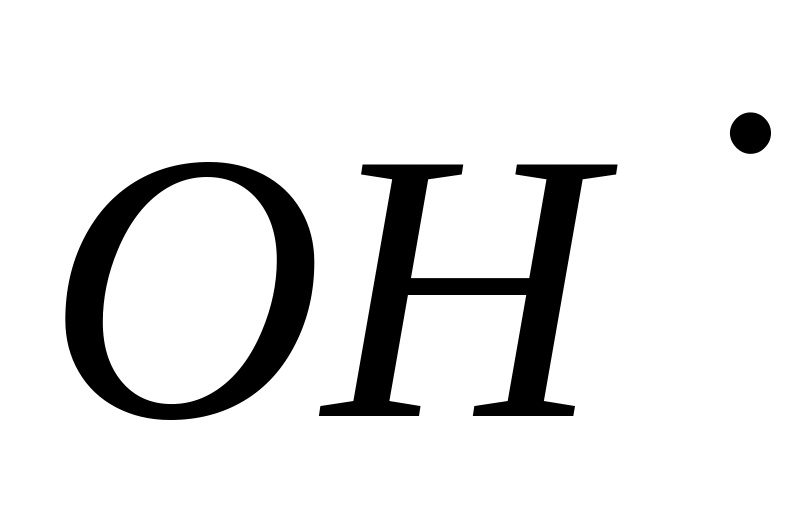 ;
;
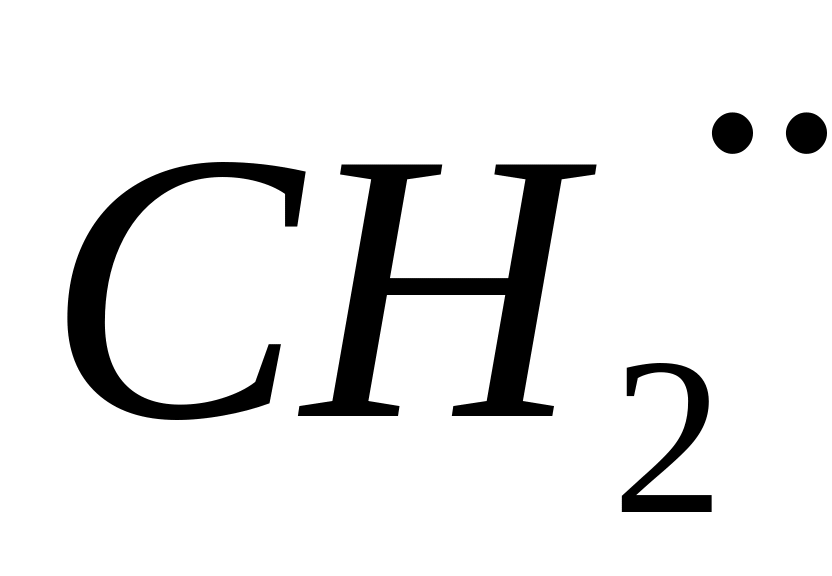 и т.д.;
и т.д.;физическим, когда по законам максвелл-больцмановского распределения энергий часть молекул в результате нагревания газа приобретает кинетическую энергию выше критического значения.
Мерой уровня теплового возбуждения молекул является энергия, которой обладает молекула в момент соударения с другой молекулой.
Молекулы, обладающие необходимым запасом энергии, достаточным для разрыва или ослабления существующих связей, называют активными молекулами или активными центрами химических реакций. Разность между средним уровнем запаса энергии молекул в возбужденном состоянии и средним уровнем запаса энергии в “нормальном”, невозбужденном состоянии, называется энергией активации Еакт.
Чем ниже значение Еакт, тем легче молекулам вступить в химическую реакцию. Поэтому величина энергии активации Еакт является как бы косвенным показателем пожарной опасности данного вещества.
Для того чтобы началось горение с выделением энергии, сначала нужно затратить ее. Связи в молекулах горючего и окислителя ослабнут, при соударении произойдет реакция и начнется выделяться энергия, значительно превышающая затраченную. Дальше этот процесс будет поддерживаться самопроизвольно, за счет передачи части тепловой выделившейся энергии новым молекулам.
Энергетическая модель процесса воспламенения. Иллюстрацией этого явления в газовых смесях может служить следующая механическая модель.
Представим себе шар массой mi, лежащий на плоскости, на высоте h1, соответствующей определенному потенциальному уровню запаса энергии Еакт (рис. 1.3, а). Система находится в покое, но она неустойчива. Далее горизонтальная плоскость h1 переходит в наклонную, которая снижается до потенциального уровня h3, меньшего, чем h1. Если шарик скатится с h1 до h3, что может произойти случайно, без затраты дополнительной энергии, запас его потенциальной энергии изменится в количестве, пропорциональном h1 - h3.
Для большинства случаев горения характерна другая ситуация, изображенная на рис. 1.3, б. Шарик находится в устойчивом равновесии (как «холодные» молекулы горючего и кислорода), т. е. перед ним есть энергетический барьер. Чтобы вывести его из этого состояния, нужно сначала затратить дополнительную энергию Еакт на подъем шарика на новый, более высокий энергетический уровень h2. На это и затрачивается энергия активации Еакт= h2-h1, придаваемая системе с помощью источника зажигания. При этом скорость движения молекул увеличится, а главное увеличится число и энергия их соударений, ослабнут и разорвутся связи между атомами – шарик «активизировался». Состояние его стало неустойчивым. Теперь при столкновении молекул горючего и окислителя произойдет химическое взаимодействие – перераспределение валентных электронов.
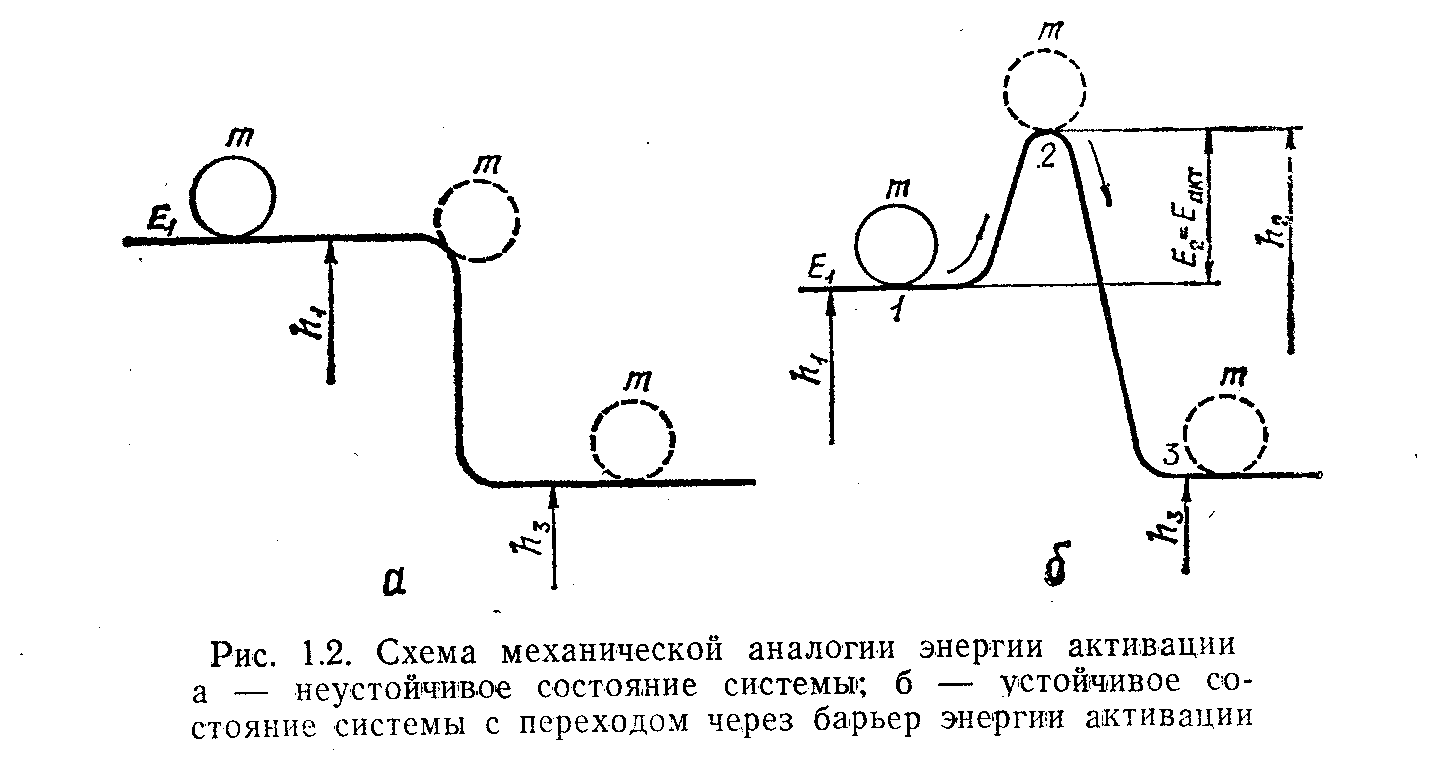
Рис. 1.3. Схема
механической аналогии энергии активации: а
– неустойчивое состояние системы; б
– устойчивое состояние системы с
переходом через барьер энергии активации
Выделится энергия горения и наш шарик переходит на более низкий и устойчивый уровень h3 – скатывается на новую плоскость, более низкую и более «глубокую», так как новое состояние молекул более устойчиво. Новые связи более прочны, и разорвать их намного труднее.
При таком переходе выделится большое количество энергии горения Егор = h1-h2. Это и есть та энергия, которая выделяется при химическом взаимодействии молекул горючего с молекулами окислителя, т. е. при реакциях горения. Напомним, что энергия горения значительно превышает по значению энергию активации. Энергия горения будет передаваться соседним молекулам, те также возбудятся, и начнется самоподдерживающийся, самоускоряющийся и самораспространяющийся на всю смесь горючего и окислителя процесс горения. Как видим, чтобы началось выделение энергии горения, надо сначала затратить ее.
Так выглядит схема возникновения и распространения горения гомогенных газовых смесей с точки зрения молекулярно-кинетической теории газов.
Мы уже выяснили, что в основе горения лежит химическая реакция (чаще всего – окисление). Скорость этой химической реакции регулируется чаще всего физическими процессами, например:
диффузией кислорода в зону горения;
теплопередачей (подготовка горючего вещества к горению и активация молекул). Теплопередача при горении осуществляется излучением, конвекцией, теплопроводностью. При развитии пожара в помещении особенно велико значение конвекции.
Необходимо отметить, что скорость химической реакции также может регулироваться и химическими факторами, например, химически активными ингибиторами – хладонами (огнетушащие вещества, которые применяются, в частности, в некоторых огнетушителях, в автоматических установках газового пожаротушения).
Кроме указанных выше физических процессов, составляющих горение, можно выделить и другие, например:
испарение горючей жидкости;
смешение горючих паров с воздухом;
соударение молекул;
излучение света;
массоперенос (перенос дымовых частиц).
Как и любой другой химический процесс, горение подчиняется таким основным законам природы, как законы сохранения вещества и энергии. Это позволяет расчетным путем определять количество воздуха, необходимое для горения веществ и материалов, объем и состав продуктов полного горения, температуру горения и т.д.
Для многих пожарно-технических расчетов необходимо составлять уравнение реакции горения, которое является обобщенной записью материального баланса реакции горения:
СН4+2(О2+3,76N2)=СО2+Н2О+23,76 N2; 12.
Если учесть тепловые реакции горения, то уравнение реакции горения будет одновременно являться обобщенной записью и теплового баланса процесса горения:
СН4+2(О2+3,76N2)=СО2+Н2О+23,76 N2+Qгор.
Иногда такую запись называют брутто-уравнением реакции горения (суммарным уравнением), имея в виду то, что она показывает только начальное и конечное состояние реагирующей системы и не дает представление о всех проходящих превращениях, путях протекания реакции и о промежуточных фазах. Для практических расчетов оказывается достаточным рассмотрение только этого уравнения.
В действительности горение органических соединений протекает в две стадии:
окисление исходного горючего вещества до монооксида углерода СО и воды Н2О;
дальнейшее сгорание СО до СО2. Причем данная стадия является определяющей.
Механизм окисления оксида углерода СО на границе зоны горения и предпламенной зоны может быть приближенно описан следующими реакциями:
Н+СО СО2+Н; Н+О2 ОН+О; ОН+Н2 Н2О+Н; О+Н2 ОН+О; О+Н2О Н2О+Н2О; Н+О2+М НО2+М;
|
О+О2+М О3+М; Н+НО2 ОН+ОН; Н+ОН2 Н2+О2; О+НО2 ОН+О2; ОН+НО2 Н2О+О2.
|
В связи с многостадийностью реакций горения в состав продуктов горения входят не только продукты полного горения СО2, НО2, N2, Р2О5 и т.д., но и продукты неполного горения и термоокислительного разложения: радикалы ОН˙, О˙, атомов Н, молекул монооксида углерода СО. Последние являются не только горючими, но и наиболее токсичными веществами.
Вопросы для самоконтроля
Что представляет собой горение с позиции электронной теории?
Опишите горение с позиции молекулярно-кинетической теории строения материи. Что больше по значению – энергия активации или энергия горения? Какое вещество более пожаровзрывоопасно – с меньшей или большей по значению энергией активации?
Какие процессы могут управлять скоростью реакции горения?
Почему уравнение реакции горения называют брутто-уравнением?
Опишите стадии сгорания органических соединений на примере углерода.
