
- •Глава 1. Основы металловедения
- •Кристаллизация и структура металлов
- •Строение металла
- •1.1.2. Кристаллизация металла
- •1.1.3. Изменение структуры металла
- •1.1.4. Изучение структуры металла
- •1.2. Строение сплавов
- •1.2.1. Правило фаз
- •1.2.2. Сплав - механическая смесь
- •1.2.3. Сплав - твердый раствор
- •1.2.4. Сплав - химическое соединение
- •1.2.5. Тройные сплавы
- •1.2.6. Электролитические сплавы
- •1.3. Свойства сплавов
- •Глава 2. Коррозия металлов
- •2.1. Определение и методы исследования коррозии
- •2.1.1. Классификация коррозионных процессов
- •2.1.2. Методы оценки коррозии
- •2.1.3. Методы коррозионных исследований
- •2.2. Химическая коррозия
- •2.2.1. Внешние факторы газовой коррозии
- •2.2.2. Оксидные пленки
- •2.2.3. Методы защиты от газовой коррозии
- •2.2.4. Коррозия в неэлектролитах
- •2.3. Электрохимическая коррозия
- •2.3.1. Причины возникновения коррозии
- •2.3.2. Коррозионная диаграмма Эванса
- •2.3.3. Коррозия с водородной и кислородной деполяризацией
- •2.3.4. Влияние внешних факторов на скорость коррозии
- •2.3.5. Влияние внутренних факторов на скорость коррозии
- •2.3.6. Атмосферная коррозия
- •2.3.7. Морская коррозия
- •2.3.8. Подземная коррозия
- •2.3.9. Электрокоррозия
- •2.4. Методы защиты от электрохимической коррозии
- •2.4.1. Обработка коррозионной среды
- •2.4.2. Катодная защита
- •2.4.3. Протекторная защита
- •2.4.4. Анодная защита
- •Глава 3. Коррозионные процессы в нефтегазовом комплексе и методы предотвращения коррозии
- •3.1. Особенности эксплуатации металлов в процессе транспортировки и хранения нефти, нефтепродуктов и газа
- •3.2. Коррозия металлов при контактировании с нефтепродуктами
- •3.3. Рациональный выбор конструкционных материалов
- •3.4. Применение органических покрытий с целью предотвращения коррозии газонефтепроводов
- •3.5. Методы электрохимической защиты трубопроводов
- •3.6. Защита трубопроводов от блуждающих токов
- •3.7. Методы защиты трубопроводов от внутренней коррозии
- •Глава 1. Основы металловедения…………………….4
- •Глава 2.Коррозия металлов……………………………...41
- •Глава 3. Коррозионные процессы в нефтегазовом комплексе и методы предотвращения коррозии……………………………………………….……109
- •394026 Воронеж, Московский просп., 14
1.2.3. Сплав - твердый раствор
Твердый раствор имеет все характерные особенности жидкого раствора: он однороден, образует одну фазу, компоненты связаны межатомными связями, он не имеет определенного химического состава. Отличие заключается в кристалличности твердого раствора по сравнению с аморфностью жидкого.

Рис. 13. Схемы решетки внедрения (а) и решетки замещения — неупорядоченной (б) и упорядоченной (в)
В твердом растворе часто можно различить компонент-растворитель и компонент - растворенное вещество.
В одних случаях растворенный компонент располагается в решетке между атомами растворителя, не нарушая существенно ее параметры. При этом образуется решетка внедрения, условно показанная на рис. 13, а. Решетку внедрения обычно образуют системы металл-неметалл. Такие неметаллы, как водород, кислород, азот, углерод, имеют гораздо меньший атомный радиус по сравнению с радиусом металла-растворителя, что и является условием образования решетки такого типа.
В других случаях, гораздо более многочисленных, растворение компонента происходит путем замещения его атомами некоторых узлов решетки компонента-растворителя. Такая решетка называется решеткой замещения и условно показана на рис. 13,б. Если взаимное расположение компонентов неопределенно, эта решетка замещения называется неупорядоченной; определенный порядок расположения компонентов дает упорядоченную решетку (рис.13,в).
Существование решетки замещения возможно благодаря дефектам реальной кристаллической решетки металла — наличию вакансий в узлах решетки (дефект Шоттки) и дислокаций атомов (дефект Френкеля). Металлы, дающие твердые растворы замещения, как правило, стоят близко один к другому в периодической таблице Менделеева, имеют однотипные или близкие решетки, близкие межатомные расстояния.
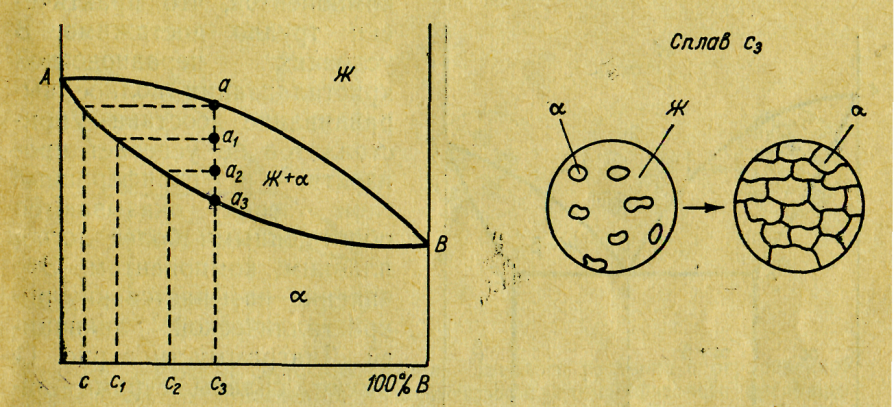
Рис. 14. Диаграмма состояния сплава - твердого раствора с неограниченной растворимостью компонентов и схема фазового превращения в сплаве состава с3
Диаграмма состояния с образованием сплава с неограниченной растворимостью компонентов. Общий вид такой диаграммы дан на рис. 14. Линия ликвидуса - АаВ, линия солидуса - Аа3В. Характерная особенность диаграммы заключается в том, что область кристаллизации сплава имеет форму линзы. Из этого следует, что кристаллизация сплава любого состава протекает в интервале температуры.
В области кристаллизации сплава мы наблюдаем присутствие двух фаз - жидкого металла Ж (жидкого раствора) и кристаллов твердого раствора α. На схеме фазового превращения сплава состава cз (рис. 14) видно, что структура затвердевшего металла представляет собой твердый раствор взаиморастворенных компонентов; система однофазна. Нетрудно видеть, что такой же структурой будет обладать сплав любого состава. Максимальное число фаз - две - наблюдается в области кристаллизации, поэтому система нонвариантной быть не может.
С помощью правила отрезков можно показать, что первые кристаллические зародыши максимально обогащены более тугоплавким компонентом. Действительно, состав кристаллов в точке а равен с. По мере охлаждения сплава концентрация А в твердой фазе снижается (с→с1→с2→...), пока не достигнет исходного значения cз.
Кристаллизация по такой схеме возможна при условии постоянного выравнивания состава кристаллов за счет диффузии компонентов, что практически трудно достижимо. В условиях неравновесной кристаллизации полное выравнивание состава кристаллитов не успевает произойти, и периферийные слои зерен оказываются обогащенными более легкоплавким компонентом. Это явление называется внутрикристаллической ликвацией. Диаграмму этого типа имеют сплавы сурьма—висмут, медь — никель, золото — платина, свинец — индий и другие.
Сплав с ограниченной растворимостью компонентов эвтектического типа.
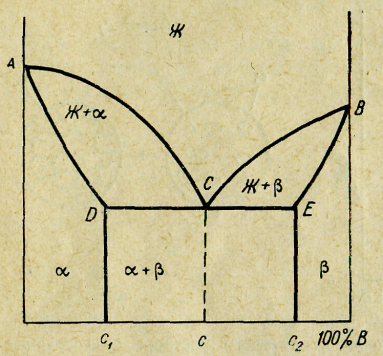
Рис. 15. Диаграмма состояния сплава - твердого раствора с ограниченной растворимостью компонентов и эвтектикой
Диаграммы состояния, рассмотренные на рис. 11 и 14, являются основными и исходными при изучении более сложных фазовых равновесий в сплавах. Они описывают два крайних случая — когда компоненты или совершенно не растворимы один в другом и образуют эвтектику, или, наоборот, полностью взаимно растворимы и образуют твердый раствор. На практике чаще встречаются сплавы с частичной взаимной растворимостью компонентов.
Рассмотрим диаграмму рис. 15. Кристаллизация начинается по линии ликвидуса АСВ и заканчивается по линии солидуса АDЕВ. Области диаграммы левее с1 и правее c2 представляют собой часть диаграммы рис. 14, а центральная область между с1и с2 имеет вид диаграммы рис. 11. Действительно, в области АСВ происходит кристаллизация твердого раствора α. При концентрации с1 наступает предел растворимости В в A. Поэтому сплав образует однофазную систему - твердый раствор α только левее с1. Аналогичная картина наблюдается в правой части диаграммы правее с2. Отличие заключается только в том, что образующийся твердый раствор β является раствором A в В.
За пределами существования однофазных сплавов α и β лежит область эвтектической смеси твердых растворов α+β.
Примером системы такого типа является сплав серебро - медь.
Сплав с ограниченной растворимостью компонентов перитектического типа. Диаграмма состояния, изображенная на рис. 16, в левой части не отличается от предыдущей диаграммы. В двухфазной области АСЕ происходит кристаллизация твердого раствора α. При температуре ниже tп и концентраций компонента В меньше, чем с, металл находится в однофазной области твердого раствора α.
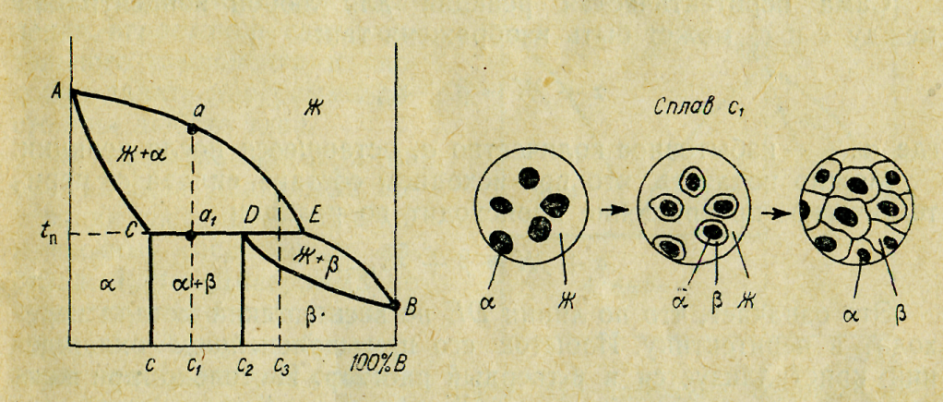
Рис. 16. Диаграмма состояния сплава - твердого раствора с ограниченной растворимостью компонентов и перитектикой, схема фазового превращения в сплаве с1
Однако с повышением концентрации В мы наблюдаем появление новой фазы, твердого раствора β. Отличие рассматриваемой диаграммы от предыдущей (см. рис. 15) заключается в механизме образования твердого раствора β. Рассмотрим кристаллизацию сплава любого состава между с и с2. Так, сплав состава с1 при охлаждении до температуры tп претерпевает превращение, при котором часть твердого раствора α взаимодействует с оставшимся жидким металлом с образованием твердого раствора β. Это превращение называется перитектическим. В результате ниже линии СD мы имеем смесь обоих твердых растворов. Сказанное поясняется схемой фазового превращения сплава состава с1. Как видно из рис. 16, кристаллиты α-твердого раствора после окончания кристаллизации оказываются заключенными внутри кристаллитов β - твердого раствора.
Правило отрезков позволяет определить количество оставшегося твердого раствора α. Действительно, если к моменту начала превращения масса α была
![]() ,
,
то после превращения α осталось
![]() .
.
Сама перитектическая реакция для любой концентрации между с и c2 может быть изображена так:
α+ Ж→β + αизб,
где αизб — избыточное количество α, оставшееся после реакции.
Можно показать, что при исходном составе сплава с3 перитектическое превращение происходит по реакции
α+ Ж→β + Ж изб.
Это означает, что по линии DЕ не весь жидкий металл переходит в перитектику. Избыток его при дальнейшем охлаждении кристаллизуется в β-твердый раствор. И только при концентрации c2 соотношение α и Ж отвечает полному превращению без избыточных количеств фаз, дающих перитектику:
α + Ж → β.
Таким образом, в рассмотренной диаграмме линией солидуса является линия АСDВ, а линией перитектики — СDЕ. Диаграмма с перитектикой встречается при рассмотрении системы железо - углерод.
