
- •Глава 1. Основы металловедения
- •Кристаллизация и структура металлов
- •Строение металла
- •1.1.2. Кристаллизация металла
- •1.1.3. Изменение структуры металла
- •1.1.4. Изучение структуры металла
- •1.2. Строение сплавов
- •1.2.1. Правило фаз
- •1.2.2. Сплав - механическая смесь
- •1.2.3. Сплав - твердый раствор
- •1.2.4. Сплав - химическое соединение
- •1.2.5. Тройные сплавы
- •1.2.6. Электролитические сплавы
- •1.3. Свойства сплавов
- •Глава 2. Коррозия металлов
- •2.1. Определение и методы исследования коррозии
- •2.1.1. Классификация коррозионных процессов
- •2.1.2. Методы оценки коррозии
- •2.1.3. Методы коррозионных исследований
- •2.2. Химическая коррозия
- •2.2.1. Внешние факторы газовой коррозии
- •2.2.2. Оксидные пленки
- •2.2.3. Методы защиты от газовой коррозии
- •2.2.4. Коррозия в неэлектролитах
- •2.3. Электрохимическая коррозия
- •2.3.1. Причины возникновения коррозии
- •2.3.2. Коррозионная диаграмма Эванса
- •2.3.3. Коррозия с водородной и кислородной деполяризацией
- •2.3.4. Влияние внешних факторов на скорость коррозии
- •2.3.5. Влияние внутренних факторов на скорость коррозии
- •2.3.6. Атмосферная коррозия
- •2.3.7. Морская коррозия
- •2.3.8. Подземная коррозия
- •2.3.9. Электрокоррозия
- •2.4. Методы защиты от электрохимической коррозии
- •2.4.1. Обработка коррозионной среды
- •2.4.2. Катодная защита
- •2.4.3. Протекторная защита
- •2.4.4. Анодная защита
- •Глава 3. Коррозионные процессы в нефтегазовом комплексе и методы предотвращения коррозии
- •3.1. Особенности эксплуатации металлов в процессе транспортировки и хранения нефти, нефтепродуктов и газа
- •3.2. Коррозия металлов при контактировании с нефтепродуктами
- •3.3. Рациональный выбор конструкционных материалов
- •3.4. Применение органических покрытий с целью предотвращения коррозии газонефтепроводов
- •3.5. Методы электрохимической защиты трубопроводов
- •3.6. Защита трубопроводов от блуждающих токов
- •3.7. Методы защиты трубопроводов от внутренней коррозии
- •Глава 1. Основы металловедения…………………….4
- •Глава 2.Коррозия металлов……………………………...41
- •Глава 3. Коррозионные процессы в нефтегазовом комплексе и методы предотвращения коррозии……………………………………………….……109
- •394026 Воронеж, Московский просп., 14
2.1.3. Методы коррозионных исследований
Результаты коррозионного исследования не исчерпываются ответом на вопрос, как быстро разрушится та или иная деталь в тех или иных условиях испытаний? Более глубокий подход требует выяснения механизма коррозии, определения стадий, лимитирующих скорость процесса, нахождения факторов, влияющих на коррозионное поведение образца. По результатам коррозионных испытаний важно составить полное представление о возможных и наиболее эффективных методах защиты от коррозии.
Первым этапом коррозионных исследований могут быть испытания лабораторных образцов или реальных деталей с целью определить изменение скорости коррозии во времени. При этом применяются все те методы количественной оценки, о которых говорилось выше. Испытания могут быть лабораторные, натурные и эксплуатационные.
Лабораторные испытания проводят, как правило, с образцами небольших размеров (например, пластинки размером 50х25 мм или цилиндрики диаметром 10-20 мм и высотой 40 мм). Условия испытаний заранее устанавливаются и строго контролируются. Результаты при применении соответствующих методик можно получать в ходе испытания и достаточно точно оценивать количественно. Наконец, возможно искусственное ускорение испытания путем ужесточения коррозионных условий. Этого можно достичь повышением температуры, увеличением концентрации коррозионной среды или перемешиванием.
Натурные испытания проводят в естественных условиях - в море, грунте, атмосфере. Натурные испытания отличаются прежде всего длительностью: их продолжительность может достигать десятков лет. Условия испытаний, естественно, подвержены колебаниям, которые нельзя заранее предугадать, а нередко и достаточно точно проконтролировать. Результаты этих испытаний в каждом конкретном случае достаточно надежны и практически важны, но их научная ценность весьма относительна.
Эксплуатационные испытания проводят путем наблюдений за деталью в условиях ее фактической службы. Испытаниям могут подвергаться или реальные детали работающей системы, или образцы, искусственно встроенные в действующую систему (например, участок трубы из испытываемого материала, вмонтированный в действующую водопроводную магистраль). Получаемые результаты в подобных случаях наиболее надежны, но проведение самих испытаний часто встречает серьезные трудности методического характера. Далеко не всегда удается технически грамотно встроить испытываемую деталь и достаточно точно оценить скорость коррозии.
Наряду с испытаниями, задача которых получение зависимости показатель коррозии - время, существуют и другие методы исследования. Важнейшие среди них электрохимические методы, позволяющие достаточно оперативно выяснить вопросы кинетики и механизма процесса.
Одним из распространенных является метод снятия потенциальной кривой в процессе коррозии исследуемого металла. Измерение потенциала производится любым из известных способов, например с помощью катодного вольтметра или с применением самопишущего электронного потенциометра, что особенно удобно. Более полную картину дает построение анодной и катодной гальваностатических поляризационных кривых в условиях, соответствующих реальным (состав коррозионной среды, температура, обработка металла, состояние поверхности и др.). Обе кривые можно снимать одновременно, для чего катод и анод изготовляют из одного и того же материала. По характеру поляризационных кривых судят о поляризуемости исследуемого металла в качестве катода и анода, о возможной роли катодных и анодных реакций в процессе коррозии.
Семейства поляризационных кривых в зависимости от рН и состава раствора, добавок, температуры и других факторов позволяют получить важные сведения о влиянии этих факторов на скорость процесса, выделить стадии, лимитирующие скорость коррозии, дают возможность разработать наиболее эффективные методы защиты от коррозии.
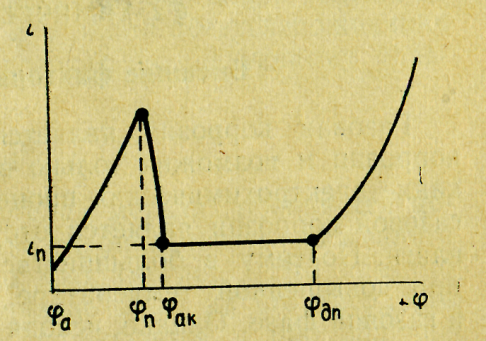
Рис. 23. Типичная анодная потенциостатическая кривая:
φа - потенциал активного анода; φп - потенциал начала пассивации; φак - потенциал активации (Фладе-потенциал); φпп - потенциал перепассивации; iп — плотность тока полной пассивации
При исследовании металлов, склонных к пассивации, метод снятия гальваностатических кривых является несовершенным. Он искажает истинную картину чередования анодных реакций. В подобных случаях используют метод снятия потенциостатических поляризационных кривых.
Типичная потенциостатичеекая кривая, построенная по данным зависимости ток - время для ряда значений потенциала дана на рис. 23. Судя по рисунку, при смещении потенциала вправо, в область положительных значений в интервале φа - φп. скорость анодного растворения металла возрастает. После достижения потенциала начала пассивации φп процесс начинает резко тормозиться, скорость анодной реакции падает до iп, наступает пассивация металла; iп называется плотностью тока полной пассивации. Потенциал φак - это так называемый Фладе-потенциал, или потенциал активации; название станет понятным, если иметь в виду, что при незначительном смещении потенциала влево от φак (т. е. в катодную область) состояние пассивности нарушается, скорость анодного растворения металла резко возрастает.
При достижении потенциала перепассивации φпп наступает состояние транспассивности (или перепассивации), металл приобретает способность растворяться со все возрастающей скоростью. Электродные реакции при транспассивном состоянии отличаются от реакций в области анодной активности φа - φп. При растворении металла образуются ионы более высокой валентности. В некоторых случаях наступает вторая область пассивности или же начинается анодное выделение кислорода.
Данные, получаемые методом снятия потенциостатической кривой, не только выявляют области активного и пассивного состояния металла в зависимости от условий, но и позволяют обосновать целесообразность анодной защиты и найти ее параметры, о чем пойдет речь ниже.
