
- •Глава 1. Основы металловедения
- •Кристаллизация и структура металлов
- •Строение металла
- •1.1.2. Кристаллизация металла
- •1.1.3. Изменение структуры металла
- •1.1.4. Изучение структуры металла
- •1.2. Строение сплавов
- •1.2.1. Правило фаз
- •1.2.2. Сплав - механическая смесь
- •1.2.3. Сплав - твердый раствор
- •1.2.4. Сплав - химическое соединение
- •1.2.5. Тройные сплавы
- •1.2.6. Электролитические сплавы
- •1.3. Свойства сплавов
- •Глава 2. Коррозия металлов
- •2.1. Определение и методы исследования коррозии
- •2.1.1. Классификация коррозионных процессов
- •2.1.2. Методы оценки коррозии
- •2.1.3. Методы коррозионных исследований
- •2.2. Химическая коррозия
- •2.2.1. Внешние факторы газовой коррозии
- •2.2.2. Оксидные пленки
- •2.2.3. Методы защиты от газовой коррозии
- •2.2.4. Коррозия в неэлектролитах
- •2.3. Электрохимическая коррозия
- •2.3.1. Причины возникновения коррозии
- •2.3.2. Коррозионная диаграмма Эванса
- •2.3.3. Коррозия с водородной и кислородной деполяризацией
- •2.3.4. Влияние внешних факторов на скорость коррозии
- •2.3.5. Влияние внутренних факторов на скорость коррозии
- •2.3.6. Атмосферная коррозия
- •2.3.7. Морская коррозия
- •2.3.8. Подземная коррозия
- •2.3.9. Электрокоррозия
- •2.4. Методы защиты от электрохимической коррозии
- •2.4.1. Обработка коррозионной среды
- •2.4.2. Катодная защита
- •2.4.3. Протекторная защита
- •2.4.4. Анодная защита
- •Глава 3. Коррозионные процессы в нефтегазовом комплексе и методы предотвращения коррозии
- •3.1. Особенности эксплуатации металлов в процессе транспортировки и хранения нефти, нефтепродуктов и газа
- •3.2. Коррозия металлов при контактировании с нефтепродуктами
- •3.3. Рациональный выбор конструкционных материалов
- •3.4. Применение органических покрытий с целью предотвращения коррозии газонефтепроводов
- •3.5. Методы электрохимической защиты трубопроводов
- •3.6. Защита трубопроводов от блуждающих токов
- •3.7. Методы защиты трубопроводов от внутренней коррозии
- •Глава 1. Основы металловедения…………………….4
- •Глава 2.Коррозия металлов……………………………...41
- •Глава 3. Коррозионные процессы в нефтегазовом комплексе и методы предотвращения коррозии……………………………………………….……109
- •394026 Воронеж, Московский просп., 14
2.3.2. Коррозионная диаграмма Эванса
Качественные
закономерности процесса коррозии
принято рассматривать на поляризационных
коррозионных диаграммах Эванса,
построенных в координатах потенциал
- ток. В рассматриваемом на рис. 28, а
случае
ток коррозии должен быть равен
![]() .
Если же сопротивление коррозионной
среды и переходное сопротивление между
катодными и анодными участками металла
достаточно велики, то коррозионный ток
снизится до I1.
Тогда величина ΔUR
будет
представлять собой общее омическое
падение напряжения в цепи коррозионного
элемента. В первом случае поверхность
металла эквипотенциальная, во втором
нет.
.
Если же сопротивление коррозионной
среды и переходное сопротивление между
катодными и анодными участками металла
достаточно велики, то коррозионный ток
снизится до I1.
Тогда величина ΔUR
будет
представлять собой общее омическое
падение напряжения в цепи коррозионного
элемента. В первом случае поверхность
металла эквипотенциальная, во втором
нет.
Таким образом, коррозионная диаграмма показывает, что величина тока коррозии зависит не только от значений равновесных потенциалов катода и анода, не только от поляризуемости электродов, но и от омического сопротивления в цепи. Вклад катодной, анодной и омической составляющей в коррозионный процесс может быть далеко не одинаковым. Ту составляющую, которая лимитирует процесс, оказывая наибольшее влияние на величину тока коррозии, принято называть контролирующей.
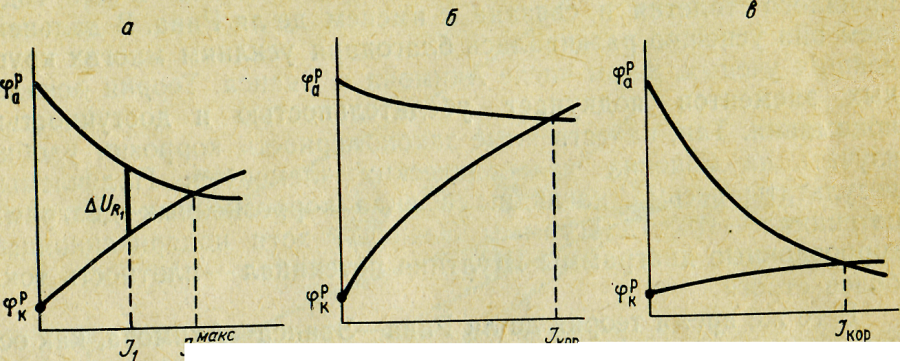 Рис.
28. Коррозионные диаграммы Эванса для
коррозии при смешанном (а),
катодном (б)
и анодном (в)
контроле
Рис.
28. Коррозионные диаграммы Эванса для
коррозии при смешанном (а),
катодном (б)
и анодном (в)
контроле
Значительная поляризуемость катодной реакции при малой поляризуемости анодной (рис. 28, б) указывает на катодный контроль коррозии. На рис. 28, в дана коррозионная диаграмма для случая анодного контроля. Если же решающую роль играет омическое сопротивление, то говорят об омическом контроле процесса.
Определить контролирующую составляющую коррозии не всегда удается визуально. Тогда прибегают к графическому анализу коррозионной диаграммы, показанному на рис. 29. На рисунке обозначены катодная поляризация ΔUK, анодная поляризация ΔUа и омическое падение напряжения ΔUR. Степень контроля процесса может быть оценена из сравнения этих величин, отнесенных к разности равновесных потенциалов коррозионного элемента:
![]()
![]()
![]() .
.
Если ни одно из значений не имеет явного преимущества, то контроль определяется как смешанный (смешанный катодно-анодный, смешанный катодно-омический) (рис. 28, а).
Равновесные потенциалы электродных реакций и сопротивление цепи, а также поляризуемость электрода зависят в свою очередь от природы, состава и свойств металла и электролита (коррозионной среды), а также от внешних условий, таких, как температура, перемешивание и др. Таким образом, на скорость коррозии металла будут влиять фактически самые разнообразные факторы, среди которых различают внешние и внутренние. К внешним факторам относят все, связанное с коррозионной средой, к внутренним - все, связанные с металлом.
Чтобы лучше понять влияние различных факторов на скорость коррозии, остановимся на особенностях двух основных типов катодной коррозионной реакции.
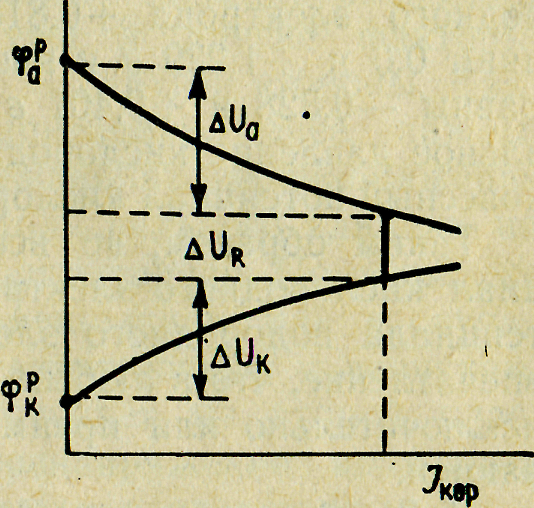
Рис. 29. Графический анализ коррозионной диаграммы Эванса
2.3.3. Коррозия с водородной и кислородной деполяризацией
Коррозию принято называть коррозией с водородной деполяризацией или коррозией с кислородной деполяризацией в зависимости от того, является ли катодной реакцией восстановление ионов водорода или восстановление молекулярного кислорода. Это два основных и наиболее вероятных типа электрохимической коррозии, поскольку водный электролит всегда содержит те или иные количества как водородных ионов, так и растворенного кислорода воздуха. Если обе катодные реакции идут параллельно с соизмеримой скоростью, то говорят о коррозии со смешанной деполяризацией. Коррозионный процесс с иными катодными реакциями, встречается гораздо реже и специального названия не имеет.
Термодинамическая возможность протекания того или иного типа коррозии, как уже отмечалось, определяется соотношением равновесных потенциалов электродных реакций. Из уравнения Нернста вытекает, что равновесные потенциалы каждой из реакций при комнатной температуре выражаются следующими несложными зависимостями:
2H++2e→H2
![]() =
=
![]() ln
ln
![]() ≈ -0.06 pH,
≈ -0.06 pH,
O2+2H2O+4e→4OH-
![]() =
φ0
+
ln
aH+
≈
1.23-0.06 pH.
=
φ0
+
ln
aH+
≈
1.23-0.06 pH.
Нетрудно найти, что в нейтральной среде (рН = 7) равновесный потенциал водородного электрода равен - 0,414В и кислородного электрода +0,815 В; при рН = 0 эти потенциалы составляют 0,0 и +1,229 В соответственно и называются стандартными; при рН = 14 потенциалы равны 0,828 и +0,401 В соответственно. В атмосфере парциальное давление кислорода составляет 0,21 атм; при этом равновесный потенциал кислородного электрода снижается на 0,01В.
Таким образом, во всем интервале рН равновесный потенциал кислородного электрода положительнее равновесного потенциала водородного электрода на 1,23 В. Может сложиться впечатление, что в любых условиях коррозия должна протекать исключительно или преимущественно с кислородной деполяризацией.
Действительно, термодинамически коррозия с водородной деполяризацией менее вероятна. Однако реализация термодинамической возможности определяется кинетическими факторами, которые влияют на поляризуемость электрода или, иначе, на перенапряжение электродных реакций. Как известно, перенапряжение, включая и концентрационную поляризацию, зависит от состава и концентрации электролита, от наличия в нем поверхностно-активных веществ, от температуры, давления, а также от скорости самого процесса. Все эти факторы и определяют окончательно тип коррозии в данных конкретных условиях.
Коррозия с водородной деполяризацией протекает обычно в растворах с высокой активностью водородных ионов или низкой активностью ионов корродирующего металла, а также при коррозии наиболее электроотрицательных металлов (щелочных, щелочноземельных, лантанидов).
Напомним, что для водородного электрода характерно перенапряжение, связанное с химической поляризацией и определяемое замедленной стадией разряда водородного иона. Поэтому те или иные причины, снижающие перенапряжение выделения водорода на металле, увеличивают скорость коррозии. Так, чистые металлы корродируют гораздо медленнее, чем металлы с примесями, смещающими в катодную сторону потенциал выделения водорода. И наоборот, все, что повышает перенапряжение выделения водорода, тормозит скорость коррозии. Перемешивание коррозионной среды не оказывает существенного влияния на скорость процесса.
Коррозия с кислородной деполяризацией широко распространена в нейтральной среде или при небольшом сдвиге рН в ту или иную сторону от 7. Характерной особенностью является определяющая роль концентрационной катодной поляризации, которая лимитирует скорость коррозии в целом. Это объясняется двумя обстоятельствами: малой концентрацией кислорода (из-за низкой его растворимости в электролитах) и незначительной скоростью диффузии кислорода.
Поэтому, в отличие от коррозии с водородной деполяризацией, здесь на скорость процесса заметное влияние оказывает перемешивание, повышение температуры и другие факторы, способствующие ускорению диффузии. С другой стороны, факторы, влияющие на химическую поляризацию, менее важны. Так, наличие примесей в металле, снижающих перенапряжение ионизации кислорода, не оказывает столь сильного влияния на скорость коррозии с кислородной деполяризацией. По этим же причинам при очень энергичном перемешивании или в случае очень тонких слоев электролита, контактирующего с воздухом, механизм диффузионной кинетики отступает на второй план. Решающую роль начинает играть перенапряжение ионизации кислорода со всеми вытекающими отсюда последствиями.
В промежуточных условиях (не слишком сильное перемешивание, некая средняя толщина слоя электролита) коррозия протекает по смешанному механизму.
Появление коррозии с кислородно-водородной деполяризацией зависит не только от соотношения равновесных потенциалов металла, кислородного и водородного электродов, но и от условий, определяющих наклон поляризационных кривых и величину диффузионного тока. Влияние взаимного расположения поляризационных кривых на скорость коррозионного процесса можно проследить по поляризационной диаграмме рис. 30.
Металл
МеI
, судя по соотношению равновесных
потенциалов ![]() и
и
![]() ,
может корродировать только с кислородной
деполяризацией. Скорость коррозии
определяется током
,
может корродировать только с кислородной
деполяризацией. Скорость коррозии
определяется током
![]() (предельным током), величина которого
зависит от скорости диффузии
растворенного кислорода к поверхности
металла.
(предельным током), величина которого
зависит от скорости диффузии
растворенного кислорода к поверхности
металла.
Равновесный потенциал металла МеII по сравнению с МеI более электроотрицателен, тем не менее скорость коррозии каждого из металлов, как видно из рисунка, определяется все тем же предельным током диффузии кислорода. Именно в этом смысле природа металла, как и степень его чистоты, не имеет существенного значения при коррозии с кислородной деполяризацией - конечно, в известных пределах. Впрочем, металл МеII термодинамически способен корродировать со смешанной деполяризацией, потому что его равновесный потенциал отрицательнее равновесного потенциала реакции восстановления водорода.
Наконец, потенциал металла МеIII настолько сдвинут в отрицательную сторону, что становится возможным протекание совместного разряда водородных ионов до водорода, как и молекул кислорода до гидроксид-ионов. Каждая электродная реакция идет со своей скоростью: первая - со скоростью iH , вторая - со скоростью .
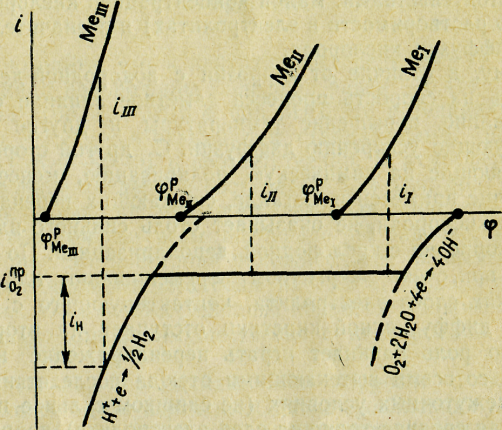
Рис. 30. Поляризационная диаграмма коррозии трех различных металлов с кислородной и кислородно-водородной деполяризацией
Скорость коррозионного процесса iК будет равна
iК= + iH.
Как видно из рис. 30, в данном случае эти скорости соизмеримы по величине, но определяющей является реакция восстановления водорода. Именно изменение величины перенапряжения выделения водорода способно увеличить или уменьшить скорость коррозии.
